名校
解题方法
1 . 某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置,请回答下列问题:
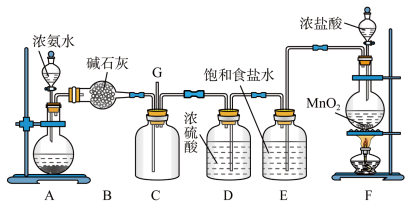
(1)该实验中没有涉及到的物质类别是_______。
(2)NaCl属于_______ 化合物(选填“共价”“离子”)。
(3)写出氯气的电子式_______ ;半径大小N_______ Cl(选填“>”、“<”)。
(4)一水合氨是_______ 电解质(选填“强”、“弱”)其电离方程式为_______ 。
(5)装置D的作用是_______ 。
(6)通入C装置的物质经过反应后不可能得到_______ 。
A. N2 B. NH4Cl C. MnCl2
(7)装置A圆底烧瓶中固体可为生石灰,简述其作用_______ 。
(8)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?_______ 。

(1)该实验中没有涉及到的物质类别是_______。
| A.酸 | B.碱 | C.盐 | D.金属 |
(3)写出氯气的电子式
(4)一水合氨是
(5)装置D的作用是
(6)通入C装置的物质经过反应后不可能得到
A. N2 B. NH4Cl C. MnCl2
(7)装置A圆底烧瓶中固体可为生石灰,简述其作用
(8)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
您最近一年使用:0次
名校
解题方法
2 . 测定铜的相对原子质量。氨气是一种无色、有强烈的刺激气味的气体。氨气具有还原性,可以与灼热的氧化铜反应可得到氮气和金属铜。某课外小组利用该反应和下列装置测定Cu的相对原子质量。

(1)按正确的顺序连接上述实验装置:___________ 。
(2)在使用石英管进行加热时,需要对通入石英管的气体进行干燥,否则在较高的温度下,若气体不纯则有可能引起装置炸裂。D装置为U形干燥管,其目的就是干燥氨气,防止通入C中引起石英管破裂。B中可选用的干燥剂是
(3)C试管被用于制备反应所需要的氨气,其中盛装的是足量的氯化铵和氢氧化钙的混合物。C中的反应的化学方程式为___________ 。
(4)B中观察到的现象是___________ ,实验时,E中收集到的物质是___________ 。
(5)为准确测定铜的相对原子质量,课外小组正确组建装置进行实验,并在实验中测得如下数据:
①实验前,称量空B管的质量为ag:
②在B管中装入药品,称得B管和CuO样品的总质量为bg:
③待充分加热后,撤去酒精灯,使B管和Cu粉冷却到室温,再称量其总质量为cg。
根据以上数据,列出计算Cu的相对原子质量的计算式: =
=___________ 。(用含字母的代数式表示)

(1)按正确的顺序连接上述实验装置:
(2)在使用石英管进行加热时,需要对通入石英管的气体进行干燥,否则在较高的温度下,若气体不纯则有可能引起装置炸裂。D装置为U形干燥管,其目的就是干燥氨气,防止通入C中引起石英管破裂。B中可选用的干燥剂是
| A.浓硫酸 | B.无水 | C.无水硫酸铜 | D.碱石灰 |
(4)B中观察到的现象是
(5)为准确测定铜的相对原子质量,课外小组正确组建装置进行实验,并在实验中测得如下数据:
①实验前,称量空B管的质量为ag:
②在B管中装入药品,称得B管和CuO样品的总质量为bg:
③待充分加热后,撤去酒精灯,使B管和Cu粉冷却到室温,再称量其总质量为cg。
根据以上数据,列出计算Cu的相对原子质量的计算式:
 =
=
您最近一年使用:0次
3 . 以下工业上或实验室中“反应/催化剂”的关系不符合事实的是( )
| A.合成氨/五氧化二钒 | B.乙醇氧化/铜 |
| C.氨催化氧化/三氧化二铬 | D.乙醇脱水/浓硫酸 |
您最近一年使用:0次
名校
4 . 某研究小组利用下图装置探究温度对氨气还原 Fe2O3的影响(固定装置略)。完成下列填空:
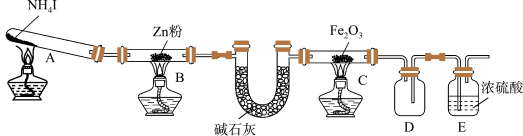
(1)实验时 A 中有大量紫红色的烟气,则 NH4I 的分解产物为___ (至少填三种),E装置的作用是___ 。
(2)装置B中的反应方程式:______ ,D装置的作用是______ 。
某研究小组按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置 C 加热,反应产物均为黑色粉末(纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
(3)乙组得到的黑色粉末是______ 。
(4)甲组步骤1中反应的离子方程式为______ 。
(5)乙组步骤3中,溶液变红的原因为______ ;溶液褪色可能的原因及其验证方法为______ 。
(6)若装置C中Fe2O3反应后的产物是两种氧化物组成的混合物,为研究氧化物的组成,研究小组取样品7.84克在加热条件下通入氨气,完全反应后,停止加热,反应管中铁粉冷却后,称得质量为5.6克,则混合物的组成为______ 。

(1)实验时 A 中有大量紫红色的烟气,则 NH4I 的分解产物为
(2)装置B中的反应方程式:
某研究小组按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置 C 加热,反应产物均为黑色粉末(纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤 1 中溶液,滴加 KSCN 溶液 | 变红 | 无现象 |
| 3 | 向步骤 2 溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
(4)甲组步骤1中反应的离子方程式为
(5)乙组步骤3中,溶液变红的原因为
(6)若装置C中Fe2O3反应后的产物是两种氧化物组成的混合物,为研究氧化物的组成,研究小组取样品7.84克在加热条件下通入氨气,完全反应后,停止加热,反应管中铁粉冷却后,称得质量为5.6克,则混合物的组成为
您最近一年使用:0次
2019-11-07更新
|
181次组卷
|
3卷引用:上海市复旦大学附中2017-2018学年高二上学期期中考试化学试题
5 . 如图是模拟工业制硝酸原理的实验装置。先用酒精灯对硬质玻璃管里的三氧化二铬加热,然后把空气鼓入盛有浓氨水的锥形瓶,当三氧化二铬保持红热状态时,移去酒精灯。根据题意回答问题:

(1)硬质玻璃管里发生反应的化学方程式为______ 。当三氧化二铬红热时,要移去酒精灯,原因是:______ 。
(2)圆底烧瓶里的实验现象是______ ,鼓入空气的作用是______ 。
(3)实验过程中,如果慢慢地鼓入空气,石蕊溶液的颜色______ 。
(4)实验结束后,在圆底烧瓶内壁上有时会看到少量无色晶体,写出生成该晶体的化学方程式:______ 。
(5)工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁或浓硫酸,然后______ (填一种操作名称)。
(6)实验室里保存浓硝酸要用棕色瓶的原因是__________________ (用化学方程式表示)。

(1)硬质玻璃管里发生反应的化学方程式为
(2)圆底烧瓶里的实验现象是
(3)实验过程中,如果慢慢地鼓入空气,石蕊溶液的颜色
(4)实验结束后,在圆底烧瓶内壁上有时会看到少量无色晶体,写出生成该晶体的化学方程式:
(5)工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁或浓硫酸,然后
(6)实验室里保存浓硝酸要用棕色瓶的原因是
您最近一年使用:0次
2019-10-25更新
|
77次组卷
|
2卷引用:上海市嘉定区交附2018-2019学年高二上学期开学摸底考化学试题
6 . 下列关于氨气的叙述中,错误的是
| A.氨气遇浓盐酸冒白烟 |
| B.氨气在一定的条件下能被氧气氧化 |
| C.氨气能使干燥的蓝色石蕊试纸变红色 |
| D.氨气能使酚酞试液变红色 |
您最近一年使用:0次
2019-06-23更新
|
290次组卷
|
2卷引用:2019年上海市浦东新区高中学业水平合格考试(模拟)化学试题
解题方法
7 . 硝酸工业尾气中的氮氧化合物NOx(NO、NO2、N2O4)常用的处理方法有以下两种:
①碱液(Na2CO3或NaOH溶液)吸收法。用Na2CO3溶液吸收反应原理如下:
NO + NO2 + Na2CO3 = 2NaNO2 + CO2;2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
②氨的催化氧化法,反应原理是:NOx + NH3 N2 + H2O
N2 + H2O
现将标准状况下2.016 L氮氧化合物NOx 通入50 mL 1.0 mol·L-1的Na2CO3溶液,恰好反应完全,且测得反应后溶液中n(NO )∶n(NO
)∶n(NO ) = 4∶1,下列说法正确的是
) = 4∶1,下列说法正确的是
①碱液(Na2CO3或NaOH溶液)吸收法。用Na2CO3溶液吸收反应原理如下:
NO + NO2 + Na2CO3 = 2NaNO2 + CO2;2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
②氨的催化氧化法,反应原理是:NOx + NH3
 N2 + H2O
N2 + H2O现将标准状况下2.016 L氮氧化合物NOx 通入50 mL 1.0 mol·L-1的Na2CO3溶液,恰好反应完全,且测得反应后溶液中n(NO
 )∶n(NO
)∶n(NO ) = 4∶1,下列说法正确的是
) = 4∶1,下列说法正确的是| A.混合气体中V(N2O4) = 0.336 L |
| B.混合气体中n(NO)∶n(NO2) = 1∶5 |
| C.NOx能够完全被Na2CO3溶液吸收,则x ≤ 1.5 |
D.如采用氨的催化氧化法处理,理论消耗n(NH3) = 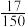 mol mol |
您最近一年使用:0次
2019-03-04更新
|
383次组卷
|
3卷引用:沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题3
8 . A、B、C、D是中学化学中常见的物质,已知C 为红棕色气体,它们之间的相互转化关系如下(部分反应条件及产物已略去)。

(1)若A为单质,则A的化学式为_________ ,试写出C→D反应的化学方程式:_________ 。
(2)A亦可为NH3,它与O2 在高温、催化剂的作用下反应生成B,此化学方程式为_________ 。

(1)若A为单质,则A的化学式为
(2)A亦可为NH3,它与O2 在高温、催化剂的作用下反应生成B,此化学方程式为
您最近一年使用:0次
2018-01-09更新
|
379次组卷
|
2卷引用:沪科版化学拓展性课程5《非金属元素》测试题



