名校
1 . 工业上制备下列物质的生产流程合理的是
A.工业制硝酸: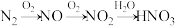 |
B.生产硅:石英砂 粗硅 粗硅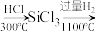 (纯) (纯) |
C.工业制硫酸:   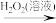  (溶液) (溶液) |
D.由铝土矿冶炼铝:铝土矿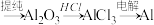 |
您最近一年使用:0次
2 . 下列物质的转化在给定条件下能实现的有
①
②
③
④
⑤饱和NaCl溶液
①

②

③

④

⑤饱和NaCl溶液

| A.1个 | B.2个 | C.3个 | D.4个 |
您最近一年使用:0次
3 . 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X和H是固体,B和G是液体,其余均为气体,1molX分解得到A、B、C各1mol。

试解答下列各题:
(1)写出下列物质的化学式:A_______ ,G_______ 。
(2)写出下列反应的化学方程式:
反应①:_______ 。
反应③:_______ 。
反应⑤:_______ 。
(3)写出下列反应的离子方程式:
反应②(足量烧碱):_______ 。
反应④:_______ 。
(4)反应⑥中氧化剂与还原剂的物质的量之比是_______ 。
(5)通过实验检验X中的阳离子的方法:取少量试样于试管中,_______ 。

试解答下列各题:
(1)写出下列物质的化学式:A
(2)写出下列反应的化学方程式:
反应①:
反应③:
反应⑤:
(3)写出下列反应的离子方程式:
反应②(足量烧碱):
反应④:
(4)反应⑥中氧化剂与还原剂的物质的量之比是
(5)通过实验检验X中的阳离子的方法:取少量试样于试管中,
您最近一年使用:0次
名校
解题方法
4 . 关于下述工业生产过程中说法不正确的是
| A.工业生产硫酸时在吸收塔中常用98.3%的硫酸来吸收三氧化硫 |
| B.工业上用焦炭还原石英砂可以制得含有少量杂质的粗硅 |
| C.氨的催化氧化是工业制硝酸的基础 |
| D.将氯气通入石灰水中便可制得漂白粉 |
您最近一年使用:0次
5 . 氮及其化合物的转化具有重要应用。下列说法不正确 的是
A.自然固氮、人工固氮都是将 转化为 转化为 |
B.侯氏制碱法以 、 、 、 、 、 、 为原料制备 为原料制备 和 和 |
C.工业上通过 催化氧化等反应过程生产 催化氧化等反应过程生产 |
| D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环” |
您最近一年使用:0次
2022-07-21更新
|
8599次组卷
|
27卷引用:黑龙江省哈尔滨市第三中学2023-2024学年高二上学期开学测试化学试题
黑龙江省哈尔滨市第三中学2023-2024学年高二上学期开学测试化学试题(已下线)第07练 元素及其化合物基础知识和应用 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题05 元素及其化合物-2022年高考真题模拟题分项汇编江苏省2022年普通高中学业水平选择性考试(已下线)第14讲 氮及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)2022年江苏卷高考真题变式题1-13(已下线)第12讲 氮及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点11 氮元素及其化合物-备战2023年高考化学考试易错题甘肃省武威第六中学2022-2023学年高三上学期第三次过关考试化学试题江苏省淮安市高中校协作体2022-2023学年高三上学期期中考试化学试题(已下线)专题08 元素及其化合物(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题10 常见非金属元素的性质及应用-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)江苏省2022年普通高中学业水平选择性考试变式题(选择题6-10)江苏省连云港市赣榆智贤中学2022-2023学年高一3月阶段检测化学试题(已下线)专题卷08 无机物的性质与用途-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)查补易混易错01 元素化合物部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)广东省梅州市大埔县虎山中学2022-2023学年高三上学期12月月考化学试题(已下线)考点11 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)(已下线)专题06 元素及其化合物 -2023年高考化学真题题源解密(新高考专用)江苏省南京市六校联合体2022-2023学年高一下学期5月期中考试化学试题辽宁省部分县级重点中学2023-2024学年高三上学期11月期中考试化学试题江苏省泰州市泰州中学2023-2024学年高三上学期第一次月度检测化学试题天津市滨海新区田家炳中学2023-2024学年高三上学期期中考试化学试题天津市第四中学2023-2024学年高三上学期第二次月考化学试卷江苏省南京师范大学附属中学2023-2024学年高一上学期1月期末化学试题河北省唐山市开滦第二中学2023-2024学年高一下学期4月月考化学试题
6 . 氮元素形成的化合物种类繁多。
(1)请根据以下工业制硝酸及硝酸铵的流程图,回答相关问题。

① 和
和 通过红热的铁纱网(起催化作用)发生反应,该反应的氧化剂是
通过红热的铁纱网(起催化作用)发生反应,该反应的氧化剂是___________ 。
②B装置是氧化炉,发生反应的化学方程式为___________ 。
③写出D中合成硝酸铵的化学方程式___________ 。
④吸收塔C中通入空气的目的是___________ 。
(2)某化学实验小组利用如图装置制备氨气,反应的化学方程式为___________ 。
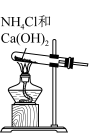
(3)用如图装置收集氨气:打开a、b,关闭c,氨气由___________ (选填“a”或“b”)进入烧瓶。氨气收集满后,关闭a、b,打开c,做喷泉实验,烧瓶内产生红色喷泉,该现象说明了氨气具有的性质是___________ 。

(1)请根据以下工业制硝酸及硝酸铵的流程图,回答相关问题。

①
 和
和 通过红热的铁纱网(起催化作用)发生反应,该反应的氧化剂是
通过红热的铁纱网(起催化作用)发生反应,该反应的氧化剂是②B装置是氧化炉,发生反应的化学方程式为
③写出D中合成硝酸铵的化学方程式
④吸收塔C中通入空气的目的是
(2)某化学实验小组利用如图装置制备氨气,反应的化学方程式为

(3)用如图装置收集氨气:打开a、b,关闭c,氨气由

您最近一年使用:0次
2022-07-15更新
|
283次组卷
|
2卷引用:黑龙江省哈尔滨市宾县第二中学2022-2023学年高二上学期开学考试化学试题
名校
解题方法
7 . 完成下列化学方程式:
(1)C与浓硝酸_______
(2)工业合成氨_______
(3)氨的催化氧化反应_______
请自选试剂完成不同价态含硫物质的转化方程式(化学或离子均可)
(4)S (-2) →S(0)_______
(5)S (+4) →S(+6)_______
(1)C与浓硝酸
(2)工业合成氨
(3)氨的催化氧化反应
请自选试剂完成不同价态含硫物质的转化方程式(化学或离子均可)
(4)S (-2) →S(0)
(5)S (+4) →S(+6)
您最近一年使用:0次
名校
解题方法
8 . 自然界的氮循环包括以下过程。下列说法中,不正确 的是

| A.硝化过程中,含氮物质被氧化 |
| B.氨氧化过程中,亚硝态氮元素与铵态氮元素理论物质的量之比为3:4 |
C.N2→ 属于氮的固定,N2发生还原反应 属于氮的固定,N2发生还原反应 |
| D.土壤中Fe2+和Fe3+的存在有利于从与其接触的水体中除去氮元素 |
您最近一年使用:0次
2022-01-14更新
|
2777次组卷
|
21卷引用:黑龙江省双鸭山市第一中学2021-2022学年高二下学期第一次月考化学试题
黑龙江省双鸭山市第一中学2021-2022学年高二下学期第一次月考化学试题云南省昆明市第三中学2023-2024学年高二上学期第一次综合测试化学试题黑龙江省双鸭山市第一中学2023-2024学年高一下学期4月月考化学试题北京市海淀区2021-2022学年高一上学期期末参考样题化学试题(已下线)章末培优 第5章 化工生产中的重要非金属元素-2021-2022学年高一化学课后培优练(人教版2019必修第二册)福建省安溪县第一中学2021-2022学年高一下学期第一次月考化学试题山东省济宁市兖州区2021-2022学年高一下学期期中考试化学试题辽宁省辽南协作体2021-2022学年高一下学期期中考试化学试题(已下线)北京市第四中学2021-2022学年高一下学期期中考试化学试题湖北省重点高中智学联盟2021-2022学年高一下学期5月联考化学试题山东省临沂第一中学2021-2022学年高一下学期6月月考化学试题山西省运城市景胜中学2021-2022学年高一下学期3月月考化学试题新疆生产建设兵团第一师高级中学2022-2023学年高一下学期4月月考化学试题第五章 化工生产中的重要非金属元素(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册) 湖北省仙桃中学2022-2023学年高一上学期10月月考化学试题北京市第五十中学2022-2023学年高一下学期期中考试化学试题(已下线)考点巩固卷04 非金属及其化合物(4大考点60题)?-2024年高考化学一轮复习考点通关卷(新高考通用)宁夏石嘴山第三中学2023-2024学年高三上学期期中考试化学试题(已下线)第五章 化工生产中的重要非金属元素【单元测试B卷】云南省开远市第一中学校2023-2024学年高一下学期3月月考化学试题北京市第十五中学2023-2024学年高一下学期期中考试化学试题
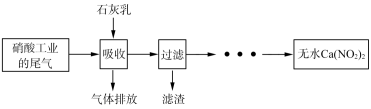
9 . 利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
(1)氨的催化氧化是工业制硝酸的基础。写出反应的化学方程式:_______ 。实验室中将氨气和氧气的混合气体通过红热的铂丝(作催化剂)模拟该反应时,反应过程中铂丝能始终保持红热,这是由于该反应是_______ 反应。
(2)氨催化氧化制得的NO经过氧化为NO2,再与水反应得到硝酸。NO2与水反应生成硝酸的反应中,氧化剂与还原剂的物质的量之比为_______ 。已知NO和NO2的混合气体能被碱液吸收生成亚硝酸盐:NO+NO2+2OH-→ +H2O,则NO2被NaOH溶液完全吸收(无气体剩余)的离子方程式为
+H2O,则NO2被NaOH溶液完全吸收(无气体剩余)的离子方程式为_______ 。
(3)流程中滤渣可循环使用,滤渣的主要成分是_______ (填化学式),已知0℃时Ca(NO3)2在水中的溶解度仍然很大,实验室从Ca(NO3)2溶液得到Ca(NO3)2晶体的操作方法是_______ 。
(4)生产中溶液需保持弱碱性。酸性条件下,Ca(NO2)2溶液会发生反应生成Ca(NO3)2、NO和H2O,该反应的离子方程式为_______ 。

(1)氨的催化氧化是工业制硝酸的基础。写出反应的化学方程式:
(2)氨催化氧化制得的NO经过氧化为NO2,再与水反应得到硝酸。NO2与水反应生成硝酸的反应中,氧化剂与还原剂的物质的量之比为
 +H2O,则NO2被NaOH溶液完全吸收(无气体剩余)的离子方程式为
+H2O,则NO2被NaOH溶液完全吸收(无气体剩余)的离子方程式为(3)流程中滤渣可循环使用,滤渣的主要成分是
(4)生产中溶液需保持弱碱性。酸性条件下,Ca(NO2)2溶液会发生反应生成Ca(NO3)2、NO和H2O,该反应的离子方程式为
您最近一年使用:0次
2021-09-10更新
|
204次组卷
|
2卷引用:黑龙江省大庆市肇州县二校2020-2021学年高二下学期期末联考化学试题
名校
解题方法
10 . 分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略)。其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是


| A.原子半径的大小:m>q>n>p |
| B.元素非金属性:q>p>n |
| C.n和p两元素形成的化合物可能组成离子化合物 |
| D.M和甲反应的另一个产物可能显碱性 |
您最近一年使用:0次
2021-02-28更新
|
359次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2022-2023学年高二下学期3月月考化学试题



