解题方法
1 . 某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
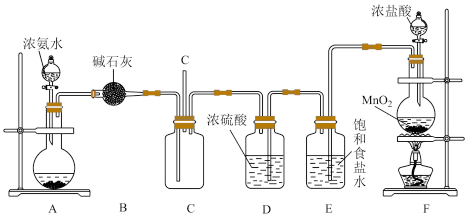
请回答下列问题:
(1)B装置的名称是________________ ;E装置的作用____________________ 。
(2)写出F中发生反应的离子反应方程式__________________________ 。
(3)上述制氨为快速制氨,实验室常用氯化铵和氢氧化钙制备,其化学方程式为:________________ 。
(4)装置A的烧瓶中装有生石灰,随着浓氨水的滴入,氨气产生的原因是_________ 。
(5)通入C装置的两根导管左边较长、右边较短,目的是_____________________________ 。
(6)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:___________________________ 。当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为(用含a、b的代数式表示)________________ 。

请回答下列问题:
(1)B装置的名称是
(2)写出F中发生反应的离子反应方程式
(3)上述制氨为快速制氨,实验室常用氯化铵和氢氧化钙制备,其化学方程式为:
(4)装置A的烧瓶中装有生石灰,随着浓氨水的滴入,氨气产生的原因是
(5)通入C装置的两根导管左边较长、右边较短,目的是
(6)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:
您最近一年使用:0次
2 . Ⅰ.某课外活动小组欲利用CuO与NH3的反应研究NH3的性质与分子组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
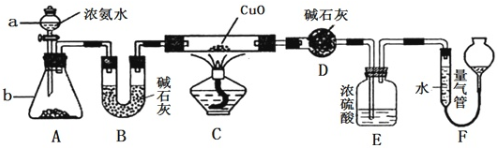
(1)仪器a的名称为________________ ;仪器b中的试剂不能为下列中的____________ (填字母)
A.氧化钙 B.碱石灰 C.石灰石 D.熟石灰
(2)装置B的作用是_______________
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管收集到无色无味的气体,写出装置C中发生反应的化学方程式_______________
(4)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为____________ (用含m、n字母的代数式表示)
Ⅱ.铁是生产生活中常用金属
(1)写出铁与水蒸气的反应方程式______________________________ 。
(2)氯化亚铁溶液在空气中易被氧化,检验溶液是否变质所加试剂为___________ (写化学式),向氯化亚铁溶液中加入烧碱溶液,现象为_________________________

(1)仪器a的名称为
A.氧化钙 B.碱石灰 C.石灰石 D.熟石灰
(2)装置B的作用是
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管收集到无色无味的气体,写出装置C中发生反应的化学方程式
(4)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为
Ⅱ.铁是生产生活中常用金属
(1)写出铁与水蒸气的反应方程式
(2)氯化亚铁溶液在空气中易被氧化,检验溶液是否变质所加试剂为
您最近一年使用:0次
名校
解题方法
3 . 下列框图中的物质均为中学化学常见物质。已知A、B、C均为有刺激性气味的气体,A、B分别通入品红溶液中,红色均褪去;B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色;H为无色气体,I为红棕色气体。反应①需要有水参加,反应②有大量白烟生成。
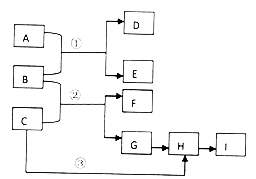
请回答下列问题:
(1)写出下列反应的化学方程式:
反应①_____________________________________ ;
反应②_______________________________________ ;
反应③____________________________________________ ;
(2)用Na2CO3溶液吸收I生成CO2,若9.2g I和Na2CO3溶液完全反应时转移0.1mol电子,则反应的离子方程式为__________________________________ 。

请回答下列问题:
(1)写出下列反应的化学方程式:
反应①
反应②
反应③
(2)用Na2CO3溶液吸收I生成CO2,若9.2g I和Na2CO3溶液完全反应时转移0.1mol电子,则反应的离子方程式为
您最近一年使用:0次
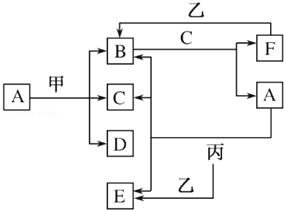
4 . 下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B 能使湿润的红色石蕊试纸变为蓝色,丁为黄绿色气体,丙在丁中燃烧产生苍白色火焰,气体B 与气体C相遇产生大量的白烟生成E,A 是强碱,D 是海水中浓度最高的盐(部分反应物和生成物已略去)。

请回答下列问题:
(1) 写出工业上由乙与丙生成B 的化学方程式:_______________ 。
(2) 写出甲和少量A溶液反应的离子方程式:_______________ 。
(3) 检验E中的阳离子的方法是:_______________ 。
(4) B物质常见用途:_______________ 。(任写两条)
(5) 某工厂用丁制漂白粉,写出制漂白粉的化学方程式:_______________ 。

请回答下列问题:
(1) 写出工业上由乙与丙生成B 的化学方程式:
(2) 写出甲和少量A溶液反应的离子方程式:
(3) 检验E中的阳离子的方法是:
(4) B物质常见用途:
(5) 某工厂用丁制漂白粉,写出制漂白粉的化学方程式:
您最近一年使用:0次
名校
5 . 因为氨气与氧化铜反应产物无污染,所以工业上常用氨气还原氧化铜制取铜。巴蜀中学化学兴趣小组为了模拟该反应并同时完成铜的相对原子质量的测定,设计如下所示的装置图并完成相关实验:
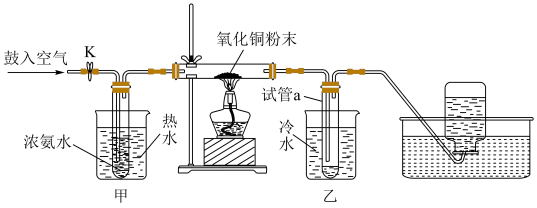
假定,测定铜的相对原子质量的实验过程中,氧化铜充分反应。以下叙述错误的是

假定,测定铜的相对原子质量的实验过程中,氧化铜充分反应。以下叙述错误的是
| A.关闭K的情况下完成实验,测得试管最终收集到的液体质量和氧化铜的质量可以求出铜的相对原子质量 |
| B.关闭K的情况下完成实验,测得氧化铜的粉末的反应前后的质量和最终集气瓶中收集到的气体体积(标准状况下)可以求出铜的相对原子质量 |
C.直型玻璃管中发生的反应为:3CuO+2NH3 N2↑+3Cu+3H2O N2↑+3Cu+3H2O |
| D.若打开K,鼓入空气,直型玻璃管中氧化铜粉末会交替出现黑色变红色,红色变黑色的现象 |
您最近一年使用:0次
2018-04-07更新
|
161次组卷
|
2卷引用:重庆市巴蜀中学2017-2018学年高一下学期3月月考化学试题
名校
6 . 为探究氨气的还原性,某同学设计了下列实验装置( 其中夹持装置略去),在实验室中进行实验探究。回答下列问题:
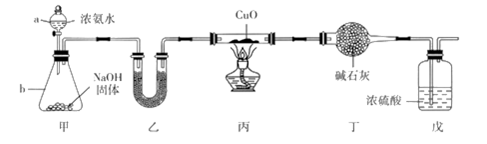
(1)仪器b的名称是_____________________ ,试解释该装置中产生NH3的原理:____________ 。
(2)装置乙中盛有的试剂名称是__________________ 。
(3)装置戊中浓硫酸的作用是_______________________________________________ 。
(4)+1价Cu 在酸性环境中不稳定,可发生反应:Cu2O+2H+==Cu2++Cu + H2O。某同学取上述反应后玻璃管内的物质于试管中,加入稀硫酸,振荡后发现溶液为蓝色,且试管底部有红色Cu,他得出结论:NH3还原CuO生成Cu2O。该同学的判断是否正确?________ (填“正确”或“不正确”),理由是__________________________________________________________________ 。
(5)已知装置丙的玻璃管内CuO粉末为mg,实验结束后测得玻璃管内固体粉末为n g,若CuO 完全被还原 为 Cu,则 m:n=______ ;写出玻璃管内发生反应的化学方程式:__________________ 。装置丁中的干燥管增重为_______ g(用含m 或n 的代数式表示)。

(1)仪器b的名称是
(2)装置乙中盛有的试剂名称是
(3)装置戊中浓硫酸的作用是
(4)+1价Cu 在酸性环境中不稳定,可发生反应:Cu2O+2H+==Cu2++Cu + H2O。某同学取上述反应后玻璃管内的物质于试管中,加入稀硫酸,振荡后发现溶液为蓝色,且试管底部有红色Cu,他得出结论:NH3还原CuO生成Cu2O。该同学的判断是否正确?
(5)已知装置丙的玻璃管内CuO粉末为mg,实验结束后测得玻璃管内固体粉末为n g,若CuO 完全被还原 为 Cu,则 m:n=
您最近一年使用:0次
2018-03-22更新
|
425次组卷
|
4卷引用:重庆市缙云教育联盟2020-2021学年高一下学期期末质量检测化学试题
名校
解题方法
7 . 实验室模拟合成氨和氨催化氧化的流程如下:

已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从如图中选择制取气体的合适装置:氮气________ 、氢气________ 。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有________ 、________ 。


(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,________ (“会”或“不会”)发生倒吸,原因是_________________ 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是________ ,锥形瓶中还可观察到的现象是____________________________ 。
(5)写出乙装置中氨氧化的化学方程式:_____________________________________________ 。
(6)反应结束后锥形瓶内的溶液含有H+、OH-、______ 、________ 离子。

已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从如图中选择制取气体的合适装置:氮气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有


(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是
(5)写出乙装置中氨氧化的化学方程式:
(6)反应结束后锥形瓶内的溶液含有H+、OH-、
您最近一年使用:0次
2017-04-06更新
|
776次组卷
|
8卷引用:重庆市南开中学高一下学期化学人教版第1章《非金属及其化合物》单元测试
重庆市南开中学高一下学期化学人教版第1章《非金属及其化合物》单元测试重庆第二十三中学校2021-2022学年高一下学期第一次月考化学试题2016-2017学年吉林省长春外国语学校高一下学期第一次月考化学试卷(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【教学案】(已下线)第6单元 常见的非金属元素(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷山东省淄博市沂源县第二中学2020-2021学年高一下学期期中考试化学试题云南省丘北县第一中学2021-2022学年高二下学期3月份考试 化学试题山东省淄博市2021-2022学年高一下学期期中考试化学试题
8 . Ⅰ.某课外活动小组欲利用CuO与NH3的反应研究NH3的性质与分子组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为____ ;仪器b中的试剂不能为下列中的_____ (填字母)

(2)装置B的作用是______
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管收集到无色无味的气体,写出装置C中发生反应的化学方程式_____
(4)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为_____ (用含m、n字母的代数式表示)
Ⅱ.铁是生产生活中常用金属
(1)写出铁与水蒸气的反应方程式_____ 。
(2)氯化亚铁溶液在空气中易被氧化,检验溶液是否变质所加试剂为___ (写化学式),向氯化亚铁溶液中加入烧碱溶液,现象为___
(1)仪器a的名称为
| A.氧化钙 | B.碱石灰 | C.石灰石 | D.氢氧化钠 |

(2)装置B的作用是
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管收集到无色无味的气体,写出装置C中发生反应的化学方程式
(4)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为
Ⅱ.铁是生产生活中常用金属
(1)写出铁与水蒸气的反应方程式
(2)氯化亚铁溶液在空气中易被氧化,检验溶液是否变质所加试剂为
您最近一年使用:0次
2017-02-17更新
|
745次组卷
|
2卷引用:2017届重庆市西北狼教育联盟高三12月月考化学试卷
9 . 现有中学化学常见的物质,其中甲、乙、丙是单质,甲为第三周期金属,A、B、C、D、E、F是化合物,B是红棕色气体,C在常温下是无色无味液体,甲元素的原子序数是丙元素原子序数的2倍,它们之间有如图所示的相互转化关系(部分反应条件已略去)。
(1)B的化学式为_____ ,D的化学式为_____ 。
(2)写出A与丙反应的化学方程式:_____ 。
(3)工业上制取A分三步进行,其中两步反应已经在图中得到体现,写出另外一步反应的化学方程式:_____ 。
(4)若9.6g甲与一定量A浓溶液完全反应后,生成标准状况下的8.96L气体中含有的B和F,且甲无剩余,则B和F的物质的量之比为_____ 。

(1)B的化学式为
(2)写出A与丙反应的化学方程式:
(3)工业上制取A分三步进行,其中两步反应已经在图中得到体现,写出另外一步反应的化学方程式:
(4)若9.6g甲与一定量A浓溶液完全反应后,生成标准状况下的8.96L气体中含有的B和F,且甲无剩余,则B和F的物质的量之比为
您最近一年使用:0次
2016-12-09更新
|
281次组卷
|
3卷引用:2015-2016学年重庆四十二中高一下期中化学试卷
名校
解题方法
10 . A、B、C、D是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。

(1)若A是一种黄色单质固体,一定条件下B可以转化为C,则B→C的化学方程式为___________________ 。
(2) 若A是一种活泼金属,C是淡黄色固体,则C的名称为______________ ,C可用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用,请用化学方程式表示该反应原理_____________________________ 。
若生成1mol O2,该反应转移电子的物质的量为____________ 。
(3)若A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体。回答:
①A为___________ (填写化学式)。实验室用两种固体共热制取A,写出此化学方程式:_____________ 。
②D可以转化为B,则D→B反应的离子方程式:________________________ 。

(1)若A是一种黄色单质固体,一定条件下B可以转化为C,则B→C的化学方程式为
(2) 若A是一种活泼金属,C是淡黄色固体,则C的名称为
若生成1mol O2,该反应转移电子的物质的量为
(3)若A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体。回答:
①A为
②D可以转化为B,则D→B反应的离子方程式:
您最近一年使用:0次
2016-12-09更新
|
1530次组卷
|
4卷引用:重庆市开州中学高 2021-2022学年高三上学期10月月考化学试题



