名校
1 . 如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
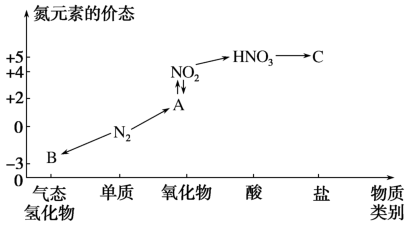
(1)写出N2的一种用途:___________ 。
(2)B物质的电子式为:___________ 。
(3)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为___________ 。
(4)实验室制取物质B的化学方程式为___________ 。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___________ 。
(6)如图装置可用于探究氯气与氨气的反应。实验时先通过三颈瓶瓶口 1 通入氨气,然后关闭 b 活塞,再通过瓶口 2 通入氯气。
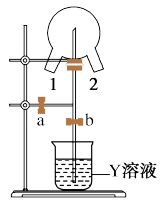
①实验中三颈瓶内出现白烟并在内壁凝结成固体,发生反应的化学方程式为___________ 。
② 实验完毕后,观察到三颈瓶内还有黄绿色气体, 简述如何处理才能不污染环境___________ 。
(7)将3.2 g铜与60.0 mL一定浓度的硝酸发生反应,铜完全溶解,产生NO2和NO混合气体的体积为8.96 L(标况)。待产生的气体全部释放后,向溶液加入100 mL 2.0 mol/L 的 NaOH 溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为___________ mol/L。

(1)写出N2的一种用途:
(2)B物质的电子式为:
(3)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为
(4)实验室制取物质B的化学方程式为
(5)浓硝酸与木炭在加热条件下反应的化学方程式为
(6)如图装置可用于探究氯气与氨气的反应。实验时先通过三颈瓶瓶口 1 通入氨气,然后关闭 b 活塞,再通过瓶口 2 通入氯气。

①实验中三颈瓶内出现白烟并在内壁凝结成固体,发生反应的化学方程式为
② 实验完毕后,观察到三颈瓶内还有黄绿色气体, 简述如何处理才能不污染环境
(7)将3.2 g铜与60.0 mL一定浓度的硝酸发生反应,铜完全溶解,产生NO2和NO混合气体的体积为8.96 L(标况)。待产生的气体全部释放后,向溶液加入100 mL 2.0 mol/L 的 NaOH 溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为
您最近一年使用:0次
解题方法
2 . Ⅰ.硫元素是动植物生长不可缺少的元素,下图是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
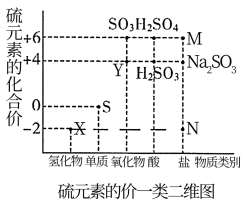
(1)图中X对应的物质是___________ ,将X气体通入 溶液中会出现淡黄色沉淀,反应物
溶液中会出现淡黄色沉淀,反应物 作
作___________ 剂(填“氧化”或“还原”)。
(2)空气中易造成硫酸酸雨的主要气体是___________ (填化学式);
(3)请写出铜和浓硫酸反应的化学方程式___________ 。
Ⅱ.氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:
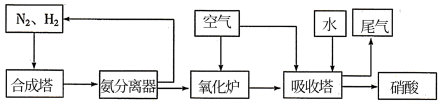
(1)氧化炉中, 转化为NO的化学方程式为
转化为NO的化学方程式为___________ 。
(2)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨的___________ 性质。
(3)写出硝酸的电离方程式___________ 。
(4)吸收塔中出来的尾气可用 溶液吸收,主要反应为:
溶液吸收,主要反应为:
a.
b.
根据反应b,每产生11.2L(标准状况下) ,吸收液质量将增加
,吸收液质量将增加___________ g。

(1)图中X对应的物质是
 溶液中会出现淡黄色沉淀,反应物
溶液中会出现淡黄色沉淀,反应物 作
作(2)空气中易造成硫酸酸雨的主要气体是
(3)请写出铜和浓硫酸反应的化学方程式
Ⅱ.氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:

(1)氧化炉中,
 转化为NO的化学方程式为
转化为NO的化学方程式为(2)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨的
(3)写出硝酸的电离方程式
(4)吸收塔中出来的尾气可用
 溶液吸收,主要反应为:
溶液吸收,主要反应为:a.
b.

根据反应b,每产生11.2L(标准状况下)
 ,吸收液质量将增加
,吸收液质量将增加
您最近一年使用:0次
名校
解题方法
3 . 利用元素的化合价推测物质的性质是化学研究的重要手段,氮元素的常见化合价与部分物质类别的对应关系如图所示。

(1)从氮元素化合价的角度分析,X、Y、Z、W中既具有氧化性又具有还原性的有______ (填化学式)。
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_______________ 。尾气中的NO用酸性NaClO溶液吸收,其原理是HClO氧化NO生成Cl−和NO3-,其离子方程式为______________________________________ 。
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为_______________________ 。
(4)W的稀溶液与铜单质发生反应的离子方程式为__________________________ 。
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为__________________________ 。

(1)从氮元素化合价的角度分析,X、Y、Z、W中既具有氧化性又具有还原性的有
(2) N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为
(3)将集满红棕色气体Z的试管倒置于盛有水的水槽中,观察到的现象为
(4)W的稀溶液与铜单质发生反应的离子方程式为
(5)已知NaNO2能被酸性KMnO4溶液氧化为NaNO3,则50mL0.01 mol·L-1 NaNO2溶液与10mL0.02 mol·L-1 KMnO4溶液恰好完全反应时,还原产物中Mn元素的化合价为
您最近一年使用:0次
2020-01-09更新
|
479次组卷
|
6卷引用:福建省泉州第一中学2020-2021学年高一下学期第一次月考化学试题
4 . 某化学兴趣小组为了制取并探究氨气性质,按下列装置(夹持装置已略去)进行实验。

【实验探究】
(1)实验室制氨气的化学方程式_______ 利用上述原理,应选用下图中_______ 发生装置进行实验。

(2)F装置中倒置漏斗的作用_______ 。
(3)某同学用排空气法收集一圆底烧瓶氨气做喷泉实验,结果发现液面只上升到圆底烧瓶的一半,该同学认为收集到的氨气不纯,请你求出混合气体的摩尔质量为_______ g/mol,最终所得溶液的浓度为_______ mol/L。

(4)氨气的用途很广,可以作为工业制硝酸的原料,写出氨气催化生成NO的化学方程式_______ 。
(5)硝酸工业尾气中的NO、NO2进入大气后,会形成光化学烟雾、破坏臭氧层等。可用氢氧化钠溶液对含氮氧化物的废气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O,将一定量NO和NO2的混合气体通入300mL5mol·L-1NaOH溶液中,恰好被完全吸收,则标准状况下NO最多为_______ L。

【实验探究】
(1)实验室制氨气的化学方程式

(2)F装置中倒置漏斗的作用
(3)某同学用排空气法收集一圆底烧瓶氨气做喷泉实验,结果发现液面只上升到圆底烧瓶的一半,该同学认为收集到的氨气不纯,请你求出混合气体的摩尔质量为

(4)氨气的用途很广,可以作为工业制硝酸的原料,写出氨气催化生成NO的化学方程式
(5)硝酸工业尾气中的NO、NO2进入大气后,会形成光化学烟雾、破坏臭氧层等。可用氢氧化钠溶液对含氮氧化物的废气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O,将一定量NO和NO2的混合气体通入300mL5mol·L-1NaOH溶液中,恰好被完全吸收,则标准状况下NO最多为
您最近一年使用:0次
名校
5 . 某化学小组模拟工业生产制取HNO3,设计了如图所示装置,其中a为一个可持续鼓入空气的橡皮球。
(1)写出装置A中主要反应的化学方程式____ 。
(2)写出装置B中发生反应的化学方程式____ 。
(3)装置C中浓硫酸的主要作用是___ 。
(4)请你帮助该化学小组设计实验室制取NH3的另一个方案:___ ,并写出NH3的两种用途:___ ,___ 。

(1)写出装置A中主要反应的化学方程式
(2)写出装置B中发生反应的化学方程式
(3)装置C中浓硫酸的主要作用是
(4)请你帮助该化学小组设计实验室制取NH3的另一个方案:
您最近一年使用:0次
2022-04-22更新
|
105次组卷
|
2卷引用:湖南省常德市第二中学2020-2021学年高一下学期期中考试化学试题
解题方法
6 . A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去):
A B
B C
C D
D
(1)若A是一种金属,C是淡黄色固体,写出C的一种用途___ 。
(2)若A为淡黄色固体单质,写出用氢氧化钠吸收B气体的化学方程式___ 。
(3)若A的单质是黑色固体,D为弱酸,则C引起的环境问题是:___ 。
(4)若A是化合物,C是红棕色气体,则A与O2反应生成B的化学方程式为___ 。
A
 B
B C
C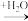 D
D(1)若A是一种金属,C是淡黄色固体,写出C的一种用途
(2)若A为淡黄色固体单质,写出用氢氧化钠吸收B气体的化学方程式
(3)若A的单质是黑色固体,D为弱酸,则C引起的环境问题是:
(4)若A是化合物,C是红棕色气体,则A与O2反应生成B的化学方程式为
您最近一年使用:0次
7 . 非金属及其化合物种类繁多,用途广泛,在化工生产和经济发展中具有重要地位。
(1)写出工业制硝酸的基础——氨的催化氧化___________
(2)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2的方法来除去SO2.写出该反应的化学方程式:___________
(3)(NH4)2Fe(SO4)2是一种重要的硫酸盐,写出其电离方程式___________
(4)用电子式表示MgCl2的形成过程___________
(1)写出工业制硝酸的基础——氨的催化氧化
(2)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2的方法来除去SO2.写出该反应的化学方程式:
(3)(NH4)2Fe(SO4)2是一种重要的硫酸盐,写出其电离方程式
(4)用电子式表示MgCl2的形成过程
您最近一年使用:0次
名校
8 . 氨在能源、化肥生产等领域有着非常重要的用途。
(1)氨气是重要的化工原料,回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为:_______ ;
②下列试剂不能用于干燥NH3的是_______ (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③氨气可以合成多种物质,写出氨催化氧化的化学方程式:_______ ;
(2)氨可用于燃料电池,氨易液化,运输和储存方便,安全性能更高。新型NH3-O2燃料电池原理如下图所示:

电极1为_______ (填“正极”或“负极”),电极2的反应式为_______ 。
(3) 工业生产中利用氨水吸收SO2和NO2,原理如下图所示:

NO2被吸收过程的离子方程式是_______ 。
(1)氨气是重要的化工原料,回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为:
②下列试剂不能用于干燥NH3的是
A.浓硫酸 B.碱石灰 C.NaOH固体
③氨气可以合成多种物质,写出氨催化氧化的化学方程式:
(2)氨可用于燃料电池,氨易液化,运输和储存方便,安全性能更高。新型NH3-O2燃料电池原理如下图所示:

电极1为
(3) 工业生产中利用氨水吸收SO2和NO2,原理如下图所示:

NO2被吸收过程的离子方程式是
您最近一年使用:0次
9 . 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。

请回答下列问题:
(1)若A是黄绿色的气体,D是铁单质。则B是_____ (填化学式)。
(2)若A是一种有刺激性气味的气体,其水溶液呈碱性;B和C是常见的氧化物且C是红棕色气体。则反应①的化学方程式为_____ ,A的用途有_____ (任写一种)。
(3)若A、C、D都是气体,B是一种(淡)黄色的固体单质,C是形成酸雨的主要物质。在标准状况下,反应③中消耗6.72L的A,则转移的电子数为_____ 。
(4)若A是钠盐,B俗称小苏打,则反应②的离子方程式为_____ ;配制250mL0.1mol·L-1Na2CO3溶液,需要用托盘天平称量Na2CO3晶体的质量为_____ 克。

请回答下列问题:
(1)若A是黄绿色的气体,D是铁单质。则B是
(2)若A是一种有刺激性气味的气体,其水溶液呈碱性;B和C是常见的氧化物且C是红棕色气体。则反应①的化学方程式为
(3)若A、C、D都是气体,B是一种(淡)黄色的固体单质,C是形成酸雨的主要物质。在标准状况下,反应③中消耗6.72L的A,则转移的电子数为
(4)若A是钠盐,B俗称小苏打,则反应②的离子方程式为
您最近一年使用:0次
10 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示:
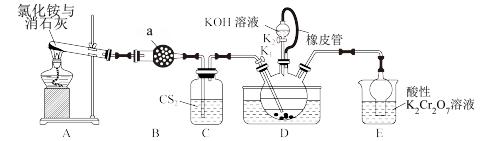
已知:①NH3不溶于CS2,CS2密度比水大且不溶于水;②三颈瓶内盛放:CS2、水和催化剂;
③ ,该反应比较缓慢且NH4SCN在高于170℃时易分解。回答下列问题:
,该反应比较缓慢且NH4SCN在高于170℃时易分解。回答下列问题:
(1)仪器a的名称为_______ ,所装试剂为_______ 。
(2)装置A中反应的化学方程式为_______ 。
(3)装置D连接橡皮管的作用为_______ 。
(4)制备KSCN溶液:熄灭A处的酒精灯,关闭K1,保持三颈烧瓶内液温105℃一段时间,然后打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,写出装置D中生成KSCN的化学方程式:_______ 。
(5)装置E的作用为吸收尾气,防止污染环境,写出吸收NH3时发生反应的离子方程式:_______ 。
(6)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压_______ 、_______ 、过滤、洗涤、干燥,得到硫氰化钾晶体。
(7)测定晶体中KSCN的含量:称取12.0g样品。配成1000mL溶液,量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3作指示剂,用0.1000mol/L AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液18.00mL。[已知:滴定时发生的反应:SCN-+Ag+=AgSCN↓ (白色)。]
①达到滴定终点时的现象为_______ 。
②晶体中KSCN的质量分数为_______ 。

已知:①NH3不溶于CS2,CS2密度比水大且不溶于水;②三颈瓶内盛放:CS2、水和催化剂;
③
 ,该反应比较缓慢且NH4SCN在高于170℃时易分解。回答下列问题:
,该反应比较缓慢且NH4SCN在高于170℃时易分解。回答下列问题:(1)仪器a的名称为
(2)装置A中反应的化学方程式为
(3)装置D连接橡皮管的作用为
(4)制备KSCN溶液:熄灭A处的酒精灯,关闭K1,保持三颈烧瓶内液温105℃一段时间,然后打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,写出装置D中生成KSCN的化学方程式:
(5)装置E的作用为吸收尾气,防止污染环境,写出吸收NH3时发生反应的离子方程式:
(6)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压
(7)测定晶体中KSCN的含量:称取12.0g样品。配成1000mL溶液,量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3作指示剂,用0.1000mol/L AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液18.00mL。[已知:滴定时发生的反应:SCN-+Ag+=AgSCN↓ (白色)。]
①达到滴定终点时的现象为
②晶体中KSCN的质量分数为
您最近一年使用:0次



