名校
解题方法
1 . 亚硝酸钠 是一种化工产品,易溶于水,无漂白性。亚硝酸钠的制备原理为
是一种化工产品,易溶于水,无漂白性。亚硝酸钠的制备原理为
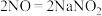 。某小组设计实验制备亚硝酸钠并测定其纯度和探究其性质,装置如图所示。已知:常温下,酸性
。某小组设计实验制备亚硝酸钠并测定其纯度和探究其性质,装置如图所示。已知:常温下,酸性 溶液能吸收
溶液能吸收 生成无色的
生成无色的 和
和 。
。
(1) 装置的作用是
装置的作用是___________ 。
(2)写出 装置中发生反应的化学方程式:
装置中发生反应的化学方程式:___________ 。
(3) 装置中紫红色变为无色,发生反应的离子方程式为
装置中紫红色变为无色,发生反应的离子方程式为___________ 。
(4)实验完毕,设计实验证明产品是否含有 :
:___________ 。
(5)为了探究 的性质,设计如下实验:
的性质,设计如下实验:
上述实验能证明 具有氧化性的是
具有氧化性的是___________ (填“I”或“II”)。
(6)取
 产品溶于水配制成
产品溶于水配制成 溶液,准确量取
溶液,准确量取 所配溶液于锥形瓶中,恰好与
所配溶液于锥形瓶中,恰好与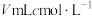 酸性
酸性 溶液完全反应。该产品中
溶液完全反应。该产品中 的质量分数为
的质量分数为___________ (已知: 和酸性
和酸性 溶液反应生成
溶液反应生成 和
和 )。
)。
 是一种化工产品,易溶于水,无漂白性。亚硝酸钠的制备原理为
是一种化工产品,易溶于水,无漂白性。亚硝酸钠的制备原理为
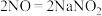 。某小组设计实验制备亚硝酸钠并测定其纯度和探究其性质,装置如图所示。已知:常温下,酸性
。某小组设计实验制备亚硝酸钠并测定其纯度和探究其性质,装置如图所示。已知:常温下,酸性 溶液能吸收
溶液能吸收 生成无色的
生成无色的 和
和 。
。
(1)
 装置的作用是
装置的作用是(2)写出
 装置中发生反应的化学方程式:
装置中发生反应的化学方程式:(3)
 装置中紫红色变为无色,发生反应的离子方程式为
装置中紫红色变为无色,发生反应的离子方程式为(4)实验完毕,设计实验证明产品是否含有
 :
:(5)为了探究
 的性质,设计如下实验:
的性质,设计如下实验:| 序号 | 操作 | 现象 |
| I | 取少量 溶于水,滴加酚酞溶液 溶于水,滴加酚酞溶液 | 溶液变红色 |
| II | 取少量  溶于水,滴加稀硫酸和 溶于水,滴加稀硫酸和 溶液,再滴加淀粉溶液 溶液,再滴加淀粉溶液 | 溶液变蓝色 |
 具有氧化性的是
具有氧化性的是(6)取

 产品溶于水配制成
产品溶于水配制成 溶液,准确量取
溶液,准确量取 所配溶液于锥形瓶中,恰好与
所配溶液于锥形瓶中,恰好与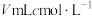 酸性
酸性 溶液完全反应。该产品中
溶液完全反应。该产品中 的质量分数为
的质量分数为 和酸性
和酸性 溶液反应生成
溶液反应生成 和
和 )。
)。
您最近一年使用:0次
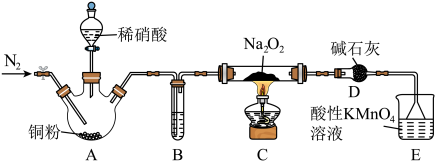
2 . 亚硝酰氯NOCl常用于合成洗涤剂及合成中间体,某学习小组在实验室利用2NO+Cl2 2NOCl反应制备NOCl,设计如图实验装置(夹持装置略去)。
2NOCl反应制备NOCl,设计如图实验装置(夹持装置略去)。

已知:①NOCl为红褐色液体或黄色气体,熔点-64.5℃,沸点-5.5℃;
②NOCl遇水发生反应NOCl+H2O=HNO2+HCl。
回答下列问题:
(1)仪器a的名称是______ ,仪器a中反应的离子方程式为_____ 。
(2)实验过程中,某同学发现铜与稀硝酸反应较慢,于是有同学提议用“浓硝酸”代替将A装置中的“稀硝酸”,该同学的观点是否合理?______ (填“合理”或“不合理”),试说明原因:______ 。
(3)实验时,应先在三颈烧瓶内通入_____ (填“Cl2”或“NO”),另一种气体可以通入的标志是_____ 。
(4)实验中用NaOH溶液进行尾气处理。
①无水CaCl2的作用是______ 。
②尾气处理时,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与______ (填化学式)同时通入NaOH溶液中。
 2NOCl反应制备NOCl,设计如图实验装置(夹持装置略去)。
2NOCl反应制备NOCl,设计如图实验装置(夹持装置略去)。
已知:①NOCl为红褐色液体或黄色气体,熔点-64.5℃,沸点-5.5℃;
②NOCl遇水发生反应NOCl+H2O=HNO2+HCl。
回答下列问题:
(1)仪器a的名称是
(2)实验过程中,某同学发现铜与稀硝酸反应较慢,于是有同学提议用“浓硝酸”代替将A装置中的“稀硝酸”,该同学的观点是否合理?
(3)实验时,应先在三颈烧瓶内通入
(4)实验中用NaOH溶液进行尾气处理。
①无水CaCl2的作用是
②尾气处理时,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与
您最近一年使用:0次
2023-05-04更新
|
438次组卷
|
2卷引用:海南省文昌中学2023-2024学年高一下学期期中段考化学试题
名校
解题方法
3 . 下列说法中正确的是
| A.制造矢量发动机使用含铼(Re)合金材料,含铼合金是纯净物 |
| B.向BaCl2溶液中加入Na2SO3产生沉淀,再通入NO2,沉淀完全溶解 |
| C.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 |
| D.常温下可以将浓硫酸盛装在铁制容器中,说明浓硫酸与铁在常温下不反应 |
您最近一年使用:0次
解题方法
4 . 一氧化氮、二氧化氮的物理性质
| 氧化物 | 颜色 | 状态 | 气味 | 水溶性 |
| NO | 气态 | |||
| NO2 | 气态 |
您最近一年使用:0次
2022-03-03更新
|
380次组卷
|
3卷引用:海南省儋州川绵中学2021-2022学年高一下学期期中考试(合格考)化学试题
21-22高一·全国·课时练习
5 . 关于氮氧化物的说法正确的是
| A.氮氧化物一定对人体有害 | B.可以用排水集气法收集NO2气体 |
| C.雷电多的地方容易形成酸雨 | D.收集NO要用排水集气法 |
您最近一年使用:0次
2022-02-10更新
|
469次组卷
|
3卷引用:海南省三亚华侨学校南新校区2021-2022学年高一下学期期中考试化学试题
海南省三亚华侨学校南新校区2021-2022学年高一下学期期中考试化学试题(已下线)7.1 氮的固定-2021-2022学年高一化学10分钟课前预习练(苏教版2019必修第二册)江苏省连云港市锦屏高级中学等四校2021-2022学年高一下学期期中考试化学试题
6 . SO2、NOx既是大气主要污染物,也是重要的化工原料,可用于硫酸、硝酸的生产。下列关于NO、NO2的说法中正确的是
| A.第一电离能:I1(N)<I1(O) | B.实验室用排空气法收集NO |
| C.用O2除去NO2中的NO | D.可用NaOH溶液吸收NO2 |
您最近一年使用:0次
2022-01-22更新
|
553次组卷
|
3卷引用:2022年海南省高考真题变式题1-14
(已下线)2022年海南省高考真题变式题1-14江苏省苏北四市(徐州、淮安、宿迁、连云港)2021-2022学年高三上学期期末调研考试化学试题河南省平顶山市龙河实验高级中学2021-2022学年高二下学期期中考试化学试题
解题方法
7 . 氮、氧、硫、氯是四种重要的非金属元素,研究它们的性质及用途对生产,生活、科研具有重要意义。
(1)一氯胺(NH2Cl)是一种长效缓释水消毒剂,工业上可利用反应NHI3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备。
①一氯胺(NH2Cl)在中性或酸性环境中会发生水解反应,生成一种具有强烈杀菌作用的物质,该物质的电子式为___________ 。
②氨气也是工业上制备硝酸的主要原料,制备硝酸的过程中涉及NO2与水的反应。该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)SO2、NO2两种气体都能对大气造成污染,需要对其进行吸收处理。用氨水吸收SO2能得到含 (NH4)2SO3和NH4HSO3的吸收液,写出生成(NH4)2SO3的离子方程式:___________ 。若向吸收液中通入过量NO2,NH4HSO3能与NO2发生反应生成N2和(NH4)2SO4,写出该反应的离子方程式:___________ 。
(3)Cl2与NaOH溶液反应可制取“84”消毒液。用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3,),此时ClO-的浓度为c0 mol/L;加热时NaClO能转化为NaClO3,测得t时刻溶液中ClO-的浓度为c1 mol/L (不考虑加热前后溶液体积的变化)。
①写出溶液中NaClO分解生成NaClO3的化学方程式:___________ 。
②t时刻溶液中c(Cl-)=___________ mol/L(用含c0、c1的代数式表示)。
(1)一氯胺(NH2Cl)是一种长效缓释水消毒剂,工业上可利用反应NHI3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备。
①一氯胺(NH2Cl)在中性或酸性环境中会发生水解反应,生成一种具有强烈杀菌作用的物质,该物质的电子式为
②氨气也是工业上制备硝酸的主要原料,制备硝酸的过程中涉及NO2与水的反应。该反应中氧化剂与还原剂的物质的量之比为
(2)SO2、NO2两种气体都能对大气造成污染,需要对其进行吸收处理。用氨水吸收SO2能得到含 (NH4)2SO3和NH4HSO3的吸收液,写出生成(NH4)2SO3的离子方程式:
(3)Cl2与NaOH溶液反应可制取“84”消毒液。用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3,),此时ClO-的浓度为c0 mol/L;加热时NaClO能转化为NaClO3,测得t时刻溶液中ClO-的浓度为c1 mol/L (不考虑加热前后溶液体积的变化)。
①写出溶液中NaClO分解生成NaClO3的化学方程式:
②t时刻溶液中c(Cl-)=
您最近一年使用:0次
解题方法
8 . 中国向世界庄严宣布:二氧化碳排放力争在2030年前达到峰值、在2060年前达到碳中和。下列措施不能减少碳排放的是:
| A.推广“液态阳光”技术,促使CO2加氢转化为液态燃料 |
| B.在汽车排气管里安装催化转化装置,将CO与氮氧化物转化为CO2、N2等排入空气 |
| C.倡导低碳生活,注意节约用电 |
| D.利用风能、水能等可再生能源发电替代火力发电 |
您最近一年使用:0次
2021-11-17更新
|
568次组卷
|
3卷引用:海南省2021-2022学年高三上学期学业水平诊断考试化学试题
9 . 某常温下非金属气体A单质,可发生如下转化,其中C是红棕色气体。
A B
B C
C D
D
(1)气体A的化学式为____ ;
(2)B→C化学反应的类型是属于____ 反应(填“化合”、“分解”、“置换”或“复分解”)。
(3)D的浓溶液应保存放在____ 色试剂瓶中,且在常温下可与铜反应并生成C气体,该反应的化学方程式____
(4)若将25.6g铜跟一定量的D的浓溶液反应,铜消耗完时,共产生11.2L(已换算成标准状况)气体。则所消耗的D的物质的量为____ 。
A
 B
B C
C D
D(1)气体A的化学式为
(2)B→C化学反应的类型是属于
(3)D的浓溶液应保存放在
(4)若将25.6g铜跟一定量的D的浓溶液反应,铜消耗完时,共产生11.2L(已换算成标准状况)气体。则所消耗的D的物质的量为
您最近一年使用:0次



