名校
解题方法
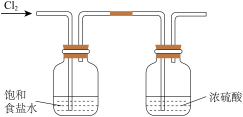
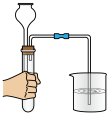
1 . 下列装置和操作不能达到实验目的的是。
|
|
|
|
A.净化浓盐酸与 反应制得的 反应制得的 | B.验证氨气极易溶于水 | C.除去 中的 中的 杂质 杂质 | D.观察浓硝酸与铜反应的现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-03更新
|
746次组卷
|
5卷引用:重庆市2023届高三第一次联合诊断检测(一模)(康德卷)化学试题
重庆市2023届高三第一次联合诊断检测(一模)(康德卷)化学试题广东省茂名市第一中学2022-2023学年高三上学期期末化学诊断检测题(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(选择题6-10)(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)四川省达州市万源中学2023-2024学年高一下学期4月期中考试化学试题
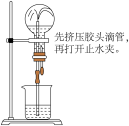
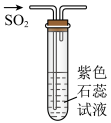
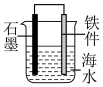
2 . 下列实验装置或操作能够达到实验目的的是
|
|
| A.检查装置的气密性 | B.验证 漂白性 漂白性 |
|
|
C.制备 | D.保护铁件 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 下列实验装置能达到相应实验目的的是
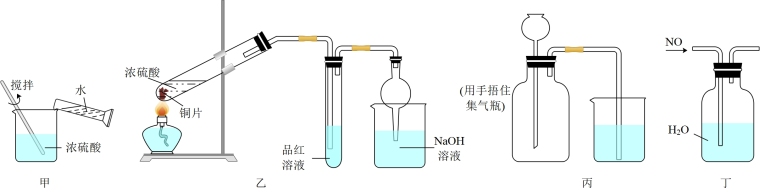
| A.装置甲稀释浓硫酸 |
| B.装置乙制备并检验SO2气体的性质 |
| C.装置丙检查装置的气密性 |
| D.装置丁收集NO |
您最近一年使用:0次
2022-03-23更新
|
539次组卷
|
9卷引用:重庆市万州第二高级中学2023-2024学年高三下学期高考适应性(二)化学试题
解题方法
4 . 下列实验操作能达到实验目的的是
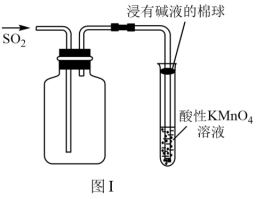
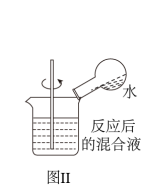
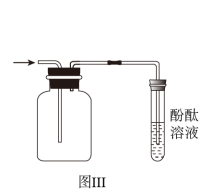





A.用图Ⅰ装置验证 的漂白性 的漂白性 |
B.用图Ⅱ检验浓硫酸与铜反应后的产物中是否含有 |
C.用图Ⅲ收集 并验证其水溶液呈碱性 并验证其水溶液呈碱性 |
D.用图Ⅳ装置制备 晶体 晶体 |
您最近一年使用:0次
2014·江西上饶·二模
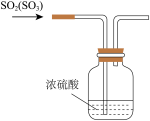
5 . 二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。



(1)实验室用图1装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:_________________ 。
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式:________ 。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是:________ 。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是__________ (用含字母的代数式表示,不用化简)。
(2)某学习小组设计用如图3装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为:_________________________ 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去。
方案Ⅲ:向第三份溶液中加入BaC12溶液,产生白色沉淀
上述方案中合理的是______ (填“I”、“Ⅱ”、或“Ⅲ”);
试管b发生反应的离子方程式:______ 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)=__________________ 用含硫微粒浓度的代数式表示)。



(1)实验室用图1装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式:
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是:
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是
(2)某学习小组设计用如图3装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为:
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去。
方案Ⅲ:向第三份溶液中加入BaC12溶液,产生白色沉淀
上述方案中合理的是
试管b发生反应的离子方程式:
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)=
您最近一年使用:0次
2016-12-09更新
|
872次组卷
|
3卷引用:重庆缙云教育联盟2024届高三高考第一次诊断性检测(一模) 化学试卷
重庆缙云教育联盟2024届高三高考第一次诊断性检测(一模) 化学试卷(已下线)2013-2014江西省上饶市重点中学高三六校第二次联考理综化学试卷人教版2017-2018学年高一化学必修1:4.3 硫和氮的氧化物 同步测试
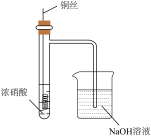
6 . 下列如图所示装置不能达到实验目的的是
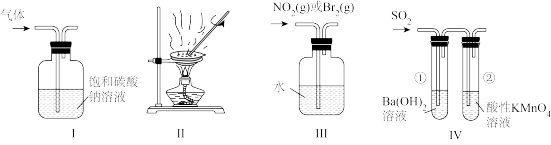

A.用装置Ⅰ除去 中的草酸蒸气 中的草酸蒸气 |
B.用装置Ⅱ蒸发 溶液得到 溶液得到 晶体 晶体 |
| C.用装置Ⅲ鉴别Br2(g)和NO2(g) |
D.用装置Ⅳ验证 的性质 的性质 |
您最近一年使用:0次
7 . 工业上常用铁质容器盛装冷的浓硫酸。某兴趣小组的同学发现: 将一定量的生铁与浓硫酸加热时,观察到固体能完全溶解,并产生大量气体。为探究反应后的产物,请你协助他们完成相关的实验。
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢) 放入冷的浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是________________________ 。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要判断溶液X中是否含有Fe2+,应选用________ (填序号)。
a.KSCN溶液和氯水 b.K3[Fe(CN)6]溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学将336mL(标准状况) 气体Y通入足量溴水中,发现溶液颜色变浅,试用化学方程式解释溴水颜色变浅的原因:__________________________________________________________ ,然后向反应后的溶液中加入足量BaCl2溶液,经适当操作得干燥固体2.33g 。由此推知气体Y 中SO2的体积分数为_________ 。
[探究二]
分析上述实验中SO2体积分数的结果,两同学认为气体Y中还可能含有H2和Q气体。为此设计如图所示探究实验装置(图中夹持仪器省略)。

(3) 装置A中发生反应的离子方程式为_____________________ ,装置B中试剂的作用是____________ 。
(4)认为气体Y中还含有气体Q的理由是_____________________________ (用化学方程式表示)。
为了进一步确认Q的存在,需在装置中添加装置M 于_________ (填序号),M中所加试剂为_________ 。
a.A~B之间 b.B~C之间 c.C~D之间 d.E~F之间
(5)利用上述实验装置进一步确认气体Y 中是否含有H2,为达到预期的实验目的,加热前称量装置D的总质量为mg,当通入336mL (标准状况) 气体Y完全反应后,继续通入氮气至装置D冷却到室温,称量装置D的质量为ng,则原混合气体中H2的体积分数为__________ 。(用含相关字母的代数式表示)
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢) 放入冷的浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要判断溶液X中是否含有Fe2+,应选用
a.KSCN溶液和氯水 b.K3[Fe(CN)6]溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学将336mL(标准状况) 气体Y通入足量溴水中,发现溶液颜色变浅,试用化学方程式解释溴水颜色变浅的原因:
[探究二]
分析上述实验中SO2体积分数的结果,两同学认为气体Y中还可能含有H2和Q气体。为此设计如图所示探究实验装置(图中夹持仪器省略)。

(3) 装置A中发生反应的离子方程式为
(4)认为气体Y中还含有气体Q的理由是
为了进一步确认Q的存在,需在装置中添加装置M 于
a.A~B之间 b.B~C之间 c.C~D之间 d.E~F之间
(5)利用上述实验装置进一步确认气体Y 中是否含有H2,为达到预期的实验目的,加热前称量装置D的总质量为mg,当通入336mL (标准状况) 气体Y完全反应后,继续通入氮气至装置D冷却到室温,称量装置D的质量为ng,则原混合气体中H2的体积分数为
您最近一年使用:0次
2023·全国·模拟预测
名校
解题方法
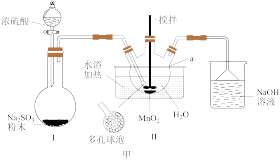
8 . MnSO4·H2O是一种浅粉色晶体,易溶于水,不溶于乙醇,是饲料中常用的添加剂,也是电解制备锰及其他锰盐的原料,工业用途广泛。某同学设计如图甲所示实验装置制备硫酸锰。
回答下列问题:
(1)仪器a的名称是_____ 。连接好实验仪器,装药品之前需进行的操作是______ 。
(2)装置Ⅱ中发生反应的化学方程式为_____ ;装置Ⅱ中水浴温度控制在80℃左右,温度过高时反应速率可能减慢的原因是______ 。
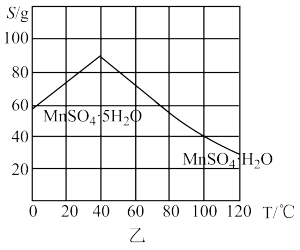
(3)结合图乙,分析反应后从溶液中获得MnSO4·H2O晶体的操作为_____ 、酒精洗涤、低温干燥。
(4)测定饲料中硫酸锰的含量常将饲料溶于水,以磷酸作络合剂,用硝酸铵作氧化剂,将试样中的二价锰定量氧化成三价锰,过量的硝酸铵立即与产生的亚硝酸盐反应而消除其影响。然后加入指示剂,用硫酸亚铁铵[Fe(NH4)2(SO4)2]标准溶液滴定生成的三价锰,溶液由红色变为亮黄色为滴定终点。有关反应的离子方程式如下:
①2Mn2++NO +4PO
+4PO +2H+=2[Mn(PO4)2]3-+NO
+2H+=2[Mn(PO4)2]3-+NO +H2O;
+H2O;
②NH +NO
+NO =N2↓+2H2O;
=N2↓+2H2O;
③[Mn(PO4)2]3-+Fe2+=Mn2++[Fe(PO4)2]3-。
取ag饲料,消耗浓度为cmol•L-1的硫酸亚铁铵标准溶液VmL,则饲料中MnSO4·H2O的质量分数为_____ %(用含a、c、V的式子表示)。若实验时未用标准溶液润洗滴定管,会导致测定结果_____ (填“偏大”“偏小”或“无影响”)。
(5)用惰性电极电解MnSO4酸性溶液可制得MnO2,请写出电解法制备MnO2时的阳极反应式:_____ 。

回答下列问题:
(1)仪器a的名称是
(2)装置Ⅱ中发生反应的化学方程式为
(3)结合图乙,分析反应后从溶液中获得MnSO4·H2O晶体的操作为

(4)测定饲料中硫酸锰的含量常将饲料溶于水,以磷酸作络合剂,用硝酸铵作氧化剂,将试样中的二价锰定量氧化成三价锰,过量的硝酸铵立即与产生的亚硝酸盐反应而消除其影响。然后加入指示剂,用硫酸亚铁铵[Fe(NH4)2(SO4)2]标准溶液滴定生成的三价锰,溶液由红色变为亮黄色为滴定终点。有关反应的离子方程式如下:
①2Mn2++NO
 +4PO
+4PO +2H+=2[Mn(PO4)2]3-+NO
+2H+=2[Mn(PO4)2]3-+NO +H2O;
+H2O;②NH
 +NO
+NO =N2↓+2H2O;
=N2↓+2H2O;③[Mn(PO4)2]3-+Fe2+=Mn2++[Fe(PO4)2]3-。
取ag饲料,消耗浓度为cmol•L-1的硫酸亚铁铵标准溶液VmL,则饲料中MnSO4·H2O的质量分数为
(5)用惰性电极电解MnSO4酸性溶液可制得MnO2,请写出电解法制备MnO2时的阳极反应式:
您最近一年使用:0次
2023-04-11更新
|
299次组卷
|
4卷引用:重庆市乌江新高考协作体2023-2024学年高三上学期第一次联合调研抽测(一模)化学试题
重庆市乌江新高考协作体2023-2024学年高三上学期第一次联合调研抽测(一模)化学试题(已下线)化学押题卷(一)河南省焦作市博爱县第一中学2023-2024学年高三下学期开学化学试题(已下线)T26-实验综合题
解题方法
9 . 随着5G时代的到来,半导体材料将迎来快速发展,三氯化氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室利用PCl3、SO2、Cl2在60~65°C时反应制备POCl3和SOCl3的实验装置如图所示(气体的制备装置未画出)。

资料卡片:
(1)该反应的化学方程式为___ 。
(2)A、B装置中的试剂分别是___ 、___ 。
(3)装置E的作用是___ 。
(4)反应装置的虚线框中未画出的仪器最好选用___ (填“F”或“G”),理由是___ 。
(5)反应结束后,提纯POCl3的操作是___ (填操作名称)。
(6)测定某掺杂剂中POCl3的含量(杂质不参与反应):准确称取4.000g样品在水解瓶中摇动至完全水解,将水解液配成250mL溶液,取25.00mL于锥形瓶中,加入0.4000mol•L-1的AgNO3溶液25.00mL,再加少许硝基苯,用力振荡。加入NH4Fe(SO4)2作指示剂,用0.l000mol•L-1KSCN标准溶液滴定过量的AgNO3至终点,消耗KSCN标准溶液22.00mL。[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12,Ag3PO4可溶于硝酸,POCl3的相对分子质量为153.5]
①加入少量的硝基苯的目的是___ 。
②POCl3的质量分数为___ 。(保留一位小数)

资料卡片:
| 物质 | 熔点/°C | 沸点/°C | 其他 |
| PCl3 | -93.6 | 76.1 | 遇水剧烈水解,易与O2反应 |
| POCl3 | 1.25 | 105.8 | 遇水剧烈水解,能溶于PCl3 |
| SOCl3 | -105 | 78.8 | 遇水剧烈水解,受热易分解 |
(1)该反应的化学方程式为
(2)A、B装置中的试剂分别是
(3)装置E的作用是
(4)反应装置的虚线框中未画出的仪器最好选用
(5)反应结束后,提纯POCl3的操作是
(6)测定某掺杂剂中POCl3的含量(杂质不参与反应):准确称取4.000g样品在水解瓶中摇动至完全水解,将水解液配成250mL溶液,取25.00mL于锥形瓶中,加入0.4000mol•L-1的AgNO3溶液25.00mL,再加少许硝基苯,用力振荡。加入NH4Fe(SO4)2作指示剂,用0.l000mol•L-1KSCN标准溶液滴定过量的AgNO3至终点,消耗KSCN标准溶液22.00mL。[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12,Ag3PO4可溶于硝酸,POCl3的相对分子质量为153.5]
①加入少量的硝基苯的目的是
②POCl3的质量分数为
您最近一年使用:0次
解题方法
10 . 某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
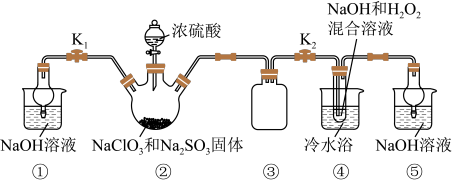
(1)装置③的作用是__________________________ 。
(2)装置②中产生ClO2的化学方程式为__________________ ;装置④中制备NaClO2的离子方程式为_______________________ 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;② 趁热过滤;③________________ ;④ 低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO +4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O =2I-+S4O
=2I-+S4O )。
)。
(4)配制待测液时,除用到烧杯、玻璃棒外,还必须用到的玻璃仪器有_________ 。
(5)该样品中NaClO2的质量分数为__________________ (用含m、c、V的代数式表示)。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
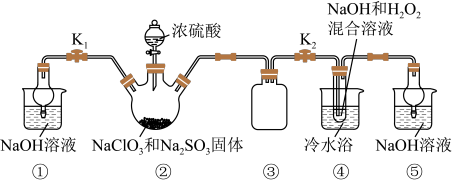
(1)装置③的作用是
(2)装置②中产生ClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;② 趁热过滤;③
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O =2I-+S4O
=2I-+S4O )。
)。(4)配制待测液时,除用到烧杯、玻璃棒外,还必须用到的玻璃仪器有
(5)该样品中NaClO2的质量分数为
您最近一年使用:0次