名校
解题方法
1 . 下列实验装置能达到实验目的的是
 |  | 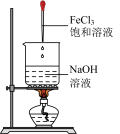 |  |
| A.检查装置气密性 | B.干燥 气体 气体 | C.制备氢氧化铁胶体 | D.处理含 的尾气 的尾气 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-04更新
|
192次组卷
|
2卷引用:河南省安阳市2022-2023学年高三上学期大联考化学试题
名校
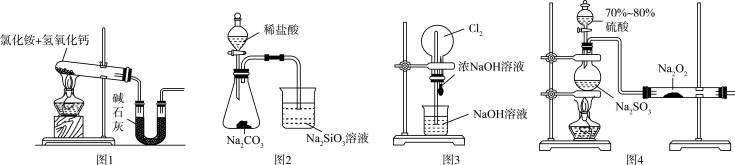
2 . 下列实验装置能达到相应实验目的的是

| A.图A是制备氯气 |
| B.图B是制备并检验SO2气体的性质 |
| C.图C是检查装置的气密性 |
| D.图D是收集NO |
您最近一年使用:0次
2022-03-17更新
|
480次组卷
|
5卷引用:河南省洛阳市创新发展联盟2021-2022学年高一下期第一次联考化学试题
名校
3 . 下列有关实验装置进行的相应实验,不能达到实验目的的是
| A.用图1所示装置可制备得到干燥的氨气 |
| B.用图2所示装置证明:非金属性:C>Si |
| C.用图3所示装置可以完成“喷泉”实验 |
| D.用图4所示装置能观察到右边装置中淡黄色固体变白色 |
您最近一年使用:0次
2021-09-29更新
|
1009次组卷
|
15卷引用:河南省郸城第一高级中学2021-2022学年高一下学期第二次月考化学试题
河南省郸城第一高级中学2021-2022学年高一下学期第二次月考化学试题广东省广州大学附属中学2021-2022学年高一下学期3月月考化学试题江西省赣州市信丰县第一中学2021-2022学年高一下学期期中考试化学试题江西省抚州市临川第二中学、临汝中学2021-2022学年高一下学期期中考试化学试题广东省广州市第一中学2021-2022学年高一下学期期中考试化学试题广东省揭阳市揭东区2021-2022学年高一下学期期末考试化学试题广东省兴宁市沐彬中学2021-2022学年高一下学期期中段考化学试题广东省广州市仲元中学2020-2021学年高一下学期期中考试化学试题广东省佛山市第四中学2022-2023学年高一下学期3月月考化学试卷天津市第二十一中学2022-2023学年高一下学期期中考试化学试题广东省广州市第七中学2022-2023学年高一下学期期中考试化学试题广东省佛山市顺德市李兆基中学2022-2023学年高一下学期3月月考化学试题广东省湛江市坡头区第一中学2022-2023学年高一下学期期中考试化学试题广东省佛山市顺德区桂洲中学2023-2024学年高一下学期第一次联考模拟化学试题 安徽省淮北市第一中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
4 . 化学兴趣小组同学在探究SO2与新制Cu(OH)2悬浊液反应,实验时发现了如下问题并展开实验探究,装置如图1:
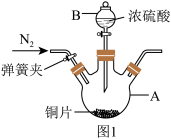
实验一:SO2的制备(图1)
(1)仪器A中加入浓硫酸加热的化学方程式_______ 。
(2)实验前通入N2的目的是_______ 。
实验二:探究SO2与新制Cu(OH)2悬浊液的反应(图2)
甲同学进行实验I:在图2试管中滴加1.5 mL1 mol·L-1CuSO4溶液和3.5 mL1 mol·L-1NaOH溶液混合,开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,试管底部有少量紫红色固体,溶液呈蓝色。
乙同学进行实验II:在试管中滴加1.5 mL1 mol·L-1CuCl2溶液和3.5 mL1 mol·L-1NaOH溶液混合,开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈蓝色。
(3)甲同学设计下列实验探究砖红色沉淀的主要成分。
取少量砖红色沉淀于试管中,加5 mL蒸馏水,滴加少量稀硫酸,静置后观察到试管底部有少量紫红色固体,溶液呈蓝色,证明砖红色沉淀是_______ (填“化学式”),发生的离子方程式为_______ 。
(4)乙同学设计下列实验探究白色沉淀的主要成分。
向得到的19.9 g白色沉淀中加入足量的稀硝酸,得到蓝色溶液;再向溶解后的溶液中加入足量的AgNO3溶液,过滤、洗涤、干燥,得到固体的质量为28.7 g,则白色沉淀的化学式为_______ (写出计算过程)。
(5)丙同学针对实验I和II中出现的实验现象,重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净,再向洗净后的Cu(OH)2中加入5mL蒸馏水,再持续通入SO2气体,得到的现象与实验I相同,说明实验I和II现象不同的原因是_______ 。

实验一:SO2的制备(图1)
(1)仪器A中加入浓硫酸加热的化学方程式
(2)实验前通入N2的目的是
实验二:探究SO2与新制Cu(OH)2悬浊液的反应(图2)

甲同学进行实验I:在图2试管中滴加1.5 mL1 mol·L-1CuSO4溶液和3.5 mL1 mol·L-1NaOH溶液混合,开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,试管底部有少量紫红色固体,溶液呈蓝色。
乙同学进行实验II:在试管中滴加1.5 mL1 mol·L-1CuCl2溶液和3.5 mL1 mol·L-1NaOH溶液混合,开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈蓝色。
(3)甲同学设计下列实验探究砖红色沉淀的主要成分。
取少量砖红色沉淀于试管中,加5 mL蒸馏水,滴加少量稀硫酸,静置后观察到试管底部有少量紫红色固体,溶液呈蓝色,证明砖红色沉淀是
(4)乙同学设计下列实验探究白色沉淀的主要成分。
向得到的19.9 g白色沉淀中加入足量的稀硝酸,得到蓝色溶液;再向溶解后的溶液中加入足量的AgNO3溶液,过滤、洗涤、干燥,得到固体的质量为28.7 g,则白色沉淀的化学式为
(5)丙同学针对实验I和II中出现的实验现象,重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净,再向洗净后的Cu(OH)2中加入5mL蒸馏水,再持续通入SO2气体,得到的现象与实验I相同,说明实验I和II现象不同的原因是
您最近一年使用:0次
2022-12-13更新
|
263次组卷
|
4卷引用:河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21)
(已下线)河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21)福建省惠安第一中学2022-2023学年高三上学期第三次月考化学试题湖南省株洲市第一中学2022-2023学年高三上学期第一次月考化学试题(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(实验探究题)
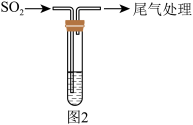
5 . 用铜单质与浓硫酸反应制备 并验证
并验证 某些性质的装置如图所示:
某些性质的装置如图所示:

回答下列问题:
(1)a中用可抽拉的铜丝,最大的优点是_______ ,a中反应的化学方程式为_______ 。
(2)实验开始后,b、c中的现象分别是_______ 、_______ 。
(3)若d中试剂分别是 溶液、
溶液、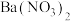 溶液或
溶液或 溶液时,其中没有沉淀生成的试剂是
溶液时,其中没有沉淀生成的试剂是_______ ,有 沉淀生成的试剂是
沉淀生成的试剂是_______ 。
(4)若去掉图中的棉团,可能的危害是_______ 。
(5)若实验结束时铜有剩余,为证明a中还存在稀硫酸,某同学取出少量溶液放入试管中,然后向试管中加入试剂X,根据实验现象可确定确实存在稀硫酸,则试剂X不可能是_______ (填序号)。
A. B.铁粉 C.
B.铁粉 C.
 并验证
并验证 某些性质的装置如图所示:
某些性质的装置如图所示:
回答下列问题:
(1)a中用可抽拉的铜丝,最大的优点是
(2)实验开始后,b、c中的现象分别是
(3)若d中试剂分别是
 溶液、
溶液、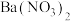 溶液或
溶液或 溶液时,其中没有沉淀生成的试剂是
溶液时,其中没有沉淀生成的试剂是 沉淀生成的试剂是
沉淀生成的试剂是(4)若去掉图中的棉团,可能的危害是
(5)若实验结束时铜有剩余,为证明a中还存在稀硫酸,某同学取出少量溶液放入试管中,然后向试管中加入试剂X,根据实验现象可确定确实存在稀硫酸,则试剂X不可能是
A.
 B.铁粉 C.
B.铁粉 C.
您最近一年使用:0次
名校
6 . 某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_______ ;
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为
MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为_______ ;
(3)①反应开始一段时间后,观察到D中的品红溶液出现的现象是:_______ 。
②停止通气后,再给B、D两个试管分别加热,B试管中的现象为:_______ 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因_______ (用化学方程式表示)提示SO2有较强的还原性。

(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为
MnCl2+Cl2↑+2H2O。若有6 mol的HCl参加反应,则转移的电子总数为(3)①反应开始一段时间后,观察到D中的品红溶液出现的现象是:
②停止通气后,再给B、D两个试管分别加热,B试管中的现象为:
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因
您最近一年使用:0次
2022-10-01更新
|
155次组卷
|
2卷引用:河南省信阳市浉河区新时代学校2021-2022学年高一下学期期中教学质量检测化学试题
名校
解题方法
7 . 摩尔盐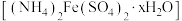 比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
(1)制备摩尔盐采用的方法是先在封闭体系中利用铁和稀硫酸反应制备硫酸亚铁溶液,再用新制的硫酸亚铁溶液和硫酸按饱和溶液反应制得。配制硫酸按饱和溶液的蒸馏水,需经煮沸并迅速冷却后再使用,目的是___________ 。
(2)可以采用热重分析法测定摩尔盐样品中所含结晶水的个数,加热其晶体需要使用的实验仪器除了玻璃棒、三脚架、泥三角、酒精灯外,还需要的仪器有___________ 。取样品 加热至两次质量恒重为
加热至两次质量恒重为 (假设减少的质量仅仅是晶体失水),则x的表达式为
(假设减少的质量仅仅是晶体失水),则x的表达式为___________ (用含a、b的代数式表示)。
(3)利用摩尔盐分解产生的 ,可制取氯化亚砜
,可制取氯化亚砜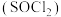 :
: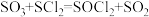 。已知
。已知 是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取
是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取 并检验生成的
并检验生成的 。
。
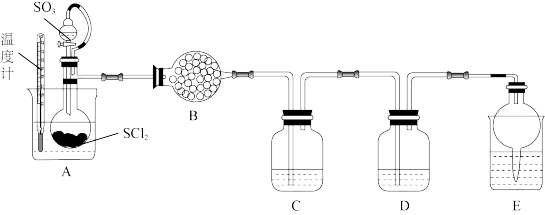
①装置B为无水 ,其作用是
,其作用是___________ 。
②装置C和装置D中的试剂分别是___________ 、___________ (填小写字母)。
a. 溶液 b.
溶液 b. 和
和 溶液 c.
溶液 c. 溶液 d.饱和的
溶液 d.饱和的 溶液
溶液
(4)利用摩尔盐分解产生的 ,设计实验探究亚硫酸与次氯酸的酸性强弱。
,设计实验探究亚硫酸与次氯酸的酸性强弱。
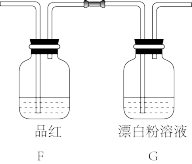
①将少量 气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是
气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是___________ (用化学反应方程式表示)。
②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置F中另一种试剂是___________ ,其作用是___________ ,通过___________ (填现象)即可证明亚硫酸的酸性强于次氯酸。
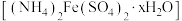 比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:(1)制备摩尔盐采用的方法是先在封闭体系中利用铁和稀硫酸反应制备硫酸亚铁溶液,再用新制的硫酸亚铁溶液和硫酸按饱和溶液反应制得。配制硫酸按饱和溶液的蒸馏水,需经煮沸并迅速冷却后再使用,目的是
(2)可以采用热重分析法测定摩尔盐样品中所含结晶水的个数,加热其晶体需要使用的实验仪器除了玻璃棒、三脚架、泥三角、酒精灯外,还需要的仪器有
 加热至两次质量恒重为
加热至两次质量恒重为 (假设减少的质量仅仅是晶体失水),则x的表达式为
(假设减少的质量仅仅是晶体失水),则x的表达式为(3)利用摩尔盐分解产生的
 ,可制取氯化亚砜
,可制取氯化亚砜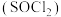 :
: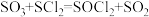 。已知
。已知 是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取
是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取 并检验生成的
并检验生成的 。
。
①装置B为无水
 ,其作用是
,其作用是②装置C和装置D中的试剂分别是
a.
 溶液 b.
溶液 b. 和
和 溶液 c.
溶液 c. 溶液 d.饱和的
溶液 d.饱和的 溶液
溶液(4)利用摩尔盐分解产生的
 ,设计实验探究亚硫酸与次氯酸的酸性强弱。
,设计实验探究亚硫酸与次氯酸的酸性强弱。
①将少量
 气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是
气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置F中另一种试剂是
您最近一年使用:0次
2022-07-15更新
|
303次组卷
|
2卷引用:河南省开封市五县2021-2022学年高二下学期期末考试化学试题
名校
8 . 某化学兴趣小组欲制备SO2并探究其某些性质。
(1)探究二氧化硫的漂白性
甲同学用如图所示装置(气密性良好)进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。

甲同学设计对照实验,但用足量碱石灰代替了氢氧化钠溶液,其原因是___ 。根据实验现象得出的实验结论是___ 。
(2)乙同学用如图所示装置验证二氧化硫的化学性质

①为验证二氧化硫的还原性,反应一段时间后,将试管d中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀。
上述方案合理的是___ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。试管d中发生反应的离子方程式为___ 。
②为了验证试管c中SO2与Fe3+发生了氧化还原反应,在如图装置中通入过量的SO2后,取试管c中的溶液分成三份,并设计了如下实验:
方案Ⅰ:向第一份溶液中加入酸性KMnO4溶液,紫色褪去;
方案Ⅱ:向第二份溶液中加入KSCN溶液不变红,再加入新制的氯水,溶液变红;
方案Ⅲ:向第三份溶液中加入用盐酸酸化的BaCl2溶液,产生白色沉淀。
指出上述不合理的方案并说明原因:___ 。试管e中发生反应的离子方程式为___ 。
(1)探究二氧化硫的漂白性
甲同学用如图所示装置(气密性良好)进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。

甲同学设计对照实验,但用足量碱石灰代替了氢氧化钠溶液,其原因是
(2)乙同学用如图所示装置验证二氧化硫的化学性质

①为验证二氧化硫的还原性,反应一段时间后,将试管d中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀。
上述方案合理的是
②为了验证试管c中SO2与Fe3+发生了氧化还原反应,在如图装置中通入过量的SO2后,取试管c中的溶液分成三份,并设计了如下实验:
方案Ⅰ:向第一份溶液中加入酸性KMnO4溶液,紫色褪去;
方案Ⅱ:向第二份溶液中加入KSCN溶液不变红,再加入新制的氯水,溶液变红;
方案Ⅲ:向第三份溶液中加入用盐酸酸化的BaCl2溶液,产生白色沉淀。
指出上述不合理的方案并说明原因:
您最近一年使用:0次
9 . 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂,是一种复盐,一般亚铁盐在空气中易被氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,利用这一性质可以用等物质的量的(NH4)2SO4和FeSO4混合制备。请回答以下问题:
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0g铁屑,加入15mLl0%Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1g。
步骤二:将步骤一中的m1g固体转移至锥形瓶,加入15mL3mol·L-1H2SO4,加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)碱煮30分钟的目的是____ 。
(2)步骤二中的加热,最佳加热方式为____ ,理由是____ 。
(3)关于步骤五中的一系列操作的相关表述,错误的是____ (填字母)。
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(4)B装置的作用是____ 。
(5)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式____ 。若去掉C,是否能得出同样结论,并解释其原因____ 。
(6)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。请填写表中的实验现象。
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0g铁屑,加入15mLl0%Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1g。
步骤二:将步骤一中的m1g固体转移至锥形瓶,加入15mL3mol·L-1H2SO4,加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)碱煮30分钟的目的是
(2)步骤二中的加热,最佳加热方式为
(3)关于步骤五中的一系列操作的相关表述,错误的是
| A.过滤时可使用玻璃棒搅拌的方式来缩短时间 |
| B.过滤和洗涤的速度都要尽可能的快,可以减少产品的氧化 |
| C.洗涤时使用无水乙醇既可以洗去晶体表面的杂质离子,又可以起到干燥作用 |
| D.所得的产品可以采取电热炉烘干的方式彻底干燥 |
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(4)B装置的作用是
(5)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式
(6)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。请填写表中的实验现象。
| 实验步骤 | 预期现象 | 结论 |
| ①取少量A中残留物于试管中,加入适量稀硫酸,充分振荡便其完全溶解;②将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液 | 固体残留物仅为Fe2O3 |
您最近一年使用:0次
解题方法
10 . 某化学小组制备 并验证
并验证 的部分性质,装置如图所示(部分夹持装置省略):
的部分性质,装置如图所示(部分夹持装置省略):

(1)仪器a的名称是___________ 。
(2)装置A制取 的反应中,利用了浓硫酸的
的反应中,利用了浓硫酸的___________ 性,___________ (填“能”或“不能”)用浓硝酸代替。
(3)在滴加浓硫酸之前,需先通入一段时间的 ,此操作的目的是
,此操作的目的是___________ 。
(4)装置B中的反应生成乳白色浑浊的同时生成了一种强碱,则该反应的化学方程式为___________ 。
(5)装置D验证了 的漂白性,为了进一步探究
的漂白性,为了进一步探究 与品红作用的可逆性,请写出有关实验操作及现象:
与品红作用的可逆性,请写出有关实验操作及现象:___________ 。
(6)为测定装置E中收集到的混合气体中二氧化硫的含量,进行如下操作:

当注入标准状况下10mL混合气体时,酸性 ,溶液恰好褪色,假设混合气体中
,溶液恰好褪色,假设混合气体中 能被
能被 溶液充分吸收。已知:
溶液充分吸收。已知: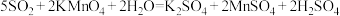 。该混合气体中二氧化硫的体积分数为
。该混合气体中二氧化硫的体积分数为___________ 。
 并验证
并验证 的部分性质,装置如图所示(部分夹持装置省略):
的部分性质,装置如图所示(部分夹持装置省略):
(1)仪器a的名称是
(2)装置A制取
 的反应中,利用了浓硫酸的
的反应中,利用了浓硫酸的(3)在滴加浓硫酸之前,需先通入一段时间的
 ,此操作的目的是
,此操作的目的是(4)装置B中的反应生成乳白色浑浊的同时生成了一种强碱,则该反应的化学方程式为
(5)装置D验证了
 的漂白性,为了进一步探究
的漂白性,为了进一步探究 与品红作用的可逆性,请写出有关实验操作及现象:
与品红作用的可逆性,请写出有关实验操作及现象:(6)为测定装置E中收集到的混合气体中二氧化硫的含量,进行如下操作:

当注入标准状况下10mL混合气体时,酸性
 ,溶液恰好褪色,假设混合气体中
,溶液恰好褪色,假设混合气体中 能被
能被 溶液充分吸收。已知:
溶液充分吸收。已知: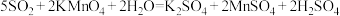 。该混合气体中二氧化硫的体积分数为
。该混合气体中二氧化硫的体积分数为
您最近一年使用:0次
2022-07-04更新
|
280次组卷
|
2卷引用:河南省平顶山市2021-2022学年高一下学期期末调研化学试题



