名校
1 . 甲、乙两组同学用不同的方法制备SO2并探究其性质。(夹持装置已略去)
I.甲组同学设计的实验装置如图所示,回答下列问题:
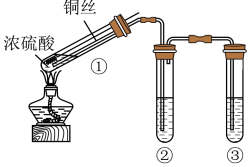
(1)试管①中反应的化学方程式是__________ 。
(2)试管②中的品红溶液褪色。欲证明品红褪色的原因是SO2,需要补充的实验操作及应出现的实验现象是__________ 。
(3)试管③中的试剂是NaOH溶液,反应的离子方程式 是___________ 。
Ⅱ .乙组同学设计的实验装置如下图所示,回答下列问题:
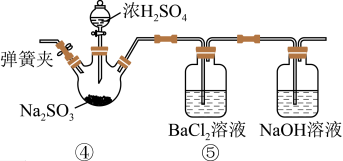
已知: BaSO3是白色难溶于水的物质,但可溶解于盐酸。
(4)④中反应的化学方程式是__________ 。
(5)⑤中产生了不溶于盐酸的白色沉淀,该沉淀是___________ 。
(6)经过分析,乙组同学认为装置中的空气是出现白色沉淀的原因。他们在不改变实验装置的情况下加入了某操作过程,证实了这种猜测是正确的。他们的操作及实验现象 是__________ 。
I.甲组同学设计的实验装置如图所示,回答下列问题:

(1)试管①中反应的化学方程式是
(2)试管②中的品红溶液褪色。欲证明品红褪色的原因是SO2,需要补充的实验操作及应出现的实验现象是
(3)试管③中的试剂是NaOH溶液,反应的
Ⅱ .乙组同学设计的实验装置如下图所示,回答下列问题:

已知: BaSO3是白色难溶于水的物质,但可溶解于盐酸。
(4)④中反应的化学方程式是
(5)⑤中产生了不溶于盐酸的白色沉淀,该沉淀是
(6)经过分析,乙组同学认为装置中的空气是出现白色沉淀的原因。他们在不改变实验装置的情况下加入了某操作过程,证实了这种猜测是正确的。他们的
您最近一年使用:0次
2019-03-03更新
|
640次组卷
|
4卷引用:北京市师范大学附属中学2018-2019学年高一上学期期末考试化学试题
解题方法
2 . 某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
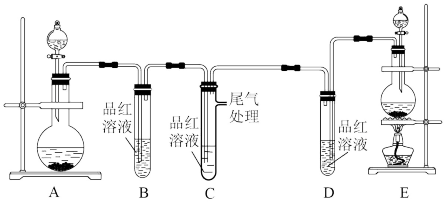
(1)制Cl2的原理:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,该反应中的还原剂是
MnCl2+Cl2↑+2H2O,该反应中的还原剂是______ 。制Cl2应选用装置______ (填字母)。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,褪色的原因______ (“相同”或“不同”)。停止通气后,给B、D两个试管中的液体加热,B试管中的现象是__________________ 。
(3)该小组同学将两种气体混合后通入品红溶液,一段时间后,C中品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是__________________ 。
(4)用NaOH溶液进行尾气处理,分别与两种气体进行反应的离子方程式__________________ 、__________________ 。

(1)制Cl2的原理:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O,该反应中的还原剂是
MnCl2+Cl2↑+2H2O,该反应中的还原剂是(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,褪色的原因
(3)该小组同学将两种气体混合后通入品红溶液,一段时间后,C中品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是
(4)用NaOH溶液进行尾气处理,分别与两种气体进行反应的离子方程式
您最近一年使用:0次
14-15高三上·吉林延边·阶段练习
名校
解题方法
3 . 某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
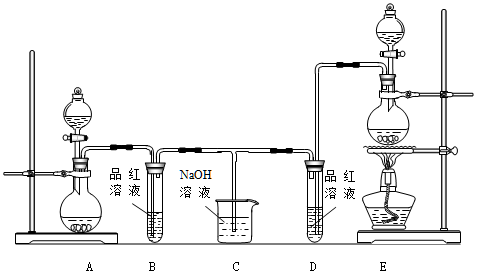
(1)他们制备Cl2依据的原理是:MnO2+ 4HCl(浓)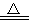 MnCl2+ 2H2O + Cl2↑,应选用上图A、E装置中的
MnCl2+ 2H2O + Cl2↑,应选用上图A、E装置中的_____ (填序号)制Cl2,反应中浓盐酸所表现出的性质是__________ 、__________ 。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是__________________________ 。
(3)NaOH溶液分别与两种气体反应的离子方程式是___________ 、_________ 。
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是_________________ 。

(1)他们制备Cl2依据的原理是:MnO2+ 4HCl(浓)
 MnCl2+ 2H2O + Cl2↑,应选用上图A、E装置中的
MnCl2+ 2H2O + Cl2↑,应选用上图A、E装置中的(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是
(3)NaOH溶液分别与两种气体反应的离子方程式是
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是
您最近一年使用:0次
2016-12-13更新
|
770次组卷
|
3卷引用:2016-2017学年北京五十六中九高三上学期期中考试化学试卷
名校
解题方法
4 . 下图是实验室制取SO2并验证SO2某些性质的装置图。若观察到装置④中有淡黄色沉淀生成,⑤中的溴水褪色(已知因含有Br2而溴水呈红棕色),请回答:
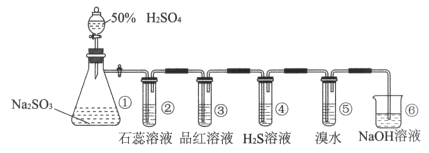
(1)①中发生反应的离子方程式是_______________ 。
(2)②中的实验现象是_____________ 。
(3)③的实验现象是_______________ ,证明SO2有_________ 性。
(4)④中SO2做____________ 剂。
(5)⑤中反应生成两种强酸,该反应的离子方程式是_______________ ,当1 molSO2参与反应时,转移电子的物质的量是_________ 。
(6)⑥的作用是_______________ 。

(1)①中发生反应的离子方程式是
(2)②中的实验现象是
(3)③的实验现象是
(4)④中SO2做
(5)⑤中反应生成两种强酸,该反应的离子方程式是
(6)⑥的作用是
您最近一年使用:0次
2016-12-09更新
|
723次组卷
|
7卷引用:2015-2016学年北京市东城区高一上学期期末考试化学试卷
2015-2016学年北京市东城区高一上学期期末考试化学试卷2015-2016学年河南省鹤壁市淇县一中高一下学期分班考试化学试卷2015-2016学年山东省济宁市微山一中高一重点班下入学检测化学试卷2015-2016学年山东省济宁市微山一中高一普通班下入学检测化学试卷(已下线)4.1.1 二氧化硫的性质与应用练习(1)——《高中新教材同步备课》(苏教版 必修第一册)江苏省沭阳县修远中学2020-2021学年高一上学期第二次月考化学试题(已下线)5.1.1 硫及其氧化物——同步学习必备知识
5 . 为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是____________________ 。
(2)棉花中浸润的溶液为__________________ 。
(3)A中发生反应的化学方程式为_______________ 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________ 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是_______ (填“甲”“乙”“丙”)。
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+ SO32-(aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
某同学设计如下实验,证实该假设成立:

①溶液E和F分别为____________ 、__________ 。
②请用化学平衡原理解释步骤3中溶液由红棕色变为浅绿色的原因____________ 。

实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是
(2)棉花中浸润的溶液为
(3)A中发生反应的化学方程式为
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是
| 过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+ SO32-(aq)
 FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
某同学设计如下实验,证实该假设成立:

①溶液E和F分别为
②请用化学平衡原理解释步骤3中溶液由红棕色变为浅绿色的原因
您最近一年使用:0次
名校
解题方法
6 . 焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂。
某研究小组对焦亚硫酸钠进行如下研究:
(1)采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。
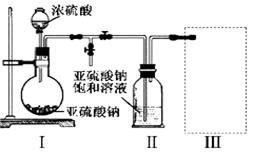
装置Ⅱ中有Na2S2O5析出,发生的化学反应方程式为:Na2SO3+ SO2= Na2S2O5。
①装置Ⅰ中产生气体的化学方程式为_____________________________ 。
②要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______________ 。
③装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为______ (填序号)。
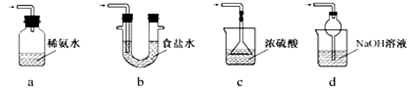
(2)【查阅资料】Na2S2O5溶于水即生成NaHSO3。
①NaHSO3溶液显酸性。请用化学用语和必要的文字解释原因________________________________ ;
证明该结论可采用的实验方法是_______________ (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
②检验Na2S2O5晶体在空气中已被氧化的实验方案是__________________ 。
(3)焦亚硫酸钠(Na2S2O5)在酸性条件下可将工业废水中的Cr2O72—还原为Cr3+。
①写出该反应的离子方程式_______________________ 。
②若处理Cr2O72—浓度为1×10-3mol/L的工业废水1L,需用Na2S2O5固体_________ mg。
某研究小组对焦亚硫酸钠进行如下研究:
(1)采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。

装置Ⅱ中有Na2S2O5析出,发生的化学反应方程式为:Na2SO3+ SO2= Na2S2O5。
①装置Ⅰ中产生气体的化学方程式为
②要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是
③装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为

(2)【查阅资料】Na2S2O5溶于水即生成NaHSO3。
①NaHSO3溶液显酸性。请用化学用语和必要的文字解释原因
证明该结论可采用的实验方法是
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
②检验Na2S2O5晶体在空气中已被氧化的实验方案是
(3)焦亚硫酸钠(Na2S2O5)在酸性条件下可将工业废水中的Cr2O72—还原为Cr3+。
①写出该反应的离子方程式
②若处理Cr2O72—浓度为1×10-3mol/L的工业废水1L,需用Na2S2O5固体
您最近一年使用:0次
2016-12-09更新
|
314次组卷
|
2卷引用:2015届北京市延庆县高三3月模拟理综化学试卷
2014·北京通州·一模
名校
解题方法
7 . 节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。
(1)他们设计如下实验装置,请你参与探究,并回答问题:
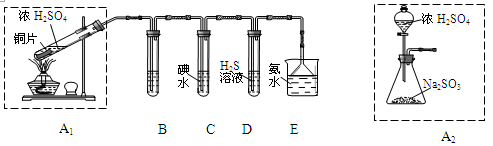
①装置A1中发生反应的化学方程式为_______________________________________________ ;
②装置B用于检验SO2的漂白性,其中所盛试剂为________ ,装置D用于检验SO2的_______ 性质;
③装置C中反应的离子方程式为________________________________________________ ;
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写二点)_________________ 、_________________ ;
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)。

①你认为哪个装置可行(填序号)______ ,使用你所选用的装置测定SO2含量时,还需要测定的物理量是_____________________________ ;
②你认为哪个装置不可行(填序号)______ ,说明理由____________________________________ 。
(1)他们设计如下实验装置,请你参与探究,并回答问题:

①装置A1中发生反应的化学方程式为
②装置B用于检验SO2的漂白性,其中所盛试剂为
③装置C中反应的离子方程式为
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写二点)
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)。

①你认为哪个装置可行(填序号)
②你认为哪个装置不可行(填序号)
您最近一年使用:0次
2016-12-09更新
|
652次组卷
|
3卷引用:2014届北京市通州区高三年级模拟考试(一)理综化学试卷
(已下线)2014届北京市通州区高三年级模拟考试(一)理综化学试卷河北省张家口市第一中学2016-2017学年高一(实验班、普通班)6月月考(理)化学试题2020届高考化学二轮复习大题精准训练 ——定性分析探究实验题



