1 . 实验小组制备硫代硫酸钠(Na2S2O3)并探究其性质。
资料:ⅰ.S2O +2H+=S↓+SO2↑+H2O。
+2H+=S↓+SO2↑+H2O。
ⅱ.Fe3++3S2O
 Fe(S2O3)
Fe(S2O3) (紫黑色)。
(紫黑色)。
ⅲ.Ag2S2O3是难溶于水、可溶于Na2S2O3溶液的白色固体。
(1)实验室可利用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制备Na2S2O3,装置如图。
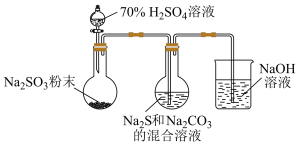
①用化学用语解释Na2S和Na2CO3的混合溶液呈碱性的原因:S2-+H2O HS-+OH-、
HS-+OH-、___ 。
②为了保证Na2S2O3的产量,实验中要控制SO2的量。若要降低SO2的生成速率,可以采取的措施有:___ (写出一条)。
(2)探究Na2S2O3溶液与不同金属的硫酸盐溶液间反应的多样性。
①Ⅰ中产生白色沉淀的离子方程式为___ 。
②经检验,现象Ⅱ中的沉淀有Al(OH)3和S,用平衡移动原理解释Ⅱ中的现象:__ 。
③经检验,现象Ⅲ中的无色溶液中含有Fe2+。从化学反应速率和限度的角度解释Ⅲ中Fe3+与S2O 反应的实验现象:
反应的实验现象:___ 。
以上实验说明:Na2S2O3溶液与金属阳离子反应的多样性和阳离子的性质有关。
资料:ⅰ.S2O
 +2H+=S↓+SO2↑+H2O。
+2H+=S↓+SO2↑+H2O。ⅱ.Fe3++3S2O

 Fe(S2O3)
Fe(S2O3) (紫黑色)。
(紫黑色)。ⅲ.Ag2S2O3是难溶于水、可溶于Na2S2O3溶液的白色固体。
(1)实验室可利用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制备Na2S2O3,装置如图。

①用化学用语解释Na2S和Na2CO3的混合溶液呈碱性的原因:S2-+H2O
 HS-+OH-、
HS-+OH-、②为了保证Na2S2O3的产量,实验中要控制SO2的量。若要降低SO2的生成速率,可以采取的措施有:
(2)探究Na2S2O3溶液与不同金属的硫酸盐溶液间反应的多样性。
| 实验 | 试剂 | 现象 | |
| 试管 | 滴管 | ||
 | 2mL0.1mol/LNa2S2O3溶液 | Ag2SO4溶液(浓度约为0.03mol/L) | Ⅰ.局部生成白色沉淀,振荡后沉淀溶解,得到无色溶液 |
| 0.03mol/LAl2(SO4)3溶液 | Ⅱ.一段时间后,生成沉淀 | ||
| 0.03mol/LFe2(SO4)3溶液 | Ⅲ.混合后溶液先变成紫黑色,30s时溶液几乎变为无色 | ||
②经检验,现象Ⅱ中的沉淀有Al(OH)3和S,用平衡移动原理解释Ⅱ中的现象:
③经检验,现象Ⅲ中的无色溶液中含有Fe2+。从化学反应速率和限度的角度解释Ⅲ中Fe3+与S2O
 反应的实验现象:
反应的实验现象:以上实验说明:Na2S2O3溶液与金属阳离子反应的多样性和阳离子的性质有关。
您最近一年使用:0次
2021-11-15更新
|
251次组卷
|
5卷引用:北京市西城区2020-2021学年高二上学期期末考试化学试题
2 . 有试验装置如图,将Mg放在导热性良好的惰性金属片上置于C管中进行实验。实验步骤为:先关闭K,使A管中反应进行,加热玻璃管C,可观察到C管中发出耀眼的白光,管壁上附有淡黄色物质。实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。B为橡胶气胆。
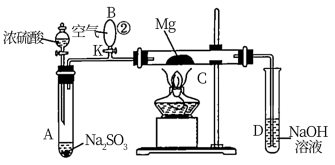
(1)C管中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为_______ 。
(2)停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯。橡胶气胆B在实验中的作用是_______ 。
(3)C中全部反应产物有_______ 。
(4)检验气密性并盛放药品后,实验前应采取的措施是_______ ,其目的是_______ 。

(1)C管中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为
(2)停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯。橡胶气胆B在实验中的作用是
(3)C中全部反应产物有
(4)检验气密性并盛放药品后,实验前应采取的措施是
您最近一年使用:0次
名校
3 . 某学习小组用下图所示实验检验浓硫酸与铜反应产生的二氧化硫(图中夹持装置已略去)。
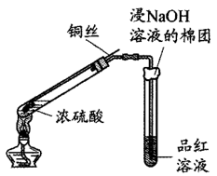
已知:浓硫酸的沸点为338℃,酒精灯外焰温度一般为500℃左右。
(1)浸有NaOH溶液的棉团作用是___________ 。
(2)能证明铜丝与浓硫酸反应产生了SO2的实验现象为___________ 。铜丝与浓硫酸反应的化学方程式为___________ 。
(3)将品红溶液换为Ba(OH)2溶液,发现其中产生白色沉淀。小组同学认为此现象不足以说明Cu和浓硫酸反应产生了SO2,其原因是___________ 。

已知:浓硫酸的沸点为338℃,酒精灯外焰温度一般为500℃左右。
(1)浸有NaOH溶液的棉团作用是
(2)能证明铜丝与浓硫酸反应产生了SO2的实验现象为
(3)将品红溶液换为Ba(OH)2溶液,发现其中产生白色沉淀。小组同学认为此现象不足以说明Cu和浓硫酸反应产生了SO2,其原因是
您最近一年使用:0次
2021-06-20更新
|
250次组卷
|
2卷引用:北京市海淀区2020-2021学年高一下学期学业水平合格性考试适应练习化学试题
名校
4 . 某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质。(夹持装置已略去)
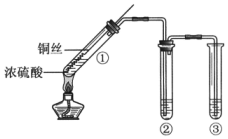
(1)试管①中反应的化学方程式是___________ ;
(2)若试管②中的试剂为品红溶液, 实验中观察到的现象是___________ ;若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有___________ 性。
(3)试管③中的试剂为NaOH溶液,反应的离子方程式是___________ 。

(1)试管①中反应的化学方程式是
(2)若试管②中的试剂为品红溶液, 实验中观察到的现象是
(3)试管③中的试剂为NaOH溶液,反应的离子方程式是
您最近一年使用:0次
2021-05-13更新
|
121次组卷
|
2卷引用:北京三中2020-2021学年高一下学期期中考试化学试题
5 . 某实验小组欲探究SO2和Cl2能否发生反应,设计如图所示的实验装置进行实验。
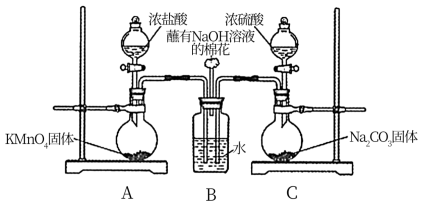
(1)装置A用来制备_______ 。
(2)装置C中发生复分解反应制取SO2,该反应的化学方程式:_______ 。
(3)为验证SO2和Cl2发生了反应,小组同学又继续如下实验。
①甲同学认为若SO2和Cl2反应,生成了Cl-,只要检验到生成的Cl-即可。
②乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法实验即可得到正确结论。洗气瓶中盛有试剂的名称是_______ 。
③丙同学认为按乙同学的建议改进实验也不合理,理由是:_______ 。
④丁同学则认为甲、乙同学的结论均不合理。丁同学取适量B中溶液于试管中,向其中滴加少量溶液X,生成白色沉淀,得出结论:SO2与Cl2同时通入水中,可以发生反应。溶液X是_______ (填选项序号)。
a.BaCl2溶液b.Ba(OH)2溶液c.氯水d.石蕊溶液
 SO2与Cl2同时通入水中反应的化学方程式是
SO2与Cl2同时通入水中反应的化学方程式是_______

(1)装置A用来制备
(2)装置C中发生复分解反应制取SO2,该反应的化学方程式:
(3)为验证SO2和Cl2发生了反应,小组同学又继续如下实验。
①甲同学认为若SO2和Cl2反应,生成了Cl-,只要检验到生成的Cl-即可。
②乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法实验即可得到正确结论。洗气瓶中盛有试剂的名称是
③丙同学认为按乙同学的建议改进实验也不合理,理由是:
④丁同学则认为甲、乙同学的结论均不合理。丁同学取适量B中溶液于试管中,向其中滴加少量溶液X,生成白色沉淀,得出结论:SO2与Cl2同时通入水中,可以发生反应。溶液X是
a.BaCl2溶液b.Ba(OH)2溶液c.氯水d.石蕊溶液
 SO2与Cl2同时通入水中反应的化学方程式是
SO2与Cl2同时通入水中反应的化学方程式是
您最近一年使用:0次
6 . 实验小组对SO2的性质进行探究。用如图所示装置进行实验。
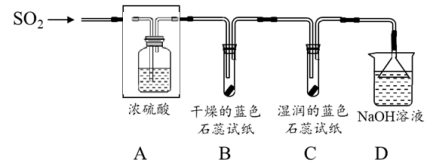
(1)A的装置中浓硫酸的作用是_______ 。
(2)实验过程中,说明SO2与水反应生成了酸的实验现象是_______ 。
(3)D的装置中发生反应的化学方程式为_______ 。

(1)A的装置中浓硫酸的作用是
(2)实验过程中,说明SO2与水反应生成了酸的实验现象是
(3)D的装置中发生反应的化学方程式为
您最近一年使用:0次
7 . 氧族元素(O、S、Se等)及其化合物在生产生活中发挥着巨大作用。
(1)实验室用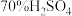 溶液和
溶液和 粉末在常温下反应制备
粉末在常温下反应制备 ,装置如图。
,装置如图。
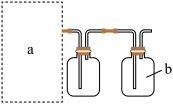
①将虚线框a内的仪器补充完整(夹持装置可省略)。___________
②b为尾气吸收装置,其中的试剂为___________ 。
(2)生物浸出法可有效回收含硫矿石中的有色金属,某种生物浸出法中主要物质的转化路径如图。
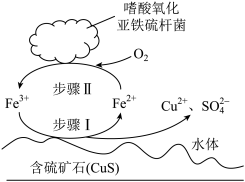
①步骤Ⅰ反应的离子方程式为___________ 。
②生物浸出法的总反应的氧化剂是___________ 。
(3)以工业硒为原料制备高纯硒的流程如图。
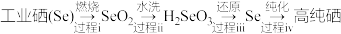
①下列说法正确的是___________ (填字母序号)。
a.过程i到过程ⅲ均为氧化还原反应
b. 既有氧化性,又有还原性
既有氧化性,又有还原性
c. 能与NaOH反应生成
能与NaOH反应生成 和
和
d.Se与 化合比S与
化合比S与 化合容易
化合容易
②过程ⅲ中使用的还原剂为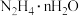 ,对应产物是
,对应产物是 。理论上,过程i消耗的
。理论上,过程i消耗的 与过程消耗的
与过程消耗的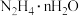 的物质的量之比为
的物质的量之比为___________ (工业硒中杂质与 的反应可忽略)。
的反应可忽略)。
(1)实验室用
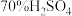 溶液和
溶液和 粉末在常温下反应制备
粉末在常温下反应制备 ,装置如图。
,装置如图。
①将虚线框a内的仪器补充完整(夹持装置可省略)。
②b为尾气吸收装置,其中的试剂为
(2)生物浸出法可有效回收含硫矿石中的有色金属,某种生物浸出法中主要物质的转化路径如图。

①步骤Ⅰ反应的离子方程式为
②生物浸出法的总反应的氧化剂是
(3)以工业硒为原料制备高纯硒的流程如图。
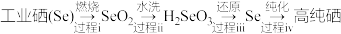
①下列说法正确的是
a.过程i到过程ⅲ均为氧化还原反应
b.
 既有氧化性,又有还原性
既有氧化性,又有还原性c.
 能与NaOH反应生成
能与NaOH反应生成 和
和
d.Se与
 化合比S与
化合比S与 化合容易
化合容易②过程ⅲ中使用的还原剂为
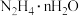 ,对应产物是
,对应产物是 。理论上,过程i消耗的
。理论上,过程i消耗的 与过程消耗的
与过程消耗的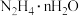 的物质的量之比为
的物质的量之比为 的反应可忽略)。
的反应可忽略)。
您最近一年使用:0次
2021-05-10更新
|
397次组卷
|
3卷引用:北京市海淀区2021届高三二模化学试题
8 . 某实验小组同学欲探究二氧化硫的性质,并比较碳和硅的非金属性,设计了如下图所示的A、B、C实验装置(各装置气密性良好)。已知酸性:H2SO3>H2CO3。
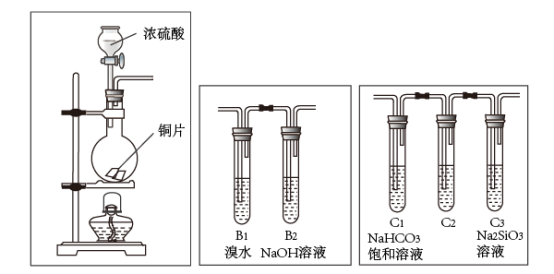
(1)实验一:制备SO2
烧瓶中发生反应的化学方程式是_______ 。
(2)实验二:研究SO2的性质:将A与B相连,待产生SO2后,可见B1中溴水逐渐褪色。
①B1中溴水褪色的原因是(用化学方程式表示)_______ 。
②已知试管B2中的溶液过量,则反应的离子方程式是_______ 。
(3)实验三:比较碳、硅的非金属性
①C2中试剂是_______ ,其作用是_______ 。
②能说明碳的非金属性比硅强的实验现象是_______ 。

(1)实验一:制备SO2
烧瓶中发生反应的化学方程式是
(2)实验二:研究SO2的性质:将A与B相连,待产生SO2后,可见B1中溴水逐渐褪色。
①B1中溴水褪色的原因是(用化学方程式表示)
②已知试管B2中的溶液过量,则反应的离子方程式是
(3)实验三:比较碳、硅的非金属性
①C2中试剂是
②能说明碳的非金属性比硅强的实验现象是
您最近一年使用:0次
名校
9 . 为验证 SO2的相关性质,某化学兴趣小组利用硬质玻璃管设计了如图所示的微型实验装置(夹持仪器已省略),实验时将浓硫酸滴入装有 Na2SO3固体的培养皿中,观察实验现象,并回答下列问题。
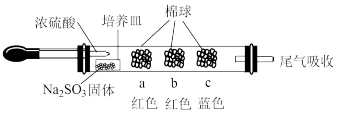
(1)浓硫酸与亚硫酸钠固体反应的化学方程式为___________ 。
(2)请填写表中空白:

(1)浓硫酸与亚硫酸钠固体反应的化学方程式为
(2)请填写表中空白:
| 棉球 | 棉球上蘸有的试剂 | 实验现象 | 解释或结论 |
| a | 棉球变白;棉球微热后变红 | 该气体具有漂白性 | |
| b | 含酚酞的NaOH 溶液 | 棉球变为白色 | 离子方程式: |
| c | I2与淀粉的混合溶液 | 棉球变为白色 | 化学方程式: |
您最近一年使用:0次
2021-02-01更新
|
595次组卷
|
3卷引用:北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题
北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题北京师范大学附属实验中学2021-2022学年高一上学期1月期末测试化学试题(已下线)专题01 硫及其化合物【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)
10 . 制备二氧化硫并研究其性质,实验装置如下图所示。

(1)A中铜与浓硫酸反应的化学方程式为_________ 。
(2)能证明SO2具有漂白性的实验现象是________ 。
(3)浸氢氧化钠溶液的棉花团的作用是_________ ,反应的离子方程式为_________ 。

(1)A中铜与浓硫酸反应的化学方程式为
(2)能证明SO2具有漂白性的实验现象是
(3)浸氢氧化钠溶液的棉花团的作用是
您最近一年使用:0次
2020-09-21更新
|
254次组卷
|
2卷引用:北京市丰台区2020年普通高中合格性考试调研化学试题



