1 . 某化学兴趣小组为探究 的性质,按如图所示装置进行实验。
的性质,按如图所示装置进行实验。
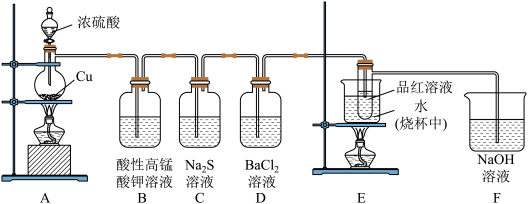
(1)装置A中反应的化学方程式为___________ 。
(2)装置B中酸性 溶液褪色,反应的离子方程式是
溶液褪色,反应的离子方程式是___________ 。装置C中产生淡黄色浑浊,体现了 的
的___________ 性。
(3)通入足量 后D中仍无明显现象,将其分成两份,分别加入列物质后均产生白色沉淀。
后D中仍无明显现象,将其分成两份,分别加入列物质后均产生白色沉淀。
(4)装置E的目的是探究 与品红作用的可逆性,请写出实验操作及现象
与品红作用的可逆性,请写出实验操作及现象___________ 。
(5)F装置中发生反应的离子方程式为___________ 。
 的性质,按如图所示装置进行实验。
的性质,按如图所示装置进行实验。
(1)装置A中反应的化学方程式为
(2)装置B中酸性
 溶液褪色,反应的离子方程式是
溶液褪色,反应的离子方程式是 的
的(3)通入足量
 后D中仍无明显现象,将其分成两份,分别加入列物质后均产生白色沉淀。
后D中仍无明显现象,将其分成两份,分别加入列物质后均产生白色沉淀。| 加入的物质 |  | 氨水 |
| 沉淀的化学式 | ① | ② |
 与品红作用的可逆性,请写出实验操作及现象
与品红作用的可逆性,请写出实验操作及现象(5)F装置中发生反应的离子方程式为
您最近一年使用:0次
名校
2 . 为探究 、
、 、
、 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
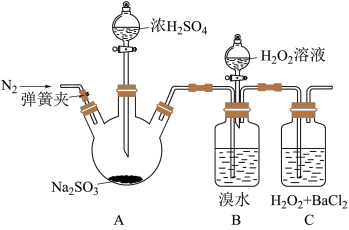
(1)A中发生反应的化学方程式是_______ 。B中红棕色褪色的化学方程式:_________ 。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性: 。乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是
。乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是___________ 。
(3)iii中滴入少量 没有明显变化。提出假设:
没有明显变化。提出假设:
观点1: 的量少不能氧化
的量少不能氧化
观点2:B中有未反应的
为验证观点2,应进行的实验操作及现象是___________ 。
(4)通过上述全部实验,得出结论: 、
、 、
、 氧化性由强到弱的顺序是
氧化性由强到弱的顺序是___________ 。
 、
、 、
、 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
| 实验操作 | 实验现象 |
| i.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ii.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
iii.打开B中分液漏斗活塞,逐滴滴加 | 开始时颜色无明显变化;继续滴加 溶液,一段时间后,混合液逐渐变成红棕色 溶液,一段时间后,混合液逐渐变成红棕色 |
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:
 。乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是
。乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是(3)iii中滴入少量
 没有明显变化。提出假设:
没有明显变化。提出假设:观点1:
 的量少不能氧化
的量少不能氧化
观点2:B中有未反应的

为验证观点2,应进行的实验操作及现象是
(4)通过上述全部实验,得出结论:
 、
、 、
、 氧化性由强到弱的顺序是
氧化性由强到弱的顺序是
您最近一年使用:0次
名校
解题方法
3 .  是中学化学的核心物质。
是中学化学的核心物质。
(一)实验小组研究 与
与 的反应。
的反应。
(1)实验前分析物质的化学性质,提出假设:
假设1: 和
和 都是酸性氧化物。写出
都是酸性氧化物。写出 与
与 反应的化学方程式
反应的化学方程式___________ ,类比可知 与
与 反应生成
反应生成 和
和 ;
;
假设2: 具有
具有___________ 性, 与
与 反应生成
反应生成 。
。
(2)用下图所示装置进行 与
与 反应的实验。实验过程中,观察到C中淡黄色粉末逐渐变为白色,用带火星的木条靠近D中导气管口,木条复燃。
反应的实验。实验过程中,观察到C中淡黄色粉末逐渐变为白色,用带火星的木条靠近D中导气管口,木条复燃。
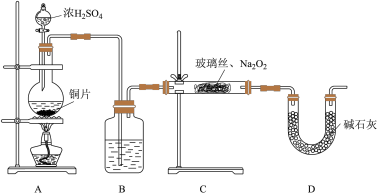
①A中发生反应的化学方程式为___________ 。
②B中的试剂为___________ ,其主要作用是干燥 。
。
③能证明假设1成立的实验现象是___________ 。
(3)为检验C中是否有 生成,设计如下方案:取少量C中反应后的白色固体溶解于水,加入
生成,设计如下方案:取少量C中反应后的白色固体溶解于水,加入 溶液,产生白色沉淀,再加入足量的稀
溶液,产生白色沉淀,再加入足量的稀 ,仍有白色沉淀不溶解,证明有
,仍有白色沉淀不溶解,证明有 生成。有同学认为该方案不合理,请简要说明理由:
生成。有同学认为该方案不合理,请简要说明理由:___________ 。
(4)进一步实验证明C中反应后的固体既有 ,又有
,又有 ,写出生成
,写出生成 的反应
的反应___________ 。
(5)实验小组分别向等体积的不含 ,含有
,含有 的
的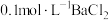 溶液中通入
溶液中通入 ,探究体系中物质间的相互作用,体系
,探究体系中物质间的相互作用,体系 变化如图所示,不含
变化如图所示,不含 的
的 溶液中没有白色沉淀,含有
溶液中没有白色沉淀,含有 的
的 溶液中产生白色沉淀。(已知:
溶液中产生白色沉淀。(已知: 越小,溶液酸性越强)下列说法正确的是
越小,溶液酸性越强)下列说法正确的是___________ 。

A.a所示溶液的 降低的原因:
降低的原因: 与
与 反应生成
反应生成 ,溶液的
,溶液的 增大
增大
B.b所示溶液中发生反应: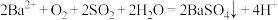
C. 通入不含
通入不含 的
的 溶液后,再通入
溶液后,再通入 ,产生
,产生 沉淀
沉淀
(二)脱除燃煤烟气中 的一种工业流程如下:
的一种工业流程如下:

(6)用纯碱溶液吸收 将其转化为
将其转化为 ,反应的离子方程式是
,反应的离子方程式是___________ 。
(7)再生池中加过量的石灰乳实现再生,部分产物可排回吸收池吸收 。用于吸收
。用于吸收 的产物是
的产物是___________ 。
 是中学化学的核心物质。
是中学化学的核心物质。(一)实验小组研究
 与
与 的反应。
的反应。(1)实验前分析物质的化学性质,提出假设:
假设1:
 和
和 都是酸性氧化物。写出
都是酸性氧化物。写出 与
与 反应的化学方程式
反应的化学方程式 与
与 反应生成
反应生成 和
和 ;
;假设2:
 具有
具有 与
与 反应生成
反应生成 。
。(2)用下图所示装置进行
 与
与 反应的实验。实验过程中,观察到C中淡黄色粉末逐渐变为白色,用带火星的木条靠近D中导气管口,木条复燃。
反应的实验。实验过程中,观察到C中淡黄色粉末逐渐变为白色,用带火星的木条靠近D中导气管口,木条复燃。
①A中发生反应的化学方程式为
②B中的试剂为
 。
。③能证明假设1成立的实验现象是
(3)为检验C中是否有
 生成,设计如下方案:取少量C中反应后的白色固体溶解于水,加入
生成,设计如下方案:取少量C中反应后的白色固体溶解于水,加入 溶液,产生白色沉淀,再加入足量的稀
溶液,产生白色沉淀,再加入足量的稀 ,仍有白色沉淀不溶解,证明有
,仍有白色沉淀不溶解,证明有 生成。有同学认为该方案不合理,请简要说明理由:
生成。有同学认为该方案不合理,请简要说明理由:(4)进一步实验证明C中反应后的固体既有
 ,又有
,又有 ,写出生成
,写出生成 的反应
的反应(5)实验小组分别向等体积的不含
 ,含有
,含有 的
的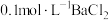 溶液中通入
溶液中通入 ,探究体系中物质间的相互作用,体系
,探究体系中物质间的相互作用,体系 变化如图所示,不含
变化如图所示,不含 的
的 溶液中没有白色沉淀,含有
溶液中没有白色沉淀,含有 的
的 溶液中产生白色沉淀。(已知:
溶液中产生白色沉淀。(已知: 越小,溶液酸性越强)下列说法正确的是
越小,溶液酸性越强)下列说法正确的是
A.a所示溶液的
 降低的原因:
降低的原因: 与
与 反应生成
反应生成 ,溶液的
,溶液的 增大
增大B.b所示溶液中发生反应:
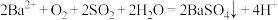
C.
 通入不含
通入不含 的
的 溶液后,再通入
溶液后,再通入 ,产生
,产生 沉淀
沉淀(二)脱除燃煤烟气中
 的一种工业流程如下:
的一种工业流程如下:
(6)用纯碱溶液吸收
 将其转化为
将其转化为 ,反应的离子方程式是
,反应的离子方程式是(7)再生池中加过量的石灰乳实现再生,部分产物可排回吸收池吸收
 。用于吸收
。用于吸收 的产物是
的产物是
您最近一年使用:0次
2023-03-11更新
|
367次组卷
|
2卷引用:北京市顺义牛栏山第一中学2022-2023学年高一下学期3月月考化学试题
名校
4 . “绿水青山就是金山银山”,SO2的治理是环境保护中的重要问题。某同学利用下图所示装置研究二氧化硫气体的性质。
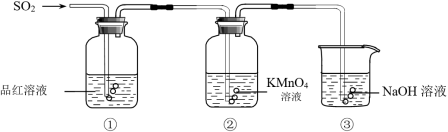
(1)实验室用亚硫酸钠固体和浓硫酸共热制取二氧化硫,该反应的化学方程式是_______ 。
(2)当观察到②中溶液颜色变浅时,①中的现象是_______ 。
(3)装置③的作用(用离子方程式表示)_______ 。
(4)硒(Se)最外层电子数也为6,其单质及化合物化学性质与硫及其化合物类似,某混合物中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
i.将该混合物与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ⅱ.用水吸收i中混合气体,可得Se固体
①请写出CuSe与浓H2SO4反应的化学方程式_______ 。
②焙烧过程产生的烟气中含有少量SeO2,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为_______ 。
③写出步骤ⅱ中的化学方程式_______ 。
(5)下列说法合理的是_______ 。
a.SeO2既有氧化性又有还原性
b.浓硒酸可能具有强氧化性、脱水性
c.H2Se中的Se只表现还原性

(1)实验室用亚硫酸钠固体和浓硫酸共热制取二氧化硫,该反应的化学方程式是
(2)当观察到②中溶液颜色变浅时,①中的现象是
(3)装置③的作用(用离子方程式表示)
(4)硒(Se)最外层电子数也为6,其单质及化合物化学性质与硫及其化合物类似,某混合物中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
i.将该混合物与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ⅱ.用水吸收i中混合气体,可得Se固体
①请写出CuSe与浓H2SO4反应的化学方程式
②焙烧过程产生的烟气中含有少量SeO2,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为
③写出步骤ⅱ中的化学方程式
(5)下列说法合理的是
a.SeO2既有氧化性又有还原性
b.浓硒酸可能具有强氧化性、脱水性
c.H2Se中的Se只表现还原性
您最近一年使用:0次
5 . 下图装置是 气体的制备和性质验证装置。
气体的制备和性质验证装置。_______ 。
(2)装置B是除杂装置,B中的试剂x是_______ (填序号)。
a.饱和 溶液 b.饱和
溶液 b.饱和 溶液 c.饱和
溶液 c.饱和 溶液
溶液
(3)小组同学观察到C、D中溶液均褪色。反应后C中溶液含有 ,反应的离子方程式是
,反应的离子方程式是_______ 。
(4)上述实验说明了或利用了 的_______(填序号)。
的_______(填序号)。
 气体的制备和性质验证装置。
气体的制备和性质验证装置。
(2)装置B是除杂装置,B中的试剂x是
a.饱和
 溶液 b.饱和
溶液 b.饱和 溶液 c.饱和
溶液 c.饱和 溶液
溶液(3)小组同学观察到C、D中溶液均褪色。反应后C中溶液含有
 ,反应的离子方程式是
,反应的离子方程式是(4)上述实验说明了或利用了
 的_______(填序号)。
的_______(填序号)。| A.还原性 | B.氧化性 | C.酸性氧化物的性质 | D.漂白性 |
您最近一年使用:0次
2023-01-06更新
|
275次组卷
|
2卷引用:北京市北京师范大学附属实验中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
6 . 某小组用如下装置制备并探究 的性质。
的性质。 时发生反应的化学方程式为
时发生反应的化学方程式为_______ 。若所用硫酸的浓度较低,反应时观察不到气泡产生,可能的原因是_______ 。
(2)能体现 与水反应生成酸性物质的实验现象是
与水反应生成酸性物质的实验现象是_______ 。
(3)②中观察到淡黄色固体生成,说明 具有
具有_______ (填“氧化”或“还原”)性。
(4)③中观察到蓝色褪去, 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(5)蘸有 溶液的棉花的作用是
溶液的棉花的作用是_______ 。
 的性质。
的性质。
 时发生反应的化学方程式为
时发生反应的化学方程式为(2)能体现
 与水反应生成酸性物质的实验现象是
与水反应生成酸性物质的实验现象是(3)②中观察到淡黄色固体生成,说明
 具有
具有(4)③中观察到蓝色褪去,
 发生反应的离子方程式为
发生反应的离子方程式为(5)蘸有
 溶液的棉花的作用是
溶液的棉花的作用是
您最近一年使用:0次
2023-01-05更新
|
394次组卷
|
3卷引用:北京市海淀区2022-2023学年高一上学期期末考试化学试题
7 . 某研究小组用下列装置(夹持装置已略去)研究不同价态硫元素之间的转化。
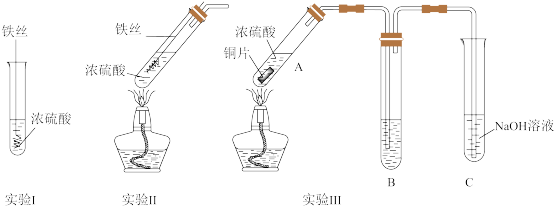
(1)实验I中铁丝表面迅速变黑,反应很快停止,其原因是______ 。
(2)实验II中产生大量气体。甲同学猜测该实验实现了 →
→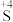 的转化,设计实验证明实现了该转化,实验操作及现象是
的转化,设计实验证明实现了该转化,实验操作及现象是______ 。
(3)实验III试管A中反应的化学方程式为______ 。
①若B中为紫色石蕊溶液,现象为______ 。
②若B为Na2S酸性溶液,观察到出现淡黄色的固体,写出反应的离子方程式______ 。
③若B为新制氯水,观察到氯水褪色,推测该反应中硫元素的化合价变化为:由______ 价转化为______ 价;为证实产物中氯元素的存在形式,某同学设计实验:向反应后的试管中加入硝酸酸化的硝酸银溶液,观察到产生白色沉淀,由此得出结论:氯水转化为Cl-。该方案是否合理______ (填“合理”或者“不合理”),请说明理由(写出2条)______ 、______ 。

(1)实验I中铁丝表面迅速变黑,反应很快停止,其原因是
(2)实验II中产生大量气体。甲同学猜测该实验实现了
 →
→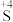 的转化,设计实验证明实现了该转化,实验操作及现象是
的转化,设计实验证明实现了该转化,实验操作及现象是(3)实验III试管A中反应的化学方程式为
①若B中为紫色石蕊溶液,现象为
②若B为Na2S酸性溶液,观察到出现淡黄色的固体,写出反应的离子方程式
③若B为新制氯水,观察到氯水褪色,推测该反应中硫元素的化合价变化为:由
您最近一年使用:0次
8 . 某实验小组对SO2的性质进行探究。用如图所示装置进行实验。
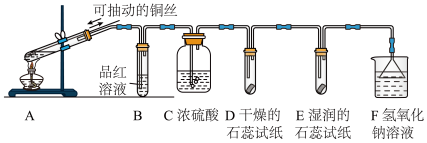
(1)A中采用铜和浓硫酸制取二氧化硫,反应的化学方程式是_______ 。为确认有CuSO4生成,采用的操作是_______ 。
(2)B中品红溶液褪色说明二氧化硫具有的性质是_______ 。
(3)实验过程中,说明SO2与水反应生成了酸的实验现象是_______ 。
(4)F的装置中发生反应的离子方程式为_______ 。

(1)A中采用铜和浓硫酸制取二氧化硫,反应的化学方程式是
(2)B中品红溶液褪色说明二氧化硫具有的性质是
(3)实验过程中,说明SO2与水反应生成了酸的实验现象是
(4)F的装置中发生反应的离子方程式为
您最近一年使用:0次
解题方法
9 . 实验小组制备硫代硫酸钠 (Na2S2O3)并探究其性质。
(1)实验室可利用反应: 制备Na2S2O3,装置如下图。
制备Na2S2O3,装置如下图。
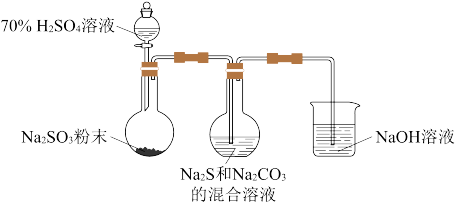
①用化学用语解释Na2S和Na2CO3的混合溶液呈碱性的原因: 、
、_______ 。
②为了保证Na2S2O3的产量,实验中通入的SO2不能过量。要控制SO2的生成速率,可以采取的措施有:_______ (写出一条)。
(2)探究 Na2S2O3的性质:
实验小组研究S产生的原因:
已知:Na2S2O3中S元素的化合价分别为-2和+6
提出假设:假设1:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素
假设2:空气中的O2也可能氧化-2价硫元素
假设3:酸性条件下Na2S2O3分解产生S
设计实验方案:
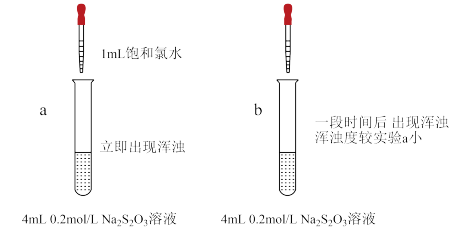
①向试管b中加入_______ 。
②依据现象,S产生的主要原因是_______ ,说明理由_______ 。
③步骤3,继续加入氯水,沉淀消失的原因是_______ (写化学方程式)。
(1)实验室可利用反应:
 制备Na2S2O3,装置如下图。
制备Na2S2O3,装置如下图。
①用化学用语解释Na2S和Na2CO3的混合溶液呈碱性的原因:
 、
、②为了保证Na2S2O3的产量,实验中通入的SO2不能过量。要控制SO2的生成速率,可以采取的措施有:
(2)探究 Na2S2O3的性质:
| 步骤1 | 取Na2S2O3晶体,溶解,配成0.2mol/L溶液。 |
| 步骤2 | 取4mL溶液,向其中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊,经检验浑浊物为S。 |
| 步骤3 | 继续滴加氯水,浑浊度增大,最后消失,溶液变澄清。 |
已知:Na2S2O3中S元素的化合价分别为-2和+6
提出假设:假设1:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素
假设2:空气中的O2也可能氧化-2价硫元素
假设3:酸性条件下Na2S2O3分解产生S
设计实验方案:

①向试管b中加入
②依据现象,S产生的主要原因是
③步骤3,继续加入氯水,沉淀消失的原因是
您最近一年使用:0次
10 . 某化学实验小组探究 与
与 溶液的反应。
溶液的反应。
实验一:用如图所示实验装置制备 ,并将足量
,并将足量 通入
通入 溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
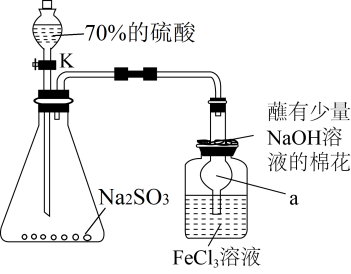
(1)制备 的化学反应方程式为
的化学反应方程式为___________ 。
(2)仪器 的名称为
的名称为___________ 。
(3)某同学取适量酸性 于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有
于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有 ,此结论
,此结论___________ (填“正确”、“不正确”),理由是___________ 。
实验二:探究血红色溶液产生的原因
实验过程如下表:
(4)实验①中, 是
是___________ (填化学式);实验②中现象是___________ 。
(5)为了进一步探究血红色物质产生的主要原因,又进行了以下实验:在
 的
的 溶液中,加入浓度相同的
溶液中,加入浓度相同的 溶液
溶液 ,
, 溶液
溶液 并混合均匀,改变
并混合均匀,改变 、
、 的值并维持
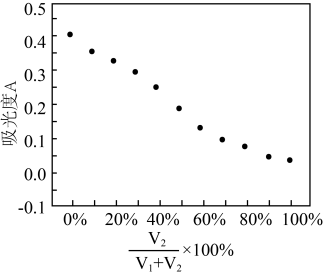
的值并维持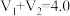 进行多组实验,测得混合溶液的吸光度与
进行多组实验,测得混合溶液的吸光度与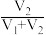 出的关系如图所示。(已知吸光度越大,溶液颜色越深)。
出的关系如图所示。(已知吸光度越大,溶液颜色越深)。
①维持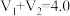 的目的是
的目的是___________ 。
②该实验得出的结论是___________ 。
 与
与 溶液的反应。
溶液的反应。实验一:用如图所示实验装置制备
 ,并将足量
,并将足量 通入
通入 溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
(1)制备
 的化学反应方程式为
的化学反应方程式为(2)仪器
 的名称为
的名称为(3)某同学取适量酸性
 于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有
于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有 ,此结论
,此结论实验二:探究血红色溶液产生的原因
实验过程如下表:
| 实验序号 | 假设 | 实验内容 | 结论 |
| ① |  增大 增大 | 取上述血红色溶液,滴入 溶液,溶液又变为黄色 溶液,溶液又变为黄色 | 假设不成立 |
| ② |  和 和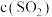 增大 增大 | 在 溶液中,滴入 溶液中,滴入  溶液,溶液呈血红色,再逐渐滴入 溶液,溶液呈血红色,再逐渐滴入 溶液,出现 溶液,出现 | 假设不成立 |
| ③ | 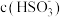 或 或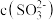 增大 增大 | 在 溶液中加入 溶液中加入 溶液,立即变为血红色 溶液,立即变为血红色 | 假设成立 |
 是
是(5)为了进一步探究血红色物质产生的主要原因,又进行了以下实验:在

 的
的 溶液中,加入浓度相同的
溶液中,加入浓度相同的 溶液
溶液 ,
, 溶液
溶液 并混合均匀,改变
并混合均匀,改变 、
、 的值并维持
的值并维持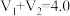 进行多组实验,测得混合溶液的吸光度与
进行多组实验,测得混合溶液的吸光度与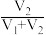 出的关系如图所示。(已知吸光度越大,溶液颜色越深)。
出的关系如图所示。(已知吸光度越大,溶液颜色越深)。
①维持
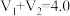 的目的是
的目的是②该实验得出的结论是
您最近一年使用:0次



