解题方法
1 . 定量分析钾铬矾晶体[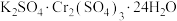 ,相对分子质量为998]的热分解过程。取
,相对分子质量为998]的热分解过程。取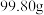 钾铬矾样品不断加热,样品受热分解过程的热重曲线(固体质量随温度变化的曲线)如图所示。已知:
钾铬矾样品不断加热,样品受热分解过程的热重曲线(固体质量随温度变化的曲线)如图所示。已知: 为两性氧化物。
为两性氧化物。
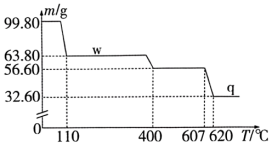
(1) 时固体w的化学式为
时固体w的化学式为______________________ 。
(2)在 时得到固体产物q及气体R,气体R能全部被盐酸酸化的
时得到固体产物q及气体R,气体R能全部被盐酸酸化的 溶液吸收并得到白色沉淀。固体q可部分溶于水,过滤后得到固体e和滤液f,向滤液f中加入盐酸酸化的
溶液吸收并得到白色沉淀。固体q可部分溶于水,过滤后得到固体e和滤液f,向滤液f中加入盐酸酸化的 溶液也得到白色沉淀;将固体e置于适量的
溶液也得到白色沉淀;将固体e置于适量的 溶液中恰好反应得到澄清溶液,则固体q的成分是
溶液中恰好反应得到澄清溶液,则固体q的成分是______________________ (填化学式),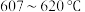 时发生反应的化学方程式为
时发生反应的化学方程式为______________________ 。
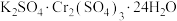 ,相对分子质量为998]的热分解过程。取
,相对分子质量为998]的热分解过程。取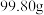 钾铬矾样品不断加热,样品受热分解过程的热重曲线(固体质量随温度变化的曲线)如图所示。已知:
钾铬矾样品不断加热,样品受热分解过程的热重曲线(固体质量随温度变化的曲线)如图所示。已知: 为两性氧化物。
为两性氧化物。
(1)
 时固体w的化学式为
时固体w的化学式为(2)在
 时得到固体产物q及气体R,气体R能全部被盐酸酸化的
时得到固体产物q及气体R,气体R能全部被盐酸酸化的 溶液吸收并得到白色沉淀。固体q可部分溶于水,过滤后得到固体e和滤液f,向滤液f中加入盐酸酸化的
溶液吸收并得到白色沉淀。固体q可部分溶于水,过滤后得到固体e和滤液f,向滤液f中加入盐酸酸化的 溶液也得到白色沉淀;将固体e置于适量的
溶液也得到白色沉淀;将固体e置于适量的 溶液中恰好反应得到澄清溶液,则固体q的成分是
溶液中恰好反应得到澄清溶液,则固体q的成分是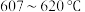 时发生反应的化学方程式为
时发生反应的化学方程式为
您最近半年使用:0次
名校
解题方法
2 . 向 溶液中依次加入甲、乙、丙三种溶液,进行如下实验:
溶液中依次加入甲、乙、丙三种溶液,进行如下实验:
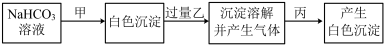
则甲、乙、丙中的溶液可能是
 溶液中依次加入甲、乙、丙三种溶液,进行如下实验:
溶液中依次加入甲、乙、丙三种溶液,进行如下实验:
则甲、乙、丙中的溶液可能是
A. 、 、 、 、 | B. 、 、 、 、 |
C. 、 、 、 、 | D. 、 、 、 、 |
您最近半年使用:0次
2022-12-31更新
|
404次组卷
|
2卷引用:北京市延庆区2022-2023学年高一上学期期末考试化学试题
3 . 硫酸盐(含 、
、 )气溶胶是
)气溶胶是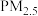 的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
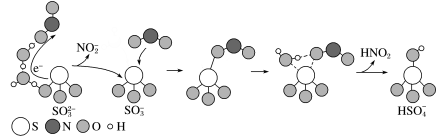
下列说法不正确 的是
 、
、 )气溶胶是
)气溶胶是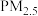 的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
下列说法
| A.硫酸盐气溶胶呈酸性 | B.该过程包含了硫氧键的断裂与形成 |
C. 是生成硫酸盐的氧化剂 是生成硫酸盐的氧化剂 | D.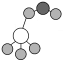 是一种含S、O、N元素的化合物 是一种含S、O、N元素的化合物 |
您最近半年使用:0次
4 . 向2mL0.2mol/LCuSO4溶液中滴加0.2mol/LNa2SO3溶液时溶液变绿,继续滴加产生棕黄色沉淀,经检验棕黄色沉淀中不含 。通过实验探究棕黄色沉淀的成分。
。通过实验探究棕黄色沉淀的成分。
实验1:向棕黄色沉淀中加入稀硫酸,观察到溶液变蓝,产生红色固体
实验2: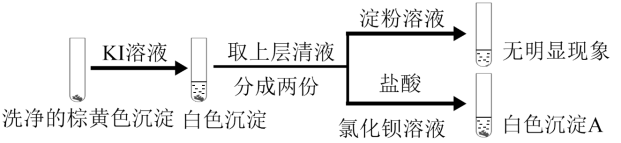
已知: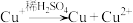 ,
,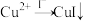 (白色)
(白色)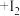 。
。
下列同学对实验现象的分析正确的是
 。通过实验探究棕黄色沉淀的成分。
。通过实验探究棕黄色沉淀的成分。实验1:向棕黄色沉淀中加入稀硫酸,观察到溶液变蓝,产生红色固体
实验2:

已知:
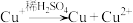 ,
,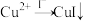 (白色)
(白色)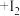 。
。下列同学对实验现象的分析正确的是
A.实验1中加入稀 后溶液变蓝可证实棕黄色沉淀中含有 后溶液变蓝可证实棕黄色沉淀中含有 |
B.实验2中加入KI溶液后产生白色沉淀,可证实棕黄色沉淀中含有 |
C.实验2中加入淀粉溶液后无明显现象,说明不存在 |
D.在 的存在下, 的存在下, 与 与 发生了氧化还原反应,产生CuI沉淀和 发生了氧化还原反应,产生CuI沉淀和 ,说明棕黄色沉淀中含有 ,说明棕黄色沉淀中含有 和 和 |
您最近半年使用:0次
2022-05-28更新
|
1264次组卷
|
11卷引用:北京市中国人民大学附属中学2022届高三下学期第三次适应性练习化学试题
北京市中国人民大学附属中学2022届高三下学期第三次适应性练习化学试题(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第13讲 硫及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题三 金属及其化合物 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)浙江省舟山市舟山中学2021-2022学年高三上学期开学考试化学试题北京首都师范大学附属中学2023届高三3月月考化学试题(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省泸州市合江县马街中学校2022-2023学年高一下学期4月期中考试化学试题辽宁省实验中学2023-2024学年高三上学期阶段测试化学试题
5 . 锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
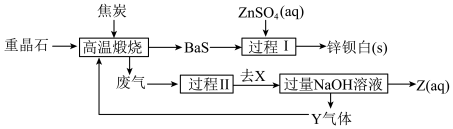
下列叙述错误的是

下列叙述错误的是
| A.重晶石和钡餐的化学成分相同 |
| B.Y气体的循环使用可以防止污染空气并能提高原料利用率 |
| C.Z(aq)中的阴离子是OH-和CO32- |
| D.高温煅烧过程中焦炭的作用是为反应提供热量和作还原剂 |
您最近半年使用:0次
名校
6 . 现有Na2SO3、Na2SO4混合物样品a g,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
| A.将样品配制成V1 L溶液,取其中25.00 mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液的体积是V2 ml |
| B.将样品与足量稀盐酸充分反应,生成的气体通过盛有碱石灰的干燥管,测得干燥管增重cg |
| C.向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为b g |
| D.将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为d g |
您最近半年使用:0次
2018-11-09更新
|
425次组卷
|
3卷引用:山东省济南市第一中学2018届高三上学期期中考试化学试题
7 . 某化学兴趣小组称取纯净的Na2SO3 ·7H20 a克,隔绝空气加强热至恒重,经过分析与计算,得到的固体质量与全部转化为亚硫酸钠固体的计算值一致,但固体在水中溶解后测的pH值比理论计算值(相同浓度Na2SO3溶液的pH)大很多。下列说法不正确的是
| A.连续两次称量强热前后固体的质量,如质量差小于0.1g,即可判断固体已经恒重 |
B.产生上述矛盾的可能解释:4Na2SO3  3Na2SO4 + Na2S 3Na2SO4 + Na2S |
| C.固体产物中加入稀盐酸可能有淡黄色沉淀产生 |
| D.加入BaCl2溶液,出现白色沉淀,则能确定产物中有Na2SO4 |
您最近半年使用:0次
2018-04-27更新
|
540次组卷
|
2卷引用:四川省遂宁市2018届高三三诊考试理科综合化学试题
2017·浙江·一模
8 . 用Zn(主要含有Fe、Al、Pb杂质)和硫酸来制取H2,利用制氢废液制备硫酸锌晶体(ZnSO4·7H2O)、Al2O3和Fe2O3,流程如下:
已知Al3+、Fe3+、Zn2+的氢氧化物完全沉淀的pH分别为5.2、4.1和8.5,ZnSO4·7H2O晶体易溶于水,易风化。回答下列问题:
(1)调节pH=2的目的是______________ ,调节pH=2,可加入_________ (填化学式)。
(2)写出生成沉淀3的化学方程式:______________________ 。
(3)加热浓缩ZnSO4溶液出现极薄品膜时,要停止加热的主要原因是_____________ 。
(4)某同学用如图所示的装置抽滤。
①有关抽滤的说法正确的是__________ 。
A.抽滤的目的主要是得到较干燥的沉淀
B.滤纸的直径应略小于漏斗内径,又能盖住全部小孔
C.图中有一处出错
D.抽滤结束,从吸滤瓶的支管口倒出滤液
②抽滤,洗涤沉淀的具体操作是___________________________ 。
(5)为得到干燥的ZnSO4·7H2O产品,选择干燥方法是________ 。
A.加热烘干 B.用浓H2SO4干燥
C.用酒精洗干 D.在空气中自然干燥
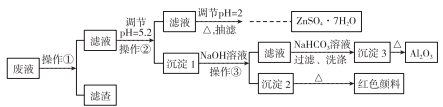
已知Al3+、Fe3+、Zn2+的氢氧化物完全沉淀的pH分别为5.2、4.1和8.5,ZnSO4·7H2O晶体易溶于水,易风化。回答下列问题:
(1)调节pH=2的目的是
(2)写出生成沉淀3的化学方程式:
(3)加热浓缩ZnSO4溶液出现极薄品膜时,要停止加热的主要原因是
(4)某同学用如图所示的装置抽滤。
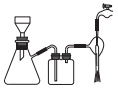
①有关抽滤的说法正确的是
A.抽滤的目的主要是得到较干燥的沉淀
B.滤纸的直径应略小于漏斗内径,又能盖住全部小孔
C.图中有一处出错
D.抽滤结束,从吸滤瓶的支管口倒出滤液
②抽滤,洗涤沉淀的具体操作是
(5)为得到干燥的ZnSO4·7H2O产品,选择干燥方法是
A.加热烘干 B.用浓H2SO4干燥
C.用酒精洗干 D.在空气中自然干燥
您最近半年使用:0次
9 . 下列有关说法不正确的是
| A.隔绝空气高温加热生物质,通过热化学转换可产生可燃性气体 |
| B.开发太阳能、天然气、风能、地热能、潮汐能等新能源可以减少霾的产生 |
| C.Na2SO4·10H2O晶体可作为光与化学能转换的贮热材料 |
| D.在光分解催化剂存在下,利用太阳能分解水制氢气 |
您最近半年使用:0次
10-11高三上·上海·期中
10 . 硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:
① Na2SO4+4C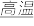 Na2S+4CO
Na2S+4CO
② Na2SO4+4CO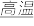 Na2S+4CO2
Na2S+4CO2
(1) 现要制取Na2S 7.80g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4)__________ g;
(2)若在反应中生成的Na2S物质的量为1mol,则消耗的碳单质的物质的量范围n的范围是________ < n <________ ;
(3)若在上述反应中消耗的碳单质为1mol,生成Na2S的物质的量为y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y=_______ ;
(4)Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经被部分氧化的硫化钠39.2g溶于水中,加入足量盐酸,充分反应后,过滤得沉淀9.6g,放出H2S气体1.12L(标准状况),求:39.2g被部分氧化的硫化钠中Na2S的物质的量为______ mol;Na2SO3的物质的量为_______ mol;Na2SO4的物质的量为_________ mol。
① Na2SO4+4C
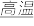 Na2S+4CO
Na2S+4CO② Na2SO4+4CO
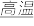 Na2S+4CO2
Na2S+4CO2(1) 现要制取Na2S 7.80g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4)
(2)若在反应中生成的Na2S物质的量为1mol,则消耗的碳单质的物质的量范围n的范围是
(3)若在上述反应中消耗的碳单质为1mol,生成Na2S的物质的量为y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y=
(4)Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经被部分氧化的硫化钠39.2g溶于水中,加入足量盐酸,充分反应后,过滤得沉淀9.6g,放出H2S气体1.12L(标准状况),求:39.2g被部分氧化的硫化钠中Na2S的物质的量为
您最近半年使用:0次



