名校
解题方法
1 . 化学实验是研究物质组成和探究物质性质的重要途径。
Ⅰ.某澄清透明溶液(忽略水的电离),可能含有Fe3+、Mg2+、K+、CO 、SO
、SO 、Ba2+、MnO
、Ba2+、MnO 等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
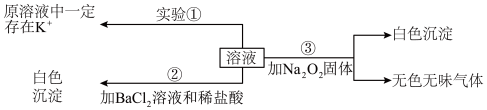
(1)实验①的焰色试验,需要透过_______ ,来观察火焰的颜色。
(2)取100mL溶液进行实验②,经足量盐酸洗涤、干燥后,得沉淀质量为2.33g。该溶液中K+的物质的量浓度为________ 。
(3)实验③产生的无色无味气体为________ ,白色沉淀为_______ (填物质化学式)。原溶液中一定存在的离子有_______ 。
(4)向该溶液中加入硫酸酸化,再通入SO2气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式_______ 。
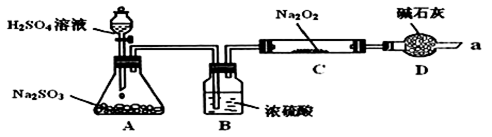
Ⅱ.Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测,Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A用锌和稀盐酸制取氢气。
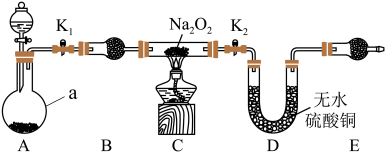
(5)装置B中的试剂是________ 。
(6)下面是实验过程中的重要操作,正确的顺序是_______。
(7)实验过程中观察到淡黄色粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推测出Na2O2与H2反应生成的产物为_______ 。
Ⅰ.某澄清透明溶液(忽略水的电离),可能含有Fe3+、Mg2+、K+、CO
 、SO
、SO 、Ba2+、MnO
、Ba2+、MnO 等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
(1)实验①的焰色试验,需要透过
(2)取100mL溶液进行实验②,经足量盐酸洗涤、干燥后,得沉淀质量为2.33g。该溶液中K+的物质的量浓度为
(3)实验③产生的无色无味气体为
(4)向该溶液中加入硫酸酸化,再通入SO2气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式
Ⅱ.Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测,Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A用锌和稀盐酸制取氢气。

(5)装置B中的试剂是
(6)下面是实验过程中的重要操作,正确的顺序是_______。
| A.加热至Na2O2逐渐熔化,反应一段时间 | B.用小试管收集气体并检验其纯度 |
| C.打开K1、K2,通入氢气 | D.停止加热,充分冷却,关闭K1、K2 |
(7)实验过程中观察到淡黄色粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推测出Na2O2与H2反应生成的产物为
您最近一年使用:0次
2 . 某些资料认为NO、NO2不能与Na2O2反应。南开中学化学学习小组提出质疑,他们分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设I:过氧化钠氧化二氧化氮,生成NaNO3;
假设II:二氧化氮氧化过氧化钠,生成O2。
(1)小组甲同学设计实验如下:
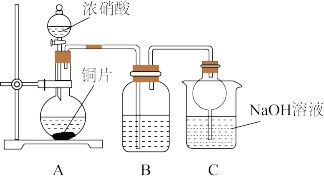
①试管A中反应的化学方程式是__________ 。
②待试管B中收集满气体,向试管B中加入适量Na2O2,塞紧塞子,振荡试管,观察到红棕色气体迅速消失;再将带火星木条迅速伸进试管内,木条复燃。甲同学认为假设II正确;乙同学认为该装置不能达到实验目的,为达到实验目的,应在A、B之间增加一个浓硫酸洗气装置,该装置的作用是_______ 。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星木条未复燃。得出结论:假设I正确。NO2和Na2O2反应的方程式是________ 。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:①2NO+Na2O2=2NaNO2
②亚硝酸盐在酸性条件下不稳定:2H++3 =
= +2NO↑+H2O。
+2NO↑+H2O。
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
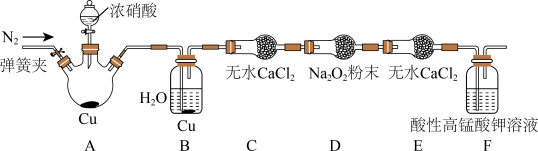
①在反应前,打开弹簧夹,通入一段时间N2,目的是_________ 。
②充分反应后,取D装置中产物少许,加入稀盐酸,若观察到________ 现象,则产物是亚硝酸钠。
③F装置的作用是________ 。该装置中发生反应的离子方程式为_________ 。
假设I:过氧化钠氧化二氧化氮,生成NaNO3;
假设II:二氧化氮氧化过氧化钠,生成O2。
(1)小组甲同学设计实验如下:

①试管A中反应的化学方程式是
②待试管B中收集满气体,向试管B中加入适量Na2O2,塞紧塞子,振荡试管,观察到红棕色气体迅速消失;再将带火星木条迅速伸进试管内,木条复燃。甲同学认为假设II正确;乙同学认为该装置不能达到实验目的,为达到实验目的,应在A、B之间增加一个浓硫酸洗气装置,该装置的作用是
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星木条未复燃。得出结论:假设I正确。NO2和Na2O2反应的方程式是
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:①2NO+Na2O2=2NaNO2
②亚硝酸盐在酸性条件下不稳定:2H++3
 =
= +2NO↑+H2O。
+2NO↑+H2O。丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①在反应前,打开弹簧夹,通入一段时间N2,目的是
②充分反应后,取D装置中产物少许,加入稀盐酸,若观察到
③F装置的作用是
您最近一年使用:0次
解题方法
3 . 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 小苏打可用于治疗胃溃疡 | NaHCO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 向Na2O2的水溶液中滴入酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的黄光 | Ⅰ对,Ⅱ对,有 |
| D | Al(OH)3胶体有吸附性 | 明矾可用作净水剂 | Ⅰ对,Ⅱ对,有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 某课外学习小组在学习了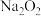 与
与 的反应后,认为
的反应后,认为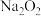 与
与 应该也可以反应。他们设计了如图装置
应该也可以反应。他们设计了如图装置 夹持装置已略去,装置的气密性良好
夹持装置已略去,装置的气密性良好 进行实验,探究
进行实验,探究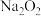 与
与 反应的产物,请按要求回答下列问题。
反应的产物,请按要求回答下列问题。
Ⅰ 写出装置A中发生反应的化学方程式:
写出装置A中发生反应的化学方程式:______ 。
Ⅱ 装置D的作用:除了可以防止空气中的
装置D的作用:除了可以防止空气中的 、水蒸气等进入C中与
、水蒸气等进入C中与 反应,还可以
反应,还可以______________________________________________________ 。
Ⅲ 在通入足量的
在通入足量的 与
与 充分反应后,他们对C中固体产物提出如下假设:
充分反应后,他们对C中固体产物提出如下假设:
假设1:只有 ;
;
假设2:___________ ;
假设3:既有 ,又有
,又有 。
。
(1)若假设2成立,写出 与
与 反应的化学方程式:
反应的化学方程式:_________________ 。
(2)某同学设计了如下实验进一步确认产物的成分。
步骤 中将产生的气体通入少量酸性
中将产生的气体通入少量酸性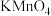 溶液中,发生反应的离子方程式为:
溶液中,发生反应的离子方程式为:______ 。通过上述实验现象确定假设______ 成立。 选填1、2或
选填1、2或
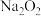 与
与 的反应后,认为
的反应后,认为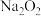 与
与 应该也可以反应。他们设计了如图装置
应该也可以反应。他们设计了如图装置 夹持装置已略去,装置的气密性良好
夹持装置已略去,装置的气密性良好 进行实验,探究
进行实验,探究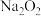 与
与 反应的产物,请按要求回答下列问题。
反应的产物,请按要求回答下列问题。
Ⅰ
 写出装置A中发生反应的化学方程式:
写出装置A中发生反应的化学方程式:Ⅱ
 装置D的作用:除了可以防止空气中的
装置D的作用:除了可以防止空气中的 、水蒸气等进入C中与
、水蒸气等进入C中与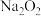 反应,还可以
反应,还可以Ⅲ
 在通入足量的
在通入足量的 与
与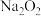 充分反应后,他们对C中固体产物提出如下假设:
充分反应后,他们对C中固体产物提出如下假设:假设1:只有
 ;
;假设2:
假设3:既有
 ,又有
,又有 。
。(1)若假设2成立,写出
 与
与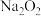 反应的化学方程式:
反应的化学方程式:(2)某同学设计了如下实验进一步确认产物的成分。
实验步骤 | 现象 |
| 固体全部溶解 |
| 酸性 |
| 产生白色沉淀 |
 中将产生的气体通入少量酸性
中将产生的气体通入少量酸性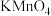 溶液中,发生反应的离子方程式为:
溶液中,发生反应的离子方程式为: 选填1、2或
选填1、2或
您最近一年使用:0次
名校
5 . 设NA为阿伏伽德罗常数的值,下列说法正确的是
| A.硅晶体中,有NA个Si就有2 NA个Si—Si键 |
| B.常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中Na+数目相等 |
| C.惰性电极电解食盐水,若线路中通过2 NA个电子的电量时,则阳极产生气体22.4 L |
| D.标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2 NA |
您最近一年使用:0次
2018-01-25更新
|
2419次组卷
|
5卷引用:【全国百强校】安徽省六安市第一中学2017-2018学年高二下学期期末考试化学试题
名校
6 . Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
I.实验探究
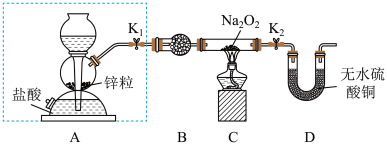
步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)组装好仪器后,要检查装置的气密性。简述检查虚线框内装置气密性的方法:________ 。
(2)B装置中所盛放的试剂是_____ ,其作用是_______ 。
(3)步骤3中的必要操作为打开K1、K2,_______ (请按正确的顺序填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭K1
D.停止加热,充分冷却
(4)由上述实验可推出Na2O2与H2反应的化学方程式为__________ 。
II.数据处理
(5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的Na2O2含量。
其操作流程如下:

①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和____ 。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_____ (填“偏大”“偏小”或“不变”)
I.实验探究

步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)组装好仪器后,要检查装置的气密性。简述检查虚线框内装置气密性的方法:
(2)B装置中所盛放的试剂是
(3)步骤3中的必要操作为打开K1、K2,
A.加热至Na2O2逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭K1
D.停止加热,充分冷却
(4)由上述实验可推出Na2O2与H2反应的化学方程式为
II.数据处理
(5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的Na2O2含量。
其操作流程如下:

①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数
您最近一年使用:0次
2017-10-30更新
|
1131次组卷
|
9卷引用:河北省承德市各县第一中学2018届高三上学期期末考试化学试题
河北省承德市各县第一中学2018届高三上学期期末考试化学试题河北省廊坊市2018-2019学年高二下学期期末考试化学试题江西省百所名校2018届高三第一次联合考试化学试题湖南省衡阳市第八中学2017-2018学年高一(理科实验班)上学期第一次月考理综化学试题山西省大同市2020届高三第一次联合考试(县区)化学试题(已下线)第三章 能力提升检测卷(测)——2021年高考化学一轮复习讲练测甘肃省天水市第一中学2021届高三上学期第一学段考试化学试题(已下线)第06讲 钠及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第1讲 钠及其重要化合物
名校
7 . 下列物质在给定条件下能实现转化的是
A.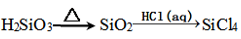 |
B.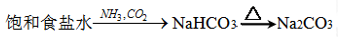 |
C. |
D.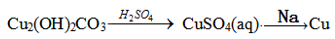 |
您最近一年使用:0次
名校
8 . 烧杯中盛有含Mg2+、Al3+、Fe3+、Na+、Fe2+、Cl-六种离子的溶液,若向其中加入足量的Na2O2搅拌,充分反应后再向该烧杯中滴加足量的稀盐酸,此时上述离子物质的量保持不变的有
| A.1 种 | B.2 种 | C.3 种 | D.4种 |
您最近一年使用:0次
2017-03-07更新
|
528次组卷
|
2卷引用:2016-2017学年辽宁省庄河市高级中学高一上学期期末考试化学试卷
9 . 某溶液含有①NO3-②HCO3-③SO32-④CO32-⑤SO42-等五种阴离子。向其中加入少量的Na2O2固体后,溶液中离子浓度基本保持不变的是(设溶液体积无变化) ( )
| A.① | B.①②④ | C.①③⑤ | D.①③④⑤ |
您最近一年使用:0次
2016-12-09更新
|
2314次组卷
|
5卷引用:2012-2013学年湖北武汉部分重点中学高一上学期期末考试化学试卷
(已下线)2012-2013学年湖北武汉部分重点中学高一上学期期末考试化学试卷(已下线)2010年黑龙江省哈三中高三上学期10月月考化学试题2016-2017学年安徽省淮北市第一中学高一下学期第一次月考化学试卷【全国校级联考】辽宁省沈阳市第五中学、同泽高级中学2017-2018学年高一下学期期中联合考试化学试题辽宁省大连市第八中学2019-2020学年高一上学期12月月考化学试题
名校
10 . 下列实验操作、现象和结论均正确的是
| 选项 | 操 作 | 可能的现象 | 结 论 |
| A | 向某溶液中先滴加少量氯水,再滴加KSCN溶液 | 溶液变为红色 | 溶液中一定含有Fe2+ |
| B | 向酚酞溶液中加入过量的Na2O2 | 溶液先变红后褪色 | Na2O2与水生成的碱有漂白性 |
| C | 将表面氧化的铜丝从酒精灯的外焰慢慢移向内焰 | 黑色的铜丝变红 | CuO被内焰中的乙醇蒸气还原 |
| D | 向饱和Na2CO3溶液中通入CO2 | 有晶体析出 | 溶解度:NaHCO3﹥Na2CO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2015-04-03更新
|
1151次组卷
|
4卷引用:辽宁省鞍山市2020-2021学年高二下学期期末考试化学试题