1 . 实验小组研究SO2与Na2O2的反应。
(1)实验前分析物质的化学性质,提出假设:
假设1:SO2和CO2都是酸性氧化物。类比CO2与Na2O2的反应可知,SO2与Na2O2反应生成Na2SO3和O2;
假设2:SO2具有_______ 性,SO2与Na2O2反应生成Na2SO4。
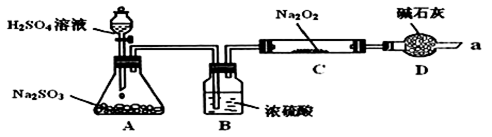
(2)用如图所示装置进行SO2与Na2O2反应的实验。实验过程中,观察到C中淡黄色粉末逐渐变为白色,用带火星的木条靠近D中导气管口,木条复燃。

①A中反应产生SO2的化学方程式是_______ 。
②B中的试剂为_______ ,其主要作用是_______ 。
③实验证明假设_______ 正确。
(3)为检验C中是否有Na2SO4生成,设计如下方案:取少量C中反应后的白色固体溶解于水,加入BaCl2溶液,产生白色沉淀,再加入足量的稀HNO3,仍有白色沉淀不溶解,证明有Na2SO4生成。该方案是否合理?_______ (填“合理”或“不合理”)。请简要说明理由:_______ 。
(4)进一步实验证明C中反应后的固体中既有Na2SO3又有Na2SO4.从氧化还原反应的角度分析,+4价硫元素能被氧化为+6价。在上述实验条件下,+4价硫元素未完全转化为+6价,可见化学反应实际进行的情况与反应的_______ (只写一条)有关。
(1)实验前分析物质的化学性质,提出假设:
假设1:SO2和CO2都是酸性氧化物。类比CO2与Na2O2的反应可知,SO2与Na2O2反应生成Na2SO3和O2;
假设2:SO2具有
(2)用如图所示装置进行SO2与Na2O2反应的实验。实验过程中,观察到C中淡黄色粉末逐渐变为白色,用带火星的木条靠近D中导气管口,木条复燃。

①A中反应产生SO2的化学方程式是
②B中的试剂为
③实验证明假设
(3)为检验C中是否有Na2SO4生成,设计如下方案:取少量C中反应后的白色固体溶解于水,加入BaCl2溶液,产生白色沉淀,再加入足量的稀HNO3,仍有白色沉淀不溶解,证明有Na2SO4生成。该方案是否合理?
(4)进一步实验证明C中反应后的固体中既有Na2SO3又有Na2SO4.从氧化还原反应的角度分析,+4价硫元素能被氧化为+6价。在上述实验条件下,+4价硫元素未完全转化为+6价,可见化学反应实际进行的情况与反应的
您最近一年使用:0次
解题方法
2 . 对下列有关现象或事实解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 乙醇、过氧化钠、次氯酸钠等均可用于消毒 | 都具有氧化性,可将病毒氧化而达到消毒的目的 |
| B | 患者服用“钡餐”做胃部造影 | 钡盐无毒且不溶于水、酸 |
| C | 钢铁在潮湿的空气中放置容易生锈 | 在潮湿的空气中,铁与水、氧气易发生化学腐蚀生成铁锈 |
| D | 在燃煤中添加生石灰用于减少二氧化硫的排放 | 高温下,二氧化硫可与生石灰发生反应,生成亚硫酸钙固体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 高铁酸钠(Na2FeO4)是一种高效的饮用水处理剂,工业上可由下列方法制得:Fe2O3+3Na2O2 2Na2FeO4+Na2O,下列关于该反应的说法中正确的是( )
2Na2FeO4+Na2O,下列关于该反应的说法中正确的是( )
 2Na2FeO4+Na2O,下列关于该反应的说法中正确的是( )
2Na2FeO4+Na2O,下列关于该反应的说法中正确的是( )| A.反应中Na2O2既是氧化剂又是还原剂 |
| B.Fe2O3可以通过铁丝在氧气中燃烧制得 |
| C.生成1molNa2FeO4,有3mol电子转移 |
| D.在Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 |
您最近一年使用:0次
4 . 下列陈述I、Ⅱ均正确且有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Na2O2具有漂白性 | Na2O2可用于潜水呼吸用氧 |
| B | SiO2有导电性 | SiO2可用于制作光导纤维 |
| C | 浓H2SO4有脱水性 | 浓H2SO4可用于干燥Cl2、SO2 |
| D | CO有还原性 | CO可用来冶炼生铁 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 下列物质能使品红溶液褪色且是利用强氧化性来漂白的是
①活性炭 ②过氧化钠 ③氯水 ④漂白粉 ⑤臭氧
①活性炭 ②过氧化钠 ③氯水 ④漂白粉 ⑤臭氧
| A.①③④ | B.②③④⑤ |
| C.①②③④ | D.①②③④⑤ |
您最近一年使用:0次
2020-01-14更新
|
358次组卷
|
5卷引用:湖北省宜昌市部分示范高中教学协作体2019-2020学年高一上学期期末联考化学试题
名校
6 . 外观与NaCl相似的亚硝酸钠(NaNO2)可用作建筑钢材缓蚀剂。某学习小组设计如图装置制备亚硝酸钠(夹持装置已省略)。
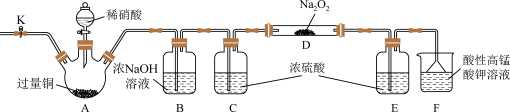
已知:2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3。
回答下列问题:
(1)实验前应检查装置气密性,写出检查装置A气密性的操作步骤和结论:____ 。
(2)装置A中铜与稀硝酸反应的化学方程式为____ 。
(3)反应开始前先打开止水夹K,通入一段时间的氮气的目的是____ 。
(4)若想制备的亚硝酸钠更纯,装置B中浓NaOH溶液的作用是____ 。
(5)若没有装置C,则装置D中剩余固体为____ 。
(6)装置F处理尾气时,酸性高锰酸钾溶液中Mn全部转化为Mn2+,写出该反应的离子方程式:___ 。

已知:2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3。
回答下列问题:
(1)实验前应检查装置气密性,写出检查装置A气密性的操作步骤和结论:
(2)装置A中铜与稀硝酸反应的化学方程式为
(3)反应开始前先打开止水夹K,通入一段时间的氮气的目的是
(4)若想制备的亚硝酸钠更纯,装置B中浓NaOH溶液的作用是
(5)若没有装置C,则装置D中剩余固体为
(6)装置F处理尾气时,酸性高锰酸钾溶液中Mn全部转化为Mn2+,写出该反应的离子方程式:
您最近一年使用:0次
2022-05-01更新
|
176次组卷
|
2卷引用:山西长治上党区第一中学校2021-2022学年高一下学期期末考试化学试题
7 . 下列物质能使品红溶液褪色,其中是利用强氧化性来漂白的是
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧
| A.①③④ | B.②③⑤ | C.①②③④ | D.①③④⑤ |
您最近一年使用:0次
2019-02-03更新
|
381次组卷
|
4卷引用:云南省玉溪一中2018-2019学年高一上学期期末考试化学试题
8 . 亚硝酸钠是重要的防腐剂,某化学兴趣小组以铜和稀硝酸为起始原料,设计如下装置利用NO与Na2O2反应制备NaNO2。(夹持装置已略)
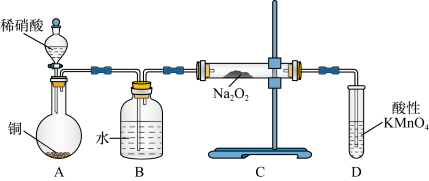
(1)A中反应的化学方程式为_____ 。
(2)B装置的作用是_____ ,装置D的作用是_____ 。
(3)为防止生成其他杂质,B、C装置间还应接入装有_____ (填试剂名称)的_____ (填仪器名称)。
(4)测定C装置中NaNO2的质量分数的过程如下:准确称取装置C中反应后的固体0.600 g于锥形瓶中,先加水溶解,再向其中滴加0.1000 mol·L-1酸性KMnO4溶液,恰好完全反应时,消耗酸性KMnO4溶液24.00 mL。计算装置C中所得固体中NaNO2的质量分数___________ (请写出计算过程)。已知测定过程中发生反应的方程式为MnO4-+NO2-+H+—Mn2++NO3-+H2O(未配平)

(1)A中反应的化学方程式为
(2)B装置的作用是
(3)为防止生成其他杂质,B、C装置间还应接入装有
(4)测定C装置中NaNO2的质量分数的过程如下:准确称取装置C中反应后的固体0.600 g于锥形瓶中,先加水溶解,再向其中滴加0.1000 mol·L-1酸性KMnO4溶液,恰好完全反应时,消耗酸性KMnO4溶液24.00 mL。计算装置C中所得固体中NaNO2的质量分数
您最近一年使用:0次
9 . 下列物质能使品红溶液褪色,其中是利用强氧化性来漂白的是
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧
| A.①③④ | B.②③⑤ | C.①②③④ | D.①②③④⑤ |
您最近一年使用:0次
2016-12-09更新
|
285次组卷
|
8卷引用:2010—20111学年河北省衡水中学高一上学期期末考试化学试卷
(已下线)2010—20111学年河北省衡水中学高一上学期期末考试化学试卷(已下线)2011-2012年湖南衡阳七校高一上学期期末质量检测化学试卷宁夏回族自治区银川市第九中学2019-2020学年高一上学期期末考试化学试题(已下线)2010—2011学年浙江省杭州二中高一下学期期中考试化学试卷(已下线)2013届河北省石家庄市第二实验中学高二上学期期中考试文科化学试卷2014-2015山东省潍坊市一中高一上学期1月月考化学试卷吉林省长春外国语学校2017-2018学年高一下学期第一次月考化学试题云南省梁河县第一中学2020-2021学年高一上学期第二次月考化学试题
名校
10 . 某课外学习小组在学习了 与
与 的反应后,认为
的反应后,认为 与
与 应该也可以反应。他们设计了如图装置
应该也可以反应。他们设计了如图装置 夹持装置已略去,装置的气密性良好
夹持装置已略去,装置的气密性良好 进行实验,探究
进行实验,探究 与
与 反应的产物,请按要求回答下列问题。
反应的产物,请按要求回答下列问题。
Ⅰ 写出装置A中发生反应的化学方程式:
写出装置A中发生反应的化学方程式:______ 。
Ⅱ 装置D的作用:除了可以防止空气中的
装置D的作用:除了可以防止空气中的 、水蒸气等进入C中与
、水蒸气等进入C中与 反应,还可以
反应,还可以______________________________________________________ 。
Ⅲ 在通入足量的
在通入足量的 与
与 充分反应后,他们对C中固体产物提出如下假设:
充分反应后,他们对C中固体产物提出如下假设:
假设1:只有 ;
;
假设2:___________ ;
假设3:既有 ,又有
,又有 。
。
(1)若假设2成立,写出 与
与 反应的化学方程式:
反应的化学方程式:_________________ 。
(2)某同学设计了如下实验进一步确认产物的成分。
步骤 中将产生的气体通入少量酸性
中将产生的气体通入少量酸性 溶液中,发生反应的离子方程式为:
溶液中,发生反应的离子方程式为:______ 。通过上述实验现象确定假设______ 成立。 选填1、2或
选填1、2或
 与
与 的反应后,认为
的反应后,认为 与
与 应该也可以反应。他们设计了如图装置
应该也可以反应。他们设计了如图装置 夹持装置已略去,装置的气密性良好
夹持装置已略去,装置的气密性良好 进行实验,探究
进行实验,探究 与
与 反应的产物,请按要求回答下列问题。
反应的产物,请按要求回答下列问题。
Ⅰ
 写出装置A中发生反应的化学方程式:
写出装置A中发生反应的化学方程式:Ⅱ
 装置D的作用:除了可以防止空气中的
装置D的作用:除了可以防止空气中的 、水蒸气等进入C中与
、水蒸气等进入C中与 反应,还可以
反应,还可以Ⅲ
 在通入足量的
在通入足量的 与
与 充分反应后,他们对C中固体产物提出如下假设:
充分反应后,他们对C中固体产物提出如下假设:假设1:只有
 ;
;假设2:
假设3:既有
 ,又有
,又有 。
。(1)若假设2成立,写出
 与
与 反应的化学方程式:
反应的化学方程式:(2)某同学设计了如下实验进一步确认产物的成分。
实验步骤 | 现象 |
| 固体全部溶解 |
| 酸性 |
| 产生白色沉淀 |
 中将产生的气体通入少量酸性
中将产生的气体通入少量酸性 溶液中,发生反应的离子方程式为:
溶液中,发生反应的离子方程式为: 选填1、2或
选填1、2或
您最近一年使用:0次






