解题方法
1 . 过氧化钠可用于医药、印染、漂白等。某学习兴趣小组探究Na2O2与NO2、NO的反应,设计如图所示实验。

(1)盛放浓硝酸的仪器M名称为_________ ,A中发生反应的离子方程式为________ 。
(2)Na2O2与NO2反应,根据化合价升降原则有下列两种观点。
观点一:Na2O2氧化NO2,生成NaNO3;
观点二:NO2氧化Na2O2,生成O2。
为验证以上观点的正确性进行如下实验:
①关闭K2和弹簧夹,打开K1和A中仪器M的活塞,再将带火星的木条放在a处,观察到_______ 。甲同学认为观点二正确。
②乙同学认为该装置不能确认观点二正确,应在A、G之间增加一个装置,该装置的作用为______ 。改进后重复甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条没有复燃。判断观点一正确。
(3)丙同学根据NO易与O2反应,预测NO也易与Na2O2反应。
①丙同学关闭K1,打开K2,用上图的装置进行实验,为防止NO与空气中氧气反应,反应前的操作是___________ 。
②装置B的作用为___________ 。
③反应一段时间后,取D装置中产物少许,加入稀硫酸,产生无色气体遇到空气变为红棕色。完成反应的化学方程式:___________ 。
6___________ 4___________
4___________
④根据D装置中产物的判断结果,说明Na2O2与NO反应中Na2O2的作用是___________ 。(填标号)
A.氧化剂 B.还原剂 C.即是氧化剂也是还原剂

(1)盛放浓硝酸的仪器M名称为
(2)Na2O2与NO2反应,根据化合价升降原则有下列两种观点。
观点一:Na2O2氧化NO2,生成NaNO3;
观点二:NO2氧化Na2O2,生成O2。
为验证以上观点的正确性进行如下实验:
①关闭K2和弹簧夹,打开K1和A中仪器M的活塞,再将带火星的木条放在a处,观察到
②乙同学认为该装置不能确认观点二正确,应在A、G之间增加一个装置,该装置的作用为
(3)丙同学根据NO易与O2反应,预测NO也易与Na2O2反应。
①丙同学关闭K1,打开K2,用上图的装置进行实验,为防止NO与空气中氧气反应,反应前的操作是
②装置B的作用为
③反应一段时间后,取D装置中产物少许,加入稀硫酸,产生无色气体遇到空气变为红棕色。完成反应的化学方程式:
6___________
 4___________
4___________
④根据D装置中产物的判断结果,说明Na2O2与NO反应中Na2O2的作用是
A.氧化剂 B.还原剂 C.即是氧化剂也是还原剂
您最近一年使用:0次
2 . 下列有关实验安全操作和常见废弃物处理办法正确的是
| A.酸沾到皮肤上立即用大量水冲洗,再用3%-5%NaOH溶液冲洗 |
| B.可以将未用完的钠、钾、白磷放回原试剂瓶 |
C.可以将未用完的 、 、 作为有害垃圾集中丢弃 作为有害垃圾集中丢弃 |
| D.用坩埚做钠在空气中燃烧的实验无需打开排风扇 |
您最近一年使用:0次
名校
3 . 下列实验事实可以说明久置的 固体变质的是
固体变质的是
 固体变质的是
固体变质的是| A.将该固体溶于水后滴加酚酞试剂,溶液变为红色,振荡后颜色褪去 |
B.将该固体加入饱和 溶液,产生白色沉淀;再加入稀盐酸后沉淀溶解 溶液,产生白色沉淀;再加入稀盐酸后沉淀溶解 |
| C.将该固体加入稀盐酸,产生大量无色无味气体 |
D.将该固体溶于水后加热煮沸,然后加入少量 溶液,产生白色沉淀 溶液,产生白色沉淀 |
您最近一年使用:0次
4 . 下列关于Na2O2的说法不正确的是
| A.将一定量的Na2O2粉末加入滴有紫色石蕊溶液的水中并振荡,有气泡产生,最终溶液褪色 |
| B.向饱和NaOH溶液中放入一定量的Na2O2粉末,充分反应后恢复到原来温度,溶液pH不变,溶液中Na+数目不变 |
| C.将足量的Na2O2投入到盛有FeCl22溶液的试管中,有气泡产生,试管壁发烫,最终沉淀呈红褐色 |
| D.Na2O2的漂白原理与次氯酸、臭氧的相同,但与SO2、活性炭的漂白原理不同 |
您最近一年使用:0次
2023-12-04更新
|
98次组卷
|
2卷引用:上海市南洋中学2023-2024学年高二上学期期中考试(等级)化学试题
名校
5 . 过氧化钠是重要的化工原料,具有杀菌、消毒等多种用途,请回答下列问题:
(1) 在空气中易变质,写出
在空气中易变质,写出 与
与 反应的化学方程式:
反应的化学方程式:______
(2)若将 投入到含有下列离子的溶液中:
投入到含有下列离子的溶液中: 、
、 、
、 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有______ (填离子符号)。
(3) 因保存不当易吸收空气中的
因保存不当易吸收空气中的 ,实验小组取样品m g,设计如图实验装置测定样品中
,实验小组取样品m g,设计如图实验装置测定样品中 的质量分数;
的质量分数;
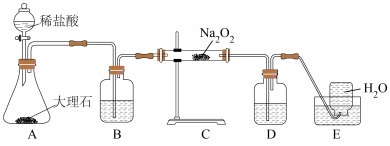
①将实验装置组装好后,必须进行的第一步操作是______ ;装置D中的试剂:______ ;
②反应结束后,测得生成气体的体积为V L(已折算为标准状况下的体积),则样品中 的质量分数为
的质量分数为______ 。
(1)
 在空气中易变质,写出
在空气中易变质,写出 与
与 反应的化学方程式:
反应的化学方程式:(2)若将
 投入到含有下列离子的溶液中:
投入到含有下列离子的溶液中: 、
、 、
、 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有(3)
 因保存不当易吸收空气中的
因保存不当易吸收空气中的 ,实验小组取样品m g,设计如图实验装置测定样品中
,实验小组取样品m g,设计如图实验装置测定样品中 的质量分数;
的质量分数;
①将实验装置组装好后,必须进行的第一步操作是
②反应结束后,测得生成气体的体积为V L(已折算为标准状况下的体积),则样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-12-01更新
|
80次组卷
|
2卷引用:山东省聊城市2023-2024学年高一上学期11月期中化学试题
名校
6 . 下列叙述正确的是
A. 可用排水法收集 可用排水法收集 | B. 可作自来水消毒剂 可作自来水消毒剂 |
C. 能通过化合反应制得 能通过化合反应制得 | D. 与 与 反应能生成 反应能生成 |
您最近一年使用:0次
2023-10-13更新
|
128次组卷
|
2卷引用:重庆市2024届高三上学期第二次质量检测化学试题
名校
解题方法
7 . 下列操作过程中实验现象的变化只有一次的是
| A.石蕊试液中逐滴滴加氯水 | B.酚酞试液中加入过氧化钠固体 |
| C.氢氧化铁胶体中逐滴滴加硫酸 | D.碳酸钠溶液中逐滴滴加盐酸 |
您最近一年使用:0次
2023-09-16更新
|
208次组卷
|
4卷引用:宁夏回族自治区石嘴山市第三中学2022-2023学年高一上学期11月期中化学试题
名校
8 . SO2虽是大气污染物之一,但也是重要的工业原料。某同学在实验室设计了如下实验,对SO2的部分性质进行了探究。
I.二氧化硫的水溶性
(1) SO2易溶于水,溶于水有H2SO3生成。向SO2饱和溶液中加入NaHSO3固体,有气体冒出,原因是_______ (结合有关平衡方程式简要说明)。
II.验证SO2能否与BaCl2溶液反应
某同学设计了如图装置,且所配制的溶液均使用了无氧蒸馏水,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。
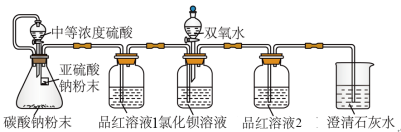
(2)加入碳酸钠粉末的目的是_______ 。
(3)当_______ 时,氯化钡溶液中没有沉淀出现,说明二氧化硫不与氯化钡溶液反应,此时滴加双氧水,出现了白色沉淀。
(4)装置中选用澄清石灰水而不用氢氧化钠溶液的目的是_______ 。
III.二氧化硫的还原性
已知SO2具有还原性,可以还原I2,也可以与Na2O2发生反应。
(5)将SO2通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。
①若木条不复燃,则说明SO2与Na2O2反应无O2生成,可能发生反应的化学方程式为_______ 。
②若木条复燃,则说明SO2与Na2O2反应有O2生成,发生反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2。
(6)将SO2通入装有碘水(含淀粉)的洗气瓶中,若_______ ,说明还原性:SO2>I-,写出该反应的离子方程式:_______ 。
I.二氧化硫的水溶性
(1) SO2易溶于水,溶于水有H2SO3生成。向SO2饱和溶液中加入NaHSO3固体,有气体冒出,原因是
II.验证SO2能否与BaCl2溶液反应
某同学设计了如图装置,且所配制的溶液均使用了无氧蒸馏水,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。

(2)加入碳酸钠粉末的目的是
(3)当
(4)装置中选用澄清石灰水而不用氢氧化钠溶液的目的是
III.二氧化硫的还原性
已知SO2具有还原性,可以还原I2,也可以与Na2O2发生反应。
(5)将SO2通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。
①若木条不复燃,则说明SO2与Na2O2反应无O2生成,可能发生反应的化学方程式为
②若木条复燃,则说明SO2与Na2O2反应有O2生成,发生反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2。
(6)将SO2通入装有碘水(含淀粉)的洗气瓶中,若
您最近一年使用:0次
2022-12-31更新
|
305次组卷
|
2卷引用:广东省梅州市名校2022-2023学年高三上学期期末考试化学试题
名校
9 . 利用以下装置制备、纯化CO,并探究CO和Na2O2的反应(CO+Na2O2=Na2CO3)。下列说法正确的是
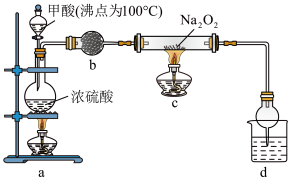

| A.装置b中的试剂可选用无水CaCl2 |
| B.装置d中的试剂可选用NaOH溶液 |
| C.实验开始时,依次点燃a、c处酒精灯 |
| D.加热一段时间后,硬质玻璃管中粉末由白色变为淡黄色 |
您最近一年使用:0次
2022-11-26更新
|
347次组卷
|
4卷引用:广东省广州市2022-2023学年高三上学期11月调研测试化学试题
名校
解题方法
10 . 下列说法正确的是
| A.钠、氧化钠、过氧化钠、氢氧化钠露置在空气中,最终都会生成碳酸钠 |
| B.将过氧化钠投入到氯化铁溶液中,生成白色沉淀 |
| C.氧化钠、过氧化钠、氢氧化钠、碳酸钠等都是白色固体 |
| D.氧化钠、过氧化钠都具有强氧化性,都能与盐酸反应 |
您最近一年使用:0次
2022-11-23更新
|
133次组卷
|
2卷引用:甘肃省天水市第一中学2022-2023学年高一上学期期中考试化学试题



