名校
解题方法
1 . 某NaOH样品中含有少量 、
、 和
和 ,经分析测定,其中含NaOH85.6%(质量分数,下同),
,经分析测定,其中含NaOH85.6%(质量分数,下同), 6.2%,
6.2%, 5.8%,
5.8%, 2.4%。将此样品若干克投入60g23%的稀硫酸中,待反应完全后,需加入18g10.0%的NaOH溶液方能恰好中和。则将反应后的溶液全部蒸干,可得固体的质量最接近于
2.4%。将此样品若干克投入60g23%的稀硫酸中,待反应完全后,需加入18g10.0%的NaOH溶液方能恰好中和。则将反应后的溶液全部蒸干,可得固体的质量最接近于
 、
、 和
和 ,经分析测定,其中含NaOH85.6%(质量分数,下同),
,经分析测定,其中含NaOH85.6%(质量分数,下同), 6.2%,
6.2%, 5.8%,
5.8%, 2.4%。将此样品若干克投入60g23%的稀硫酸中,待反应完全后,需加入18g10.0%的NaOH溶液方能恰好中和。则将反应后的溶液全部蒸干,可得固体的质量最接近于
2.4%。将此样品若干克投入60g23%的稀硫酸中,待反应完全后,需加入18g10.0%的NaOH溶液方能恰好中和。则将反应后的溶液全部蒸干,可得固体的质量最接近于| A.25g | B.10g | C.15g | D.20g |
您最近一年使用:0次
2022-11-05更新
|
66次组卷
|
2卷引用:甘肃省武威市天祝一中、民勤一中、古浪一中等四校联考2023-2024学年高一上学期11月期中考试化学试题
名校
2 . 某兴趣小组课后对 和
和 的性质进行实验探究,回答下列问题:
的性质进行实验探究,回答下列问题:
(1)实验室两瓶固体试剂标签已经模糊,无法区分 和
和 两种白色固体,该小组设计了四种实验方案,方案或结论错误的是_______(填字母)。
两种白色固体,该小组设计了四种实验方案,方案或结论错误的是_______(填字母)。
(2)为测定碳酸钠与碳酸氢钠混合物样品中碳酸氢钠的质量分数,按下列装置进行实验:

实验步骤:
①按图组装好实验装置后,首先进行的操作是_______ 。
②加药品,A中应加入试剂的名称为_______ ,C装置的作用为_______ ,D和E中加入碱石灰,向B装置的硬质玻璃管中加入 药品,实验前称量D装置的质量为
药品,实验前称量D装置的质量为 。
。
③连接好装置后,打开铁夹 、
、 ,关闭
,关闭 缓缓鼓入空气数分钟,其目的是
缓缓鼓入空气数分钟,其目的是_______ 。
④关闭铁夹 、
、 ,打开
,打开 ,点燃酒精灯加热至不再产生气体。
,点燃酒精灯加热至不再产生气体。
⑤继续关闭铁夹 ,打开
,打开 和
和 ,缓缓鼓入空气数分钟,然后拆下装置,再次称量装置D的质量为
,缓缓鼓入空气数分钟,然后拆下装置,再次称量装置D的质量为 。
。
实验分析:
⑥有关该实验装置及实验过程中,下列因素可能使碳酸氢钠的质量分数偏高的是_______ (填字母)。
a.样品分解不完全 b.加热反应前不鼓入空气
c.产生气流过快,没有被装置D完全吸收 d.缺少装置E
实验结论:
⑦该样品中碳酸氢钠的质量分数为_______ (用含m、a、b的代数式表示)
 和
和 的性质进行实验探究,回答下列问题:
的性质进行实验探究,回答下列问题:(1)实验室两瓶固体试剂标签已经模糊,无法区分
 和
和 两种白色固体,该小组设计了四种实验方案,方案或结论错误的是_______(填字母)。
两种白色固体,该小组设计了四种实验方案,方案或结论错误的是_______(填字母)。A.将两种固体分别配制成溶液,滴入澄清石灰水,观察有无浑浊,出现浑浊现象的为 |
B.称取等质量的固体粉末装入气球中,倒入装有足量盐酸的试管中,最终气球体积大的为 |
C.将两种固体分别加入试管中加热,将产生的气体通入澄清石灰水,出现浑浊的为 |
D.往两种固体中分别滴入适量的水,用温度计测量溶解过程中温度的变化,温度升高的为 |

实验步骤:
①按图组装好实验装置后,首先进行的操作是
②加药品,A中应加入试剂的名称为
 药品,实验前称量D装置的质量为
药品,实验前称量D装置的质量为 。
。③连接好装置后,打开铁夹
 、
、 ,关闭
,关闭 缓缓鼓入空气数分钟,其目的是
缓缓鼓入空气数分钟,其目的是④关闭铁夹
 、
、 ,打开
,打开 ,点燃酒精灯加热至不再产生气体。
,点燃酒精灯加热至不再产生气体。⑤继续关闭铁夹
 ,打开
,打开 和
和 ,缓缓鼓入空气数分钟,然后拆下装置,再次称量装置D的质量为
,缓缓鼓入空气数分钟,然后拆下装置,再次称量装置D的质量为 。
。实验分析:
⑥有关该实验装置及实验过程中,下列因素可能使碳酸氢钠的质量分数偏高的是
a.样品分解不完全 b.加热反应前不鼓入空气
c.产生气流过快,没有被装置D完全吸收 d.缺少装置E
实验结论:
⑦该样品中碳酸氢钠的质量分数为
您最近一年使用:0次
3 . 把13.7gNa2CO3和NaHCO3的混合物加热到质量不再变化时,得到10.6g残留固体。试求:
(1)原混合物中无水碳酸钠的质量是_______ 。
(2)在原混合物中NaHCO3的质量分数是_______ 。
(3)若把10.6g残留固体全部溶于水,配成500mL的溶液,则所得溶液中溶质的物质的量浓度是_______ 。
(1)原混合物中无水碳酸钠的质量是
(2)在原混合物中NaHCO3的质量分数是
(3)若把10.6g残留固体全部溶于水,配成500mL的溶液,则所得溶液中溶质的物质的量浓度是
您最近一年使用:0次
名校
解题方法
4 . 钠和钠的化合物有许多重要的用途,碳酸钠可用于从海水提取溴,涉及的反应如下: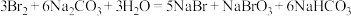
(1)用双线桥法表示电子转移情况_______ 。
(2)该反应的离子方程式为_______ 。
(3)该反应中氧化剂与还原剂的物质的量之比是_______ 。
(4)少量的钠应保存在_______ 中;钠着火时应采取的灭火措施是_______ ,不能用水灭火,原因是_______ (涉及反应的离子方程式)。
(5)用洁净的铂丝蘸取 溶液置于酒精灯火焰上灼烧,火焰呈
溶液置于酒精灯火焰上灼烧,火焰呈_______ 色。
(6)等质量的 和
和 分别与足量的盐酸反应,在相同条件下产生
分别与足量的盐酸反应,在相同条件下产生 的体积
的体积
_______  (填“大于”,“小于”或“等于”)。
(填“大于”,“小于”或“等于”)。
(7)若加热10.0g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为_______ 。
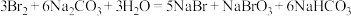
(1)用双线桥法表示电子转移情况
(2)该反应的离子方程式为
(3)该反应中氧化剂与还原剂的物质的量之比是
(4)少量的钠应保存在
(5)用洁净的铂丝蘸取
 溶液置于酒精灯火焰上灼烧,火焰呈
溶液置于酒精灯火焰上灼烧,火焰呈(6)等质量的
 和
和 分别与足量的盐酸反应,在相同条件下产生
分别与足量的盐酸反应,在相同条件下产生 的体积
的体积
 (填“大于”,“小于”或“等于”)。
(填“大于”,“小于”或“等于”)。(7)若加热10.0g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为
您最近一年使用:0次
名校
解题方法
5 . Na2CO3和NaHCO3在日常生产生活中有着广泛应用。
(1)探究两者热稳定性的“套管实验”的实验装置如图所示:
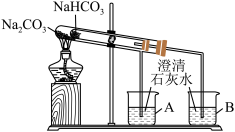
①写出实验过程中试管中发生反应的化学方程式:_______ 。
②证明热稳定性的实验装置中,能否将NaHCO3、Na2CO3的位置互换_______ (填“能”或“不能”)。
(2)能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是_______ 。
A.将Na2CO3和NaHCO3配制成同浓度的溶液,用pH试纸测定pH值并做比较
B.分别在这两种物质的溶液中,滴加同浓度的稀盐酸
C.分别在这两种物质的溶液中,加入少量Ca(OH)2溶液
(3)利用图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如图:

a.按图连接装置,并检查气密性;
b.准确称得盛有碱石灰的干燥管D的质量为83.4g;
c.准确称得10g纯碱样品放入容器II中;
d.打开分液漏斗I的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
e.打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g。
①装置A中试剂X应选用_______ ,通入空气的目的是_______ 。
②E装置的作用是_______ 。
③根据实验中测得的有关数据,计算纯碱样品中Na2CO3的质量分数为_______ 。
(1)探究两者热稳定性的“套管实验”的实验装置如图所示:

①写出实验过程中试管中发生反应的化学方程式:
②证明热稳定性的实验装置中,能否将NaHCO3、Na2CO3的位置互换
(2)能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是
A.将Na2CO3和NaHCO3配制成同浓度的溶液,用pH试纸测定pH值并做比较
B.分别在这两种物质的溶液中,滴加同浓度的稀盐酸
C.分别在这两种物质的溶液中,加入少量Ca(OH)2溶液
(3)利用图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如图:

a.按图连接装置,并检查气密性;
b.准确称得盛有碱石灰的干燥管D的质量为83.4g;
c.准确称得10g纯碱样品放入容器II中;
d.打开分液漏斗I的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
e.打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g。
①装置A中试剂X应选用
②E装置的作用是
③根据实验中测得的有关数据,计算纯碱样品中Na2CO3的质量分数为
您最近一年使用:0次
名校
解题方法
6 . 下列实验方案中,不能测定 和
和 混合物中
混合物中 质量分数的是
质量分数的是
 和
和 混合物中
混合物中 质量分数的是
质量分数的是| A.取ag混合物与足量稀硫酸充分反应,逸出气体干燥后用碱石灰吸收,增重bg |
| B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体 |
| C.取ag混合物充分加热,固体质量减少bg |
D.取ag混合物与足量 溶液充分反应,得bg溶液 溶液充分反应,得bg溶液 |
您最近一年使用:0次
2022-11-05更新
|
393次组卷
|
4卷引用:甘肃省天水市2023-2024学年高一上学期10月份化学竞赛试卷
名校
解题方法
7 . 下列说法正确的是
① 投入到紫色石蕊试液中,溶液先变蓝,后褪色;
投入到紫色石蕊试液中,溶液先变蓝,后褪色;
②质量相等的 与
与 分别与足量相同浓度盐酸完全反应时,产生
分别与足量相同浓度盐酸完全反应时,产生 的物质的量相等;
的物质的量相等;
③取 和
和 混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定
混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定 和
和 混合物中
混合物中 质量分数;
质量分数;
④区别 与
与 溶液,可用
溶液,可用 溶液;
溶液;
⑤ 固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
⑥ 粉末中混有
粉末中混有 ,可配制成溶液通入过量的
,可配制成溶液通入过量的 ,再低温结晶提纯得到。
,再低温结晶提纯得到。
①
 投入到紫色石蕊试液中,溶液先变蓝,后褪色;
投入到紫色石蕊试液中,溶液先变蓝,后褪色;②质量相等的
 与
与 分别与足量相同浓度盐酸完全反应时,产生
分别与足量相同浓度盐酸完全反应时,产生 的物质的量相等;
的物质的量相等;③取
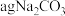 和
和 混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定
混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定 和
和 混合物中
混合物中 质量分数;
质量分数;④区别
 与
与 溶液,可用
溶液,可用 溶液;
溶液;⑤
 固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
固体可以做干粉灭火剂,金属钠起火可以用它来灭火;⑥
 粉末中混有
粉末中混有 ,可配制成溶液通入过量的
,可配制成溶液通入过量的 ,再低温结晶提纯得到。
,再低温结晶提纯得到。| A.②④ | B.②⑤ | C.①⑥ | D.③④ |
您最近一年使用:0次
2022-08-25更新
|
251次组卷
|
15卷引用:甘肃省兰州市西北师范大学附属中学2022-2023学年高三上学期期中考试化学试题
甘肃省兰州市西北师范大学附属中学2022-2023学年高三上学期期中考试化学试题安徽省蚌埠市第二中学2020-2021学年高一上学期期中考试化学(理科)试题河南省镇平县第一高级中学2020-2021学年高一上学期第二次月考化学试题湖北省沙市中学2021-2022学年高一上学期期中考试化学试题天津市耀华中学2021-2022学年高一上学期期中考试化学试题(已下线)必考点07 钠盐及焰色试验-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)(已下线)第08练 钠及其化合物-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)(已下线)衔接点15 钠的化合物-2022年初升高化学无忧衔接?黑龙江省饶河县高级中学2021-2022学年高一上学期期中考试化学试题江西省宜春市万载中学2021-2022学年高一上学期第三次月考化学试题山东省威海乳山市银滩高级中学2022-2023学年高一10月第二次考试化学试题黑龙江省鹤岗市第一中学2022-2023学年高一上学期11月期中化学试题江西省丰城中学2023-2024学年高三上学期开学考试化学试题新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题天津市第二十中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
8 . 大苏打 、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
(1)工业上,将 和
和 以1:2的物质的量之比配成溶液。再通入
以1:2的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ ; 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为_______ 。
(2) 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因_______ 。
(3)下列关于苏打和小苏打的说法正确的是_______(选填字母序号)。
(4)向 的
的 溶液中通入一定量
溶液中通入一定量 ,充分反应后再向溶液中逐滴滴入
,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
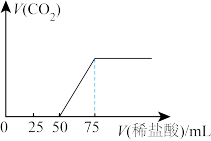
①通入 后形成溶液的溶质成分是
后形成溶液的溶质成分是_______ (填化学式);
②原 溶液的浓度为
溶液的浓度为_______  。
。
 、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打(纯碱)、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。(1)工业上,将
 和
和 以1:2的物质的量之比配成溶液。再通入
以1:2的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程式
,写出该反应的化学方程式 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过䠲化钠相似的结构,该物质的电子式为(2)
 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因(3)下列关于苏打和小苏打的说法正确的是_______(选填字母序号)。
| A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用 |
| B.苏打和小苏打的相互转化属于可逆反应 |
C.采用加热法除去 溶液中混有的 溶液中混有的 |
| D.小苏打和全锌化铝均可治疗胃酸 |
 的
的 溶液中通入一定量
溶液中通入一定量 ,充分反应后再向溶液中逐滴滴入
,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
的稀盐酸,产生气体体积(标况)如下图所示。请回答下列问题:
①通入
 后形成溶液的溶质成分是
后形成溶液的溶质成分是②原
 溶液的浓度为
溶液的浓度为 。
。
您最近一年使用:0次
2023-09-24更新
|
50次组卷
|
2卷引用:甘肃省民乐县第一中学2023-2024学年高三上学期第一次诊断考试化学试题
名校
9 . 下列说法正确的是
①Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色;
②质量相等的NaHCO3与Na2CO3分别与相同浓度盐酸完全反应时,产生CO2的物质的质量相等;
③取agNa2CO3和NaHCO3混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数;
④区别NaHCO3与Na2CO3溶液,可用Ca(OH)2溶液;
⑤NaHCO3固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
⑥NaHCO3粉末中混有Na2CO3,可配制成溶液通入过量的CO2,再低温结晶提纯得到。
①Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色;
②质量相等的NaHCO3与Na2CO3分别与相同浓度盐酸完全反应时,产生CO2的物质的质量相等;
③取agNa2CO3和NaHCO3混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数;
④区别NaHCO3与Na2CO3溶液,可用Ca(OH)2溶液;
⑤NaHCO3固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
⑥NaHCO3粉末中混有Na2CO3,可配制成溶液通入过量的CO2,再低温结晶提纯得到。
| A.①⑥ | B.①②⑤ | C.①③⑥ | D.②③④ |
您最近一年使用:0次
2021-12-18更新
|
125次组卷
|
2卷引用:甘肃省永昌县第一高级中学2021-2022学年高一上学期期中考试化学试题
名校
10 . 某化学兴趣小组为探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,按以下装置图进行实验,按要求填空。

(1) 中反应的化学方程式为
中反应的化学方程式为___________ 。
(2) 中浓硫酸的作用是
中浓硫酸的作用是___________ , 中收集的气体主要是
中收集的气体主要是___________ 。
(3) 中发生反应的化学方程式为
中发生反应的化学方程式为___________ ,反应每生成1个 分子转移
分子转移___________ 个电子。
(4) 中现象是
中现象是___________ ,反应的离子方程式是___________ 。
(5)某次实验结束后, 试管中余下
试管中余下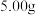 固体,充分加热使其完全分解,固体的质量减少了
固体,充分加热使其完全分解,固体的质量减少了 ,则
,则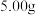 固体中未分解的
固体中未分解的 的质量分数是
的质量分数是___________ 。

(1)
 中反应的化学方程式为
中反应的化学方程式为(2)
 中浓硫酸的作用是
中浓硫酸的作用是 中收集的气体主要是
中收集的气体主要是(3)
 中发生反应的化学方程式为
中发生反应的化学方程式为 分子转移
分子转移(4)
 中现象是
中现象是(5)某次实验结束后,
 试管中余下
试管中余下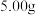 固体,充分加热使其完全分解,固体的质量减少了
固体,充分加热使其完全分解,固体的质量减少了 ,则
,则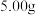 固体中未分解的
固体中未分解的 的质量分数是
的质量分数是
您最近一年使用:0次



