名校
解题方法
1 . Na2CO3和NaHCO3是两种重要的化工原料,二者的性质存在差异,为进一步探究其性质,请根据某实验小组的实验探究回答有关问题。
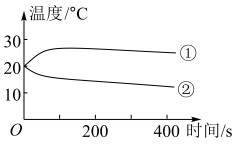
(1)分别将1.0g Na2CO3和NaHCO3的固体加入50mL盛有10mL蒸馏水的烧杯中,测定烧杯中溶液的温度变化如图所示。则曲线②代表的物质是(填化学式)______ 。
(2)如下图所示,分别向盛有10mL澄清石灰水的烧杯中加入蒸馏水和等浓度的Na2CO3、NaHCO3溶液,利用传感器测得溶液pH与加入试剂体积的变化曲线如下图所示。滴加Na2CO3溶液的烧杯中OH-未参与该反应的实验证据是___________ ;滴加NaHCO3溶液的烧杯中开始时发生反应的离子方程式为:___________ 。(提示:溶液pH越小,OH-的浓度越小,溶液碱性越弱。)

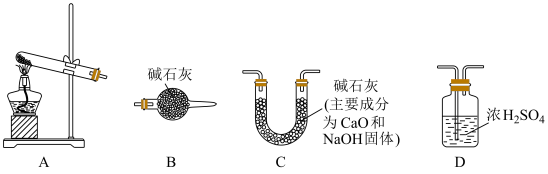
(3)某NaHCO3固体样品中含有Na2CO3杂质,某小组拟通过下列装置(气密性良好)测定CO2的质量来计算样品中NaHCO3的含量,装置的连接顺序为___→___→___→ B (每个装置仅使用一次),_____ 。经分析,上述方案存在缺陷(假定固体充分反应),会导致测定结果偏小,原因可能为:________ 。利用改进装置进行实验,ag样品加热至恒重后,称量所得固体质量为bg,则样品中NaHCO3质量分数为____ %(用含a、b的代数式表示)。
(1)分别将1.0g Na2CO3和NaHCO3的固体加入50mL盛有10mL蒸馏水的烧杯中,测定烧杯中溶液的温度变化如图所示。则曲线②代表的物质是(填化学式)

(2)如下图所示,分别向盛有10mL澄清石灰水的烧杯中加入蒸馏水和等浓度的Na2CO3、NaHCO3溶液,利用传感器测得溶液pH与加入试剂体积的变化曲线如下图所示。滴加Na2CO3溶液的烧杯中OH-未参与该反应的实验证据是

(3)某NaHCO3固体样品中含有Na2CO3杂质,某小组拟通过下列装置(气密性良好)测定CO2的质量来计算样品中NaHCO3的含量,装置的连接顺序为___→___→___→ B (每个装置仅使用一次),

您最近半年使用:0次
名校
2 . 碳酸氢钠俗称小苏打,在医疗、食品、橡胶工业中有广泛应用。
(1)甲同学向饱和 溶液中先通
溶液中先通 再通入
再通入 ,充分反应后得到
,充分反应后得到 晶体和另一种不含金属元素的盐,请补充完整该反应方程式。
晶体和另一种不含金属元素的盐,请补充完整该反应方程式。
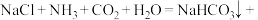
_____ ;
乙同学认为甲同学获得的 晶体中含有
晶体中含有 等与酸不反应的杂质。为测定
等与酸不反应的杂质。为测定 的质量分数,他设计了以下两种方案:
的质量分数,他设计了以下两种方案:
方案一:滴定法
称取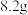 样品溶于水,逐滴加入
样品溶于水,逐滴加入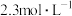 稀硫酸,待完全反应时,测定所消耗稀硫酸的体积。
稀硫酸,待完全反应时,测定所消耗稀硫酸的体积。
(2)配制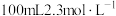 的稀硫酸
的稀硫酸
①若用 浓硫酸配制,需量取浓硫酸
浓硫酸配制,需量取浓硫酸_____  。
。
②配制过程中不需要用到的仪器是_____ (填字母)。
A. B.
B. C.
C. D.
D.
③下列情况会导致所配制溶液浓度偏低的是_____ 。
A.没有洗涤烧杯和玻璃棒
B.定容时俯视刻度线
C.容量瓶清洗后残留有少量蒸馏水
D.如果加水超过了刻度线,吸出液体使液面恰好到刻度线
(3)乙同学在用硫酸滴定样品测定含量时,在保证测定结果数值变化不大的情况下,一共进行3次测定,这样做的目的是_____ 。
方案二:称量法
乙同学按如图操作流程进行测定。
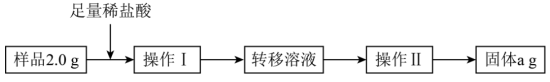
(4)操作Ⅰ后所得溶液的主要溶质的化学式是_____ 。
(5)操作Ⅱ的名称是_____ 。
(6)样品中 的质量分数为
的质量分数为_____ (用含a的代数式表示)。
(1)甲同学向饱和
 溶液中先通
溶液中先通 再通入
再通入 ,充分反应后得到
,充分反应后得到 晶体和另一种不含金属元素的盐,请补充完整该反应方程式。
晶体和另一种不含金属元素的盐,请补充完整该反应方程式。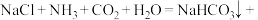
乙同学认为甲同学获得的
 晶体中含有
晶体中含有 等与酸不反应的杂质。为测定
等与酸不反应的杂质。为测定 的质量分数,他设计了以下两种方案:
的质量分数,他设计了以下两种方案:方案一:滴定法
称取
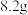 样品溶于水,逐滴加入
样品溶于水,逐滴加入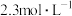 稀硫酸,待完全反应时,测定所消耗稀硫酸的体积。
稀硫酸,待完全反应时,测定所消耗稀硫酸的体积。(2)配制
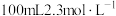 的稀硫酸
的稀硫酸①若用
 浓硫酸配制,需量取浓硫酸
浓硫酸配制,需量取浓硫酸 。
。②配制过程中不需要用到的仪器是
A.
 B.
B. C.
C. D.
D.
③下列情况会导致所配制溶液浓度偏低的是
A.没有洗涤烧杯和玻璃棒
B.定容时俯视刻度线
C.容量瓶清洗后残留有少量蒸馏水
D.如果加水超过了刻度线,吸出液体使液面恰好到刻度线
(3)乙同学在用硫酸滴定样品测定含量时,在保证测定结果数值变化不大的情况下,一共进行3次测定,这样做的目的是
方案二:称量法
乙同学按如图操作流程进行测定。

(4)操作Ⅰ后所得溶液的主要溶质的化学式是
(5)操作Ⅱ的名称是
(6)样品中
 的质量分数为
的质量分数为
您最近半年使用:0次
名校
解题方法
3 . 某膨松剂由碳酸氢钠与碳酸钠组成。某学校兴趣小组为研究该膨松剂中碳酸氢钠的含量,利用下图所示装置进行相关实验。已知各装置中的试剂皆为足量。

(1)装置A中NaOH溶液的作用是_________ ;
(2)装置C的作用是_________ ;
(3)装置E中所用仪器的名称是_________ ;
(4)已知碱石灰是固体氢氧化钠和氧化钙的混合物,则装置D中NaOH发生化学方程式为_________ ;
(5)将一定质量的该膨松剂样品装入装置B中,测定实验前后装置_________ (填装置对应的字母符号)的质量,其质量差即为样品产生的CO2的质量。
(6)上述实验中,若没有装置E,可能会造成测定结果_________ (填“偏大”、“偏小”或“不变”);
(7)若上述实验中加入的样品质量为30g,测得生成的CO2的质量为6.6g。则样品中NaHCO3的质量分数为_________ 。

(1)装置A中NaOH溶液的作用是
(2)装置C的作用是
(3)装置E中所用仪器的名称是
(4)已知碱石灰是固体氢氧化钠和氧化钙的混合物,则装置D中NaOH发生化学方程式为
(5)将一定质量的该膨松剂样品装入装置B中,测定实验前后装置
(6)上述实验中,若没有装置E,可能会造成测定结果
(7)若上述实验中加入的样品质量为30g,测得生成的CO2的质量为6.6g。则样品中NaHCO3的质量分数为
您最近半年使用:0次
2023-12-11更新
|
66次组卷
|
2卷引用:湖北省宜昌市远安县第一高级中学2023-2024学年高一上学期期中考试化学试题
4 . 膨松剂是一种食品添加剂。膨松剂反应产生气体的量作为检验膨松剂品质的一项重要指标。已知某膨松剂含碳酸氢钠、碳酸氢铵中的一种或两种,化学兴趣小组对该膨松剂进行如下探究:
查阅资料:碱石灰是固体氢氧化钠与氧化钙的混合
实验一:检验膨松剂成分

在玻璃管中加入该膨松剂,按右图连接好装置(铁架台略去,下同)。点燃酒精灯:
(1)关闭铁夹1,打开铁夹2,观察到___________ ,说明膨松剂中没有碳酸氢铵;
(2)打开铁夹1,关闭铁夹2,观察到___________ ,说明膨松剂中有碳酸氢钠;
结论:膨松剂含碳酸氢钠
实验二:测定膨松剂受热产生气体的量,测定膨松剂中碳酸氢钠的含量。
将质量为 的膨松剂样品装入装置B中,用下图装置测定该膨松剂样品产生的二氧化碳气体的质量(整套装置气密性良好,各装置中气体吸收剂足量)。
的膨松剂样品装入装置B中,用下图装置测定该膨松剂样品产生的二氧化碳气体的质量(整套装置气密性良好,各装置中气体吸收剂足量)。
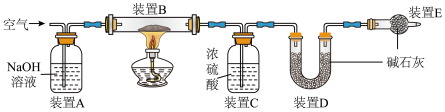
(3)在加热前,先对装置A、B和C(已连接)通一段时间的空气,再连接上装置D、E.装置A的作用是___________ ;装置C的作用___________ 。
(4)测定实验前后装置___________ (填装置名称)的质量,其质量差即为产CO2的质量;若没有装置E,造成测定二氧化碳气体的质量结果___________ (填“偏大”、“不变”或“偏小”)。
(5)充分反应后,停止加热,测得装置B中固体的质量为 。停止加热后,仍继续通入空气一段时间,目的是
。停止加热后,仍继续通入空气一段时间,目的是___________ 。
(6)若上述实验测得CO2的质量为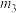 ,则该膨松剂中碳酸氢钠的质量分数为
,则该膨松剂中碳酸氢钠的质量分数为___________ 。
查阅资料:碱石灰是固体氢氧化钠与氧化钙的混合
实验一:检验膨松剂成分

在玻璃管中加入该膨松剂,按右图连接好装置(铁架台略去,下同)。点燃酒精灯:
(1)关闭铁夹1,打开铁夹2,观察到
(2)打开铁夹1,关闭铁夹2,观察到
结论:膨松剂含碳酸氢钠
实验二:测定膨松剂受热产生气体的量,测定膨松剂中碳酸氢钠的含量。
将质量为
 的膨松剂样品装入装置B中,用下图装置测定该膨松剂样品产生的二氧化碳气体的质量(整套装置气密性良好,各装置中气体吸收剂足量)。
的膨松剂样品装入装置B中,用下图装置测定该膨松剂样品产生的二氧化碳气体的质量(整套装置气密性良好,各装置中气体吸收剂足量)。
(3)在加热前,先对装置A、B和C(已连接)通一段时间的空气,再连接上装置D、E.装置A的作用是
(4)测定实验前后装置
(5)充分反应后,停止加热,测得装置B中固体的质量为
 。停止加热后,仍继续通入空气一段时间,目的是
。停止加热后,仍继续通入空气一段时间,目的是(6)若上述实验测得CO2的质量为
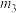 ,则该膨松剂中碳酸氢钠的质量分数为
,则该膨松剂中碳酸氢钠的质量分数为
您最近半年使用:0次
名校
解题方法
5 . Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:已知 在低温下溶解度较小。
在低温下溶解度较小。
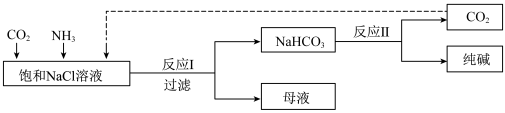
(1)一定温度下,往一定量饱和NaCl溶液中先通入___________ 达到饱和后,再不断通入另一种气体,一段时间后,出现沉淀,过滤得到 晶体。
晶体。
(2)得到的 晶体中可能含有少量NaCl、
晶体中可能含有少量NaCl、 等杂质,检验该晶体中是否含有氯离子杂质的操作方法是
等杂质,检验该晶体中是否含有氯离子杂质的操作方法是___________ 。
(3) 和
和 是两种常见的钠盐,
是两种常见的钠盐, 和
和 溶于水溶液均显
溶于水溶液均显___________ (填“酸性”、“中性”或“碱性”)。写出向饱和碳酸钠溶液中通入 的离子方程式
的离子方程式___________ 。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 的含量。
的含量。
(4)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若___________ ,说明装置不漏气。
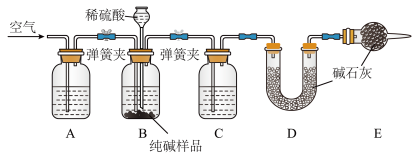
(5)装置A中的试剂为___________ ,装置C中的试剂为___________ 。
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中 的质量分数为
的质量分数为___________ (保留小数点后一位):若缺少E装置,会使测定结果___________ (填“偏高”或“偏低”)。
 在低温下溶解度较小。
在低温下溶解度较小。
(1)一定温度下,往一定量饱和NaCl溶液中先通入
 晶体。
晶体。(2)得到的
 晶体中可能含有少量NaCl、
晶体中可能含有少量NaCl、 等杂质,检验该晶体中是否含有氯离子杂质的操作方法是
等杂质,检验该晶体中是否含有氯离子杂质的操作方法是(3)
 和
和 是两种常见的钠盐,
是两种常见的钠盐, 和
和 溶于水溶液均显
溶于水溶液均显 的离子方程式
的离子方程式Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中
 的含量。
的含量。(4)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若

(5)装置A中的试剂为
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中
 的质量分数为
的质量分数为
您最近半年使用:0次
2023-12-03更新
|
76次组卷
|
2卷引用:陕西省西安市碑林区教育局2023-2024学年高一上学期期中教育质量监测化学试题
名校
6 . 碳酸钠是一种重要的化工原料。某小组模拟侯氏制碱法,制备碳酸钠并测定粗产品中碳酸氢钠杂质的含量。
Ⅰ. 碳酸钠的制备
①下图装置中,通入足量二氧化碳,有白色晶体析出,经过滤、洗涤、灼烧,得到碳酸钠粗产品。

Ⅱ.测定碳酸钠粗产品中碳酸氢钠的含量
②准确称取碳酸钠粗产品m g,用适量蒸馏水溶解于锥形瓶中,以酚酞作为指示剂,用a mol·L−1的盐酸标准液滴定,当到达滴定终点时,消耗盐酸体积为V1mL。
③继续向锥形瓶中加入2滴甲基橙,用amol·L−1的盐酸标准液滴定,当到达滴定终点时,消耗盐酸体积为V2 mL。
回答下列问题
(1)①中洗涤操作中如何判断已经洗涤干净:___________ 。
(2)①的装置中,稀硫酸的作用是___________ 。
(3)②中滴定终点的现象为___________ 。
(4)②中,若开始时读数准确,终点时俯视读数,会使碳酸氢钠的质量分数___________ (填“偏大”、“偏小”或“无影响”)。
(5)③中反应的离子方程式为___________ 。
(6)粗产品中NaHCO3的质量分数为___________ 。(用含a、m、V1、V2的表达式表示)
Ⅰ. 碳酸钠的制备
①下图装置中,通入足量二氧化碳,有白色晶体析出,经过滤、洗涤、灼烧,得到碳酸钠粗产品。

Ⅱ.测定碳酸钠粗产品中碳酸氢钠的含量
②准确称取碳酸钠粗产品m g,用适量蒸馏水溶解于锥形瓶中,以酚酞作为指示剂,用a mol·L−1的盐酸标准液滴定,当到达滴定终点时,消耗盐酸体积为V1mL。
③继续向锥形瓶中加入2滴甲基橙,用amol·L−1的盐酸标准液滴定,当到达滴定终点时,消耗盐酸体积为V2 mL。
回答下列问题
(1)①中洗涤操作中如何判断已经洗涤干净:
(2)①的装置中,稀硫酸的作用是
(3)②中滴定终点的现象为
(4)②中,若开始时读数准确,终点时俯视读数,会使碳酸氢钠的质量分数
(5)③中反应的离子方程式为
(6)粗产品中NaHCO3的质量分数为
您最近半年使用:0次
名校
7 . 侯氏制碱法为我国纯碱工业做出了重要贡献。
I.某化学兴趣小组模拟侯氏制碱法制备 ,进一步处理得到
,进一步处理得到 和
和 ,实验流程如图:
,实验流程如图:
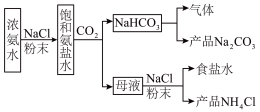
回答下列问题:
(1)生成 的总反应的化学方程式为
的总反应的化学方程式为___________ 。
II.实验中制得的纯碱中含有少量NaCl,该小组设计如图所示装置,测定实验得到的纯碱中 的含量。
的含量。
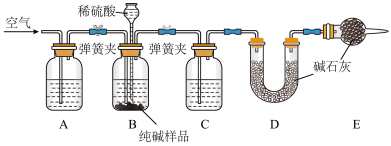
(2)装置A中的试剂为___________ ,装置C中的试剂为___________ 。
(3)实验结束后通入空气的目的:___________ 。
(4)实验前称取26.50g样品,实验后测得D装置增重8.80g,则样品中 的质量分数为
的质量分数为___________ (保留2位小数)。按照以上装置及操作,有同学提出测定结果可能会偏大,他的理由是___________ 。
I.某化学兴趣小组模拟侯氏制碱法制备
 ,进一步处理得到
,进一步处理得到 和
和 ,实验流程如图:
,实验流程如图:
回答下列问题:
(1)生成
 的总反应的化学方程式为
的总反应的化学方程式为II.实验中制得的纯碱中含有少量NaCl,该小组设计如图所示装置,测定实验得到的纯碱中
 的含量。
的含量。
(2)装置A中的试剂为
(3)实验结束后通入空气的目的:
(4)实验前称取26.50g样品,实验后测得D装置增重8.80g,则样品中
 的质量分数为
的质量分数为
您最近半年使用:0次
2023-11-30更新
|
127次组卷
|
2卷引用:陕西省西安铁一中滨河高级中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
8 . Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为_______ 。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 Na2CO3的含量。
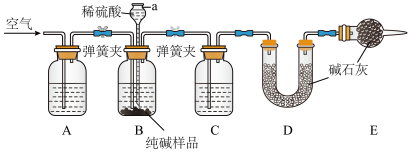
(2)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若_______ ,说明装置不漏气。
(3)装置A中的试剂为_______ ,装置C中的试剂为_______ 。装置E的作用是_______ 。
(4)实验前称取28.80 g样品,实验后测得D装置增重8.80 g,则样品中Na2CO3的质量分数为_______ (保留一位小数);若缺少E装置,会使测定结果_______ (填“偏高”或“偏低”)。

已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 Na2CO3的含量。

(2)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若
(3)装置A中的试剂为
(4)实验前称取28.80 g样品,实验后测得D装置增重8.80 g,则样品中Na2CO3的质量分数为
您最近半年使用:0次
2023-11-26更新
|
218次组卷
|
3卷引用:山西省实验中学2023-2024学年高一上学期期中考试化学试题
解题方法
9 . 课外兴趣小组的同学探究Na2CO3和NaHCO3的性质,并测定混合物中NaHCO3的含量。
实验一:Na2CO3和NaHCO3溶解性与碱性的比较
(1)室温下,Na2CO3的溶解度大于NaHCO3的实验证据是_____________ 。
(2)该实验_____________ (填“能”或“不能”)说明Na2CO3溶液的碱性强于NaHCO3溶液,理由是_____________ 。
实验二:Na2CO3和NaHCO3与澄清石灰水反应的比较
查阅资料:可以用pH表示溶液酸碱性的强弱。常温下,pH<7,溶液为酸性;pH=7,溶液为中性;pH>7,溶液为碱性。pH越小,c(OH-)越小,溶液碱性越弱。
(3)上述实验中,向澄清石灰水中滴加Na2CO3溶液,OH-未参与该反应的实验证据是_____________ 。
(4)滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,结合离子方程式说明原因:_____________ 。
实验三:Na2CO3和NaHCO3混合物(不考虑其他杂质)中NaHCO3质量分数的测定
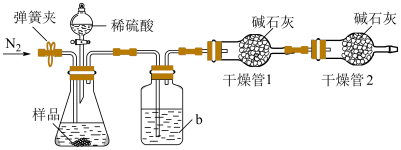
实验装置如图所示。称取19.0g待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的N2,然后关闭弹簧夹,接上总质量为200.0g的干燥管1,再接上干燥管2,打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的N2,最后取下干燥管1,称得其质量为208.8g。
(5)①洗气瓶中盛放的液体是_________________ (填名称)。
②第一次通入N2的目的是_________________ 。第二次通入N2的目的是_________________ 。如果没有进行第一次通N2的操作,测量的结果将会_________________ (填“偏大”“偏小”或“不变”)。
③计算出混合物中NaHCO3的质量分数为_________________ %(保留1位小数)。
实验一:Na2CO3和NaHCO3溶解性与碱性的比较
| 序号 | 实验操作 | 实验现象 | |
| ① | 在两支试管中分别加入1gNa2CO3、NaHCO3,再加入5mL水,充分振荡;用温度计测量两试管中溶液温度的变化 | Na2CO3 | NaHCO3 |
| 温度由17.6℃变为23.2℃;放置到室温时,试管内无固体 | 温度由17.6℃变为17.2℃;放置到室温时,试管内有少量固体残留 | ||
| ② | 室温时,分别向①所得溶液中滴入2滴酚酞溶液 | 溶液变红 | 溶液变微红 |
(1)室温下,Na2CO3的溶解度大于NaHCO3的实验证据是
(2)该实验
实验二:Na2CO3和NaHCO3与澄清石灰水反应的比较
查阅资料:可以用pH表示溶液酸碱性的强弱。常温下,pH<7,溶液为酸性;pH=7,溶液为中性;pH>7,溶液为碱性。pH越小,c(OH-)越小,溶液碱性越弱。
| 实验操作 | 实验数据 |
测量如下实验过程的pH变化 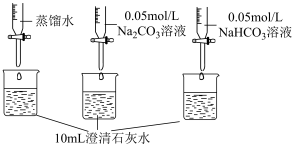 | 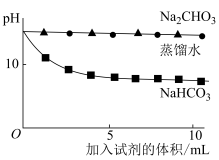 |
(3)上述实验中,向澄清石灰水中滴加Na2CO3溶液,OH-未参与该反应的实验证据是
(4)滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,结合离子方程式说明原因:
实验三:Na2CO3和NaHCO3混合物(不考虑其他杂质)中NaHCO3质量分数的测定

实验装置如图所示。称取19.0g待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的N2,然后关闭弹簧夹,接上总质量为200.0g的干燥管1,再接上干燥管2,打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的N2,最后取下干燥管1,称得其质量为208.8g。
(5)①洗气瓶中盛放的液体是
②第一次通入N2的目的是
③计算出混合物中NaHCO3的质量分数为
您最近半年使用:0次
解题方法
10 . 钠及其化合物在生产、生活中有着重要的用途,根据所学知识,回答下列问题。
Ⅰ.某汽车安全气囊的产气药剂主要含有 、
、 、
、 、
、 等物质。当汽车发生碰撞时,
等物质。当汽车发生碰撞时, 迅速分解产生
迅速分解产生 和Na,同时放出大量的热,
和Na,同时放出大量的热, 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。
(1) 是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为
是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为___________ 。
Ⅱ.某实验小组设计如下实验方案测定 与
与 混合物中各组分的含量。
混合物中各组分的含量。
(2)方案一:称取30g样品,置于坩埚中加热至恒重,冷却、称量,剩余固体质量为31.6g,计算。
①实验中加热至恒重的目的是___________ 。
②样品中 的质量分数为
的质量分数为___________ 。
(3)方案二:用如图所示装置(铁架台、铁夹等仪器未在图中画出)进行实验。
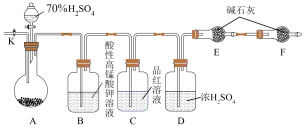
①装置C的作用是___________ ;装置F的作用是___________ 。
②实验过程中,当装置A内的固体反应完全后,需打开活塞K,向A中通入大量的氮气。这样做的目的是___________ 。
(4)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量 溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗涤干净的方法是
溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗涤干净的方法是___________ 。
Ⅰ.某汽车安全气囊的产气药剂主要含有
 、
、 、
、 、
、 等物质。当汽车发生碰撞时,
等物质。当汽车发生碰撞时, 迅速分解产生
迅速分解产生 和Na,同时放出大量的热,
和Na,同时放出大量的热, 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。(1)
 是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为
是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为Ⅱ.某实验小组设计如下实验方案测定
 与
与 混合物中各组分的含量。
混合物中各组分的含量。(2)方案一:称取30g样品,置于坩埚中加热至恒重,冷却、称量,剩余固体质量为31.6g,计算。
①实验中加热至恒重的目的是
②样品中
 的质量分数为
的质量分数为(3)方案二:用如图所示装置(铁架台、铁夹等仪器未在图中画出)进行实验。

①装置C的作用是
②实验过程中,当装置A内的固体反应完全后,需打开活塞K,向A中通入大量的氮气。这样做的目的是
(4)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量
 溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗涤干净的方法是
溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗涤干净的方法是
您最近半年使用:0次



