解题方法
1 . X、Y、Z、M为原子序数依次增大的短周期主族元素,这四种元素原子的最外层电子数之和等于12。A~G是由上述四种元素组成的化合物,其转化关系如图所示,其中C是一种强碱,焰色试验呈黄色。

回答下列问题:
(1)元素Y在元素周期表中的位置是___________ 。
(2)Y、Z、M三种元素的原子半径由大到小的顺序为___________ (用元素符号表示)。
(3)能说明Z的非金属性强于Y的依据是___________ (写一点即可)。
(4)写出反应①的离子方程式___________ 。
(5)去除A溶液中混有的少量B的方法是___________ 。
(6)3.9g固体D与足量F反应转移的电子数目为___________ 。
(7)下列实验方案中,能测定出物质A和B的混合物中B的质量分数的是___________ (填标号)。
a.取mg混合物充分加热,质量减少ng
b.取mg混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到ng固体
c.取mg混合物与足量NaOH溶液充分反应,得到ng溶液
d.取mg混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加ng

回答下列问题:
(1)元素Y在元素周期表中的位置是
(2)Y、Z、M三种元素的原子半径由大到小的顺序为
(3)能说明Z的非金属性强于Y的依据是
(4)写出反应①的离子方程式
(5)去除A溶液中混有的少量B的方法是
(6)3.9g固体D与足量F反应转移的电子数目为
(7)下列实验方案中,能测定出物质A和B的混合物中B的质量分数的是
a.取mg混合物充分加热,质量减少ng
b.取mg混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到ng固体
c.取mg混合物与足量NaOH溶液充分反应,得到ng溶液
d.取mg混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加ng
您最近半年使用:0次
名校
解题方法
2 . A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
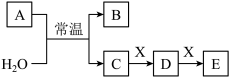
(1)若A为常见的金属单质,焰色试验呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:__ 。证明D已经氧化变质的方法是:取少量D固体溶于水中,__ 。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强。该元素在元素周期表中的位置为__ ,则X可能为__ (填代号)。
a.NaHCO3 b.Na2CO3 c.Fe(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为__ 。若X为一种最常见的造成温室效应的气体。若鉴别等浓度的D、E两种溶液,可选择的试剂为__ (填代号)。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为__ ,E是__ (填化学式)。

(1)若A为常见的金属单质,焰色试验呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强。该元素在元素周期表中的位置为
a.NaHCO3 b.Na2CO3 c.Fe(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为
您最近半年使用:0次
解题方法
3 . Ⅰ、A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3两种化合物。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
①D元素在元素周期表中的位置是______________ 。
②A与D所形成的化合物的电子式为___________________ 。
③将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的化学方程式为_______________ 。
Ⅱ、由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。

(1)若A为金属钠, A与水反应的离子方程式为______________________ 。
(2)若A为过氧化钠, A与水反应的化学方程式为____________________ 。
(3)A不论是Na还是Na2O2,依据转化关系判断物质D是_______________ ,
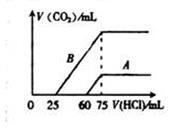
(4)向30ml某浓度的B溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示两种情况(不计CO2的溶解),则曲线B表明M中的溶质为______________ ;原NaOH溶液的物质的量浓度为__________ ;由曲线A、B可知,两次实验通入的CO2的体积比为___________ 。
(5)请你设计一实验证明Na2CO3溶液碱性比NaHCO3溶液的碱性强:__________________ 。
①D元素在元素周期表中的位置是
②A与D所形成的化合物的电子式为
③将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的化学方程式为
Ⅱ、由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。

(1)若A为金属钠, A与水反应的离子方程式为
(2)若A为过氧化钠, A与水反应的化学方程式为
(3)A不论是Na还是Na2O2,依据转化关系判断物质D是
(4)向30ml某浓度的B溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示两种情况(不计CO2的溶解),则曲线B表明M中的溶质为

(5)请你设计一实验证明Na2CO3溶液碱性比NaHCO3溶液的碱性强:
您最近半年使用:0次
4 . 下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
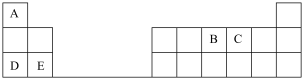
完成下列填空(填元素符号或化学式):
(1)元素C在元素周期表中的位置是__________ ,B、C、E三种元素原子半径从大到小的顺序是__________ ;
(2)D简单离子的结构示意图为______________ ,D的金属性________ E的金属性(填“大于”“小于”“等于”)。D单质在空气中燃烧可生成淡黄色粉末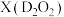 ,
, 的电子式为
的电子式为___________ ,D的最高价氧化物对应的水化物中含有的化学键类型有_________ 。
(3)将 、
、 的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入
的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入 的盐酸,所加盐酸的体积与产生
的盐酸,所加盐酸的体积与产生 的体积(标准状况)关系如图所示。
的体积(标准状况)关系如图所示。
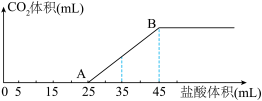
已知:逐滴将盐酸加入碳酸钠溶液中时,盐酸先与碳酸钠反应生成碳酸氢钠。
①AB段发生反应的离子方程式为____________ 。
②原固体混合物中 与
与 的物质的量之比为
的物质的量之比为____________ 。

完成下列填空(填元素符号或化学式):
(1)元素C在元素周期表中的位置是
(2)D简单离子的结构示意图为
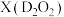 ,
, 的电子式为
的电子式为(3)将
 、
、 的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入
的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入 的盐酸,所加盐酸的体积与产生
的盐酸,所加盐酸的体积与产生 的体积(标准状况)关系如图所示。
的体积(标准状况)关系如图所示。
已知:逐滴将盐酸加入碳酸钠溶液中时,盐酸先与碳酸钠反应生成碳酸氢钠。
①AB段发生反应的离子方程式为
②原固体混合物中
 与
与 的物质的量之比为
的物质的量之比为
您最近半年使用:0次
5 . A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大。A、D同主族,B的简单气态氢化物的水溶液呈碱性,C、E同主族,形成的化合物 是形成酸雨的主要物质之一。请回答下列问题:
是形成酸雨的主要物质之一。请回答下列问题:
(1)F在元素周期表中的位置为_________ 。
(2)D2E溶液在空气中长期放置会发生反应,生成物之一为H。H与 的结构和化学性质相似,其溶液显黄色。写出
的结构和化学性质相似,其溶液显黄色。写出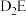 溶液在空气中长期放置生成H的化学方程式:
溶液在空气中长期放置生成H的化学方程式:___________ 。H溶液与稀硫酸反应产生的现象为_______________ 。
(3)化学家发现一种化学式为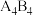 的离子化合物,一定条件下
的离子化合物,一定条件下 熔融
熔融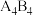 电离生成两种离子各
电离生成两种离子各 ,则该物质熔融时的电离方程式为
,则该物质熔融时的电离方程式为______________ 。
(4)向 某浓度由A、B、C、D中的三种元素形成的一元强碱溶液中通入
某浓度由A、B、C、D中的三种元素形成的一元强碱溶液中通入 气体后得溶液M,因
气体后得溶液M,因 通入量的不同,溶液M的组成也不同。若向溶液M中逐滴加入
通入量的不同,溶液M的组成也不同。若向溶液M中逐滴加入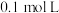 盐酸,产生的气体体积
盐酸,产生的气体体积 与加入盐酸的体积[V(盐酸)]的关系有如图所示两种情况(不计
与加入盐酸的体积[V(盐酸)]的关系有如图所示两种情况(不计 的溶解)。
的溶解)。
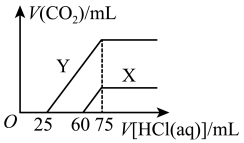
①原一元强碱溶液的物质的量浓度为________  。
。
②由曲线X、Y可知,两次实验通入的 体积之比为
体积之比为__________ 。
 是形成酸雨的主要物质之一。请回答下列问题:
是形成酸雨的主要物质之一。请回答下列问题:(1)F在元素周期表中的位置为
(2)D2E溶液在空气中长期放置会发生反应,生成物之一为H。H与
 的结构和化学性质相似,其溶液显黄色。写出
的结构和化学性质相似,其溶液显黄色。写出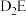 溶液在空气中长期放置生成H的化学方程式:
溶液在空气中长期放置生成H的化学方程式:(3)化学家发现一种化学式为
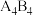 的离子化合物,一定条件下
的离子化合物,一定条件下 熔融
熔融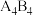 电离生成两种离子各
电离生成两种离子各 ,则该物质熔融时的电离方程式为
,则该物质熔融时的电离方程式为(4)向
 某浓度由A、B、C、D中的三种元素形成的一元强碱溶液中通入
某浓度由A、B、C、D中的三种元素形成的一元强碱溶液中通入 气体后得溶液M,因
气体后得溶液M,因 通入量的不同,溶液M的组成也不同。若向溶液M中逐滴加入
通入量的不同,溶液M的组成也不同。若向溶液M中逐滴加入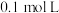 盐酸,产生的气体体积
盐酸,产生的气体体积 与加入盐酸的体积[V(盐酸)]的关系有如图所示两种情况(不计
与加入盐酸的体积[V(盐酸)]的关系有如图所示两种情况(不计 的溶解)。
的溶解)。
①原一元强碱溶液的物质的量浓度为
 。
。②由曲线X、Y可知,两次实验通入的
 体积之比为
体积之比为
您最近半年使用:0次
解题方法
6 . A、B、C、D、E、F、G六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;A、D同主族,D的焰色反应为黄色;E的简单阳离子与X具有相同电子数,且E是同周期中简单离子半径最小的元素;F元素的原子最外层比次外层少两个电子,C、G两种元素的原子最外层共有13个电子。则
(1)F在元素周期表中的位置为_______________ 。
(2)用电子式表示D2F的形成过程_____________ 。
(3)在2 L的密闭容器中,充入2 mol B2和3 mol A2,在一定条件下发生反应,5 s后测得A2为1.8 mol,则以B2的表示的反应速率v(B2)为__________________________ 。
(4)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为_______________ 。
(5)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol A4B4熔融电离生成两种离子各1mol,则该物质熔融时的电离方程式为____________ 。
(6)向30mL某浓度由A、B、C、D中三种元素形成一元强碱溶液通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。
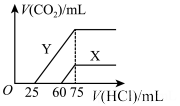
则曲线Y表明M中的溶质为________ ;原NaOH溶液的物质的量浓度为_______ ;由曲线X、Y可知,两次实验通入的CO2的体积比为_________ 。
(1)F在元素周期表中的位置为
(2)用电子式表示D2F的形成过程
(3)在2 L的密闭容器中,充入2 mol B2和3 mol A2,在一定条件下发生反应,5 s后测得A2为1.8 mol,则以B2的表示的反应速率v(B2)为
(4)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为
(5)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol A4B4熔融电离生成两种离子各1mol,则该物质熔融时的电离方程式为
(6)向30mL某浓度由A、B、C、D中三种元素形成一元强碱溶液通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。
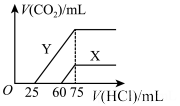
则曲线Y表明M中的溶质为
您最近半年使用:0次
名校
7 . A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大。A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一。用化学用语回答下列问题:
(1)F在元素周期表中的位置为__ 。
(2)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。H的电子式为___ ,写出在空气中长期放置生成H的化学反应方程式为:__ 。
(3)向30mL某浓度由A、B、C、D中三种元素形成一元强碱溶液通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。
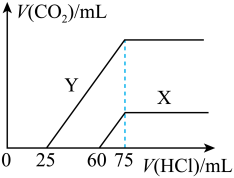
则曲线Y表明M中的溶质为___ ;原NaOH溶液的物质的量浓度为__ ;由曲线X、Y可知,两次实验通入的CO2的体积比为__ 。
(1)F在元素周期表中的位置为
(2)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。H的电子式为
(3)向30mL某浓度由A、B、C、D中三种元素形成一元强碱溶液通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。

则曲线Y表明M中的溶质为
您最近半年使用:0次
2010·河南鹤壁·一模
解题方法
8 . A、B、D、X、Y是由短周期元素组成的化合物,其中X、Y分别是常见的强酸、强碱。它们存在如下图转化(部分生成物和水略去)。
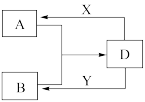
(1)若A、B均为气体,在水溶液中反应生成正盐D,其中A是形成酸雨的主要物质。则D的化学式是_______ 。B发生催化氧化反应的化学方程式是______________ 。
(2)若A、B、D含有相同的金属元素,则此元素在元素周期表中的位置是_____________ ,工业上制取该金属单质的化学方程式为:_________________ ,现将X滴入B的溶液中至过量,该过程发生的离子方程式为:_________________ 。
(3)若A为无色无味的气体,B为盐,且A、B、D三种物质含有相同元素,则A的电子式为:____ ,A与B溶液反应生成D的离子方程式为:____________ 。

(1)若A、B均为气体,在水溶液中反应生成正盐D,其中A是形成酸雨的主要物质。则D的化学式是
(2)若A、B、D含有相同的金属元素,则此元素在元素周期表中的位置是
(3)若A为无色无味的气体,B为盐,且A、B、D三种物质含有相同元素,则A的电子式为:
您最近半年使用:0次
9 . 已知甲、乙、丙、丁是四种常见物质,其转化关系如图所示。
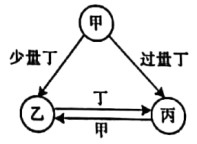
请回答下列问题:
(1)若丁为O2,乙常温下为淡黄色单质固体。写出乙中所含元素在周期表中的位置__ ,甲的分子式___ 。
(2)若丙和丁均为金属单质,且丙为我国目前生产量最大,使用最广泛的金属,甲和乙均为盐溶液。比较丙和丁还原性强弱:丙___ 丁(写>、<、=),甲跟丙反应生成乙的离子方程式__ 。
(3)若甲、乙、丙的水溶液均呈碱性且丙可制胃药。写出甲和丙反应生成乙的化学方程式__ 。

请回答下列问题:
(1)若丁为O2,乙常温下为淡黄色单质固体。写出乙中所含元素在周期表中的位置
(2)若丙和丁均为金属单质,且丙为我国目前生产量最大,使用最广泛的金属,甲和乙均为盐溶液。比较丙和丁还原性强弱:丙
(3)若甲、乙、丙的水溶液均呈碱性且丙可制胃药。写出甲和丙反应生成乙的化学方程式
您最近半年使用:0次
10 . 非金属及其化合物在生产、生活中应用广泛。
Ⅰ.CO2的有效利用可以缓解温室效应和能源短缺问题,CO2的分子结构决定了其性质和用途。
(1) CO2的电子式是_______ ,包含的化学键类型为_______ 共价键(填“非极性”或“极性”)。
(2) 在温度高于31.26 ℃、压强高于7.29×106 Pa时,CO2处于超临界状态,称为超临界CO2流体,可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,超临界CO2萃取的优点有_______ (答出一点即可)。
Ⅱ.某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制出如下转化关系图(部分反应物或产物略去),并用于研究物质A、B、C、D的性质及其变化。
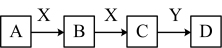
(3)若A是黄绿色气体,X是生活中应用最大量的金属,D是白色固体。
①组成A的元素在周期表中的位置是_______ 。
②下列说法正确的是______ (填字母)。
a.B的水溶液中加入KSCN溶液,变为红色
b.C只具有还原性
c.若Y是碱,D放置在空气中会迅速变为灰绿色,最终变为红褐色
(4)若A、B、C、D的焰色反应均为黄色,X的固体俗称干冰。
① B转化为C的离子方程式是________ 。
② A用于呼吸面具或潜水艇中氧气的来源,若A和X反应生成1 mol B时,转移电子数为______ 。
③ C与Y反应生成X的离子方程式_________ 。
Ⅰ.CO2的有效利用可以缓解温室效应和能源短缺问题,CO2的分子结构决定了其性质和用途。
(1) CO2的电子式是
(2) 在温度高于31.26 ℃、压强高于7.29×106 Pa时,CO2处于超临界状态,称为超临界CO2流体,可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,超临界CO2萃取的优点有
Ⅱ.某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制出如下转化关系图(部分反应物或产物略去),并用于研究物质A、B、C、D的性质及其变化。

(3)若A是黄绿色气体,X是生活中应用最大量的金属,D是白色固体。
①组成A的元素在周期表中的位置是
②下列说法正确的是
a.B的水溶液中加入KSCN溶液,变为红色
b.C只具有还原性
c.若Y是碱,D放置在空气中会迅速变为灰绿色,最终变为红褐色
(4)若A、B、C、D的焰色反应均为黄色,X的固体俗称干冰。
① B转化为C的离子方程式是
② A用于呼吸面具或潜水艇中氧气的来源,若A和X反应生成1 mol B时,转移电子数为
③ C与Y反应生成X的离子方程式
您最近半年使用:0次



