1 . Ⅰ.现代工业常以NaCl为原料制备纯碱,部分工艺流程如图:
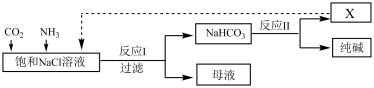
(1)产物X为_______________ (填化学式)。
(2)反应Ⅰ的化学方程式为________________________________________ 。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。其中碱石灰的主要成分为氧化钙和氢氧化钠。

(3)装置a的仪器名称是_____________ ,装置①中X试剂的作用为_____________ 。
(4)若装置③中Ba(OH)2不足,则该装置中发生反应的离子方程式为_____________ 。
(5)实验结束后继续通入空气的目的是_________________________________ 。
(6)实验前称取25.0 g样品,③中产生BaCO3质量为39.4 g,则样品中Na2CO3的质量分数为__________ (保留小数点后一位);若缺少④装置,会使测定结果__________ (填“偏高”或“偏低”)。

(1)产物X为
(2)反应Ⅰ的化学方程式为
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。其中碱石灰的主要成分为氧化钙和氢氧化钠。

(3)装置a的仪器名称是
(4)若装置③中Ba(OH)2不足,则该装置中发生反应的离子方程式为
(5)实验结束后继续通入空气的目的是
(6)实验前称取25.0 g样品,③中产生BaCO3质量为39.4 g,则样品中Na2CO3的质量分数为
您最近一年使用:0次
名校
2 . 碳酸钠俗称纯碱,用途非常广泛,我国化学家侯德榜发明了“侯氏制碱法”。南宁二中2023级化学兴趣小组在实验室中模拟“侯氏制碱法”制备 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如下所示。
,实验流程如下所示。
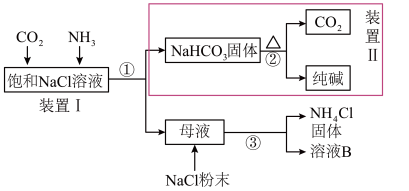
请回答下列问题:
(1)上述流程中,①②③所涉及的操作方法,包含过滤的是___________ (填序号)。过滤时,所需要的玻璃仪器:烧杯、___________ 、___________ 。
(2)向装置Ⅰ的饱和 溶液中通入足量的
溶液中通入足量的 和
和 ,应先通入足量
,应先通入足量___________ (填“ ”或“
”或“ ”)。装置Ⅰ中发生反应的化学方程式为
”)。装置Ⅰ中发生反应的化学方程式为___________ 。
(3)检验装置Ⅱ中制备的纯碱含有 的方法:取少量该纯碱样品溶于水,
的方法:取少量该纯碱样品溶于水,___________ 。
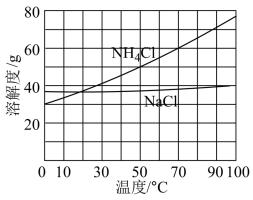
(4)向母液中加入一定量 粉末,存在
粉末,存在 。为使
。为使 晶体充分析出并分离,根据下图中
晶体充分析出并分离,根据下图中 和
和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为___________ 、___________ 、过滤、洗涤、干燥。
(5)整个实验流程中,可循环利用的物质的化学式是___________ 。
(6)若装置Ⅱ中得到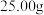 的碳酸钠和碳酸氢钠的固体混合物,加热至混合物质量不再变化,固体质量共减少了
的碳酸钠和碳酸氢钠的固体混合物,加热至混合物质量不再变化,固体质量共减少了 ,则原混合物中碳酸钠的质量分数为
,则原混合物中碳酸钠的质量分数为___________ 。
 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如下所示。
,实验流程如下所示。
请回答下列问题:
(1)上述流程中,①②③所涉及的操作方法,包含过滤的是
(2)向装置Ⅰ的饱和
 溶液中通入足量的
溶液中通入足量的 和
和 ,应先通入足量
,应先通入足量 ”或“
”或“ ”)。装置Ⅰ中发生反应的化学方程式为
”)。装置Ⅰ中发生反应的化学方程式为(3)检验装置Ⅱ中制备的纯碱含有
 的方法:取少量该纯碱样品溶于水,
的方法:取少量该纯碱样品溶于水,(4)向母液中加入一定量
 粉末,存在
粉末,存在 。为使
。为使 晶体充分析出并分离,根据下图中
晶体充分析出并分离,根据下图中 和
和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为
(5)整个实验流程中,可循环利用的物质的化学式是
(6)若装置Ⅱ中得到
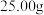 的碳酸钠和碳酸氢钠的固体混合物,加热至混合物质量不再变化,固体质量共减少了
的碳酸钠和碳酸氢钠的固体混合物,加热至混合物质量不再变化,固体质量共减少了 ,则原混合物中碳酸钠的质量分数为
,则原混合物中碳酸钠的质量分数为
您最近一年使用:0次
名校
3 . 回答下列问题。
(1)标况下,0.1mol 所占的体积约为
所占的体积约为_______ L,所含的电子总数约为________ 个。
(2)从400mL2.0mol/L的 溶液中取出20mL,将这20mL加水稀释到100mL,所得的溶液中
溶液中取出20mL,将这20mL加水稀释到100mL,所得的溶液中 的物质的量浓度为
的物质的量浓度为___________ mol/L。
(3) 和
和 组成的固体混合物40.0g加热至质量不再变化,冷却干燥后称得残余固体质量为33.8g,则原固体混合物中
组成的固体混合物40.0g加热至质量不再变化,冷却干燥后称得残余固体质量为33.8g,则原固体混合物中 的质量分数为
的质量分数为___________ %[保留小数点后1位]。
(4)常温常压下,某钢性瓶充满 气体时质量为273.90g,改充满
气体时质量为273.90g,改充满 则质量为275.50g。若充满
则质量为275.50g。若充满 则质量是
则质量是___________ g[保留小数点后2位]。
(5)往100mL4.0mol/L的NaOH溶液中缓缓地通入2.24L 气体(标况),若忽略溶液体积的变化,所得溶液的溶质及其物质的量浓度分别为
气体(标况),若忽略溶液体积的变化,所得溶液的溶质及其物质的量浓度分别为___________ 。
(1)标况下,0.1mol
 所占的体积约为
所占的体积约为(2)从400mL2.0mol/L的
 溶液中取出20mL,将这20mL加水稀释到100mL,所得的溶液中
溶液中取出20mL,将这20mL加水稀释到100mL,所得的溶液中 的物质的量浓度为
的物质的量浓度为(3)
 和
和 组成的固体混合物40.0g加热至质量不再变化,冷却干燥后称得残余固体质量为33.8g,则原固体混合物中
组成的固体混合物40.0g加热至质量不再变化,冷却干燥后称得残余固体质量为33.8g,则原固体混合物中 的质量分数为
的质量分数为(4)常温常压下,某钢性瓶充满
 气体时质量为273.90g,改充满
气体时质量为273.90g,改充满 则质量为275.50g。若充满
则质量为275.50g。若充满 则质量是
则质量是(5)往100mL4.0mol/L的NaOH溶液中缓缓地通入2.24L
 气体(标况),若忽略溶液体积的变化,所得溶液的溶质及其物质的量浓度分别为
气体(标况),若忽略溶液体积的变化,所得溶液的溶质及其物质的量浓度分别为
您最近一年使用:0次
4 . 生活处处有化学,制作馒头、面包等所用的发酵粉,主要成分是由 、
、 和固体有机酸混合而成的。
和固体有机酸混合而成的。
(1)将 和
和 分别加热,能产生
分别加热,能产生 的物质是
的物质是___________ (填化学式),该反应的化学方程式为___________ 。
(2)向盛有 溶液的试管中滴加澄清石灰水,可观察到(填实验现象)
溶液的试管中滴加澄清石灰水,可观察到(填实验现象)___________ ,发生的离子反应方程式为___________ 。 可用于治疗胃酸过多,反应的离子方程式为
可用于治疗胃酸过多,反应的离子方程式为___________ 。
(3)下列实验方案中,能测定出 和
和 的混合物中
的混合物中 质量分数的是___________。
质量分数的是___________。
 、
、 和固体有机酸混合而成的。
和固体有机酸混合而成的。(1)将
 和
和 分别加热,能产生
分别加热,能产生 的物质是
的物质是(2)向盛有
 溶液的试管中滴加澄清石灰水,可观察到(填实验现象)
溶液的试管中滴加澄清石灰水,可观察到(填实验现象) 可用于治疗胃酸过多,反应的离子方程式为
可用于治疗胃酸过多,反应的离子方程式为(3)下列实验方案中,能测定出
 和
和 的混合物中
的混合物中 质量分数的是___________。
质量分数的是___________。| A.取ag混合物充分加热至恒重,剩余固体质量为bg |
B.取ag混合物与足量 溶液充分反应,加热、蒸干、灼烧,得到bg固体 溶液充分反应,加热、蒸干、灼烧,得到bg固体 |
| C.取ag混合物与足量盐酸充分反应,加热、蒸干、灼烧,得到bg固体 |
| D.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加bg |
您最近一年使用:0次
名校
解题方法
5 . 下列实验方案中,能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
| A.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| B.取a克混合物与足量NaOH溶液充分反应,得到b克溶液 |
| C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加b克 |
| D.取a克混合物与过量NaOH溶液充分反应,加热、蒸干、灼烧,得b克固体 |
您最近一年使用:0次
2024-01-01更新
|
35次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高一上学期10月考试化学试卷
6 . Na2CO3、NaHCO3是生活中常见的盐,某实验小组通过以下实验探究这两种物质的性质。
(1)称取两种固体各1g分别放入两支试管中,再各加入5mL水,充分振荡,并恢复至室温。发现Na2CO3完全溶解,而NaHCO3有剩余。由此得出结论:在相同温度下,_______ 。
(2)某学生设计如图所示装置进行NaHCO3的分解实验,并证实产物中有CO2产生。
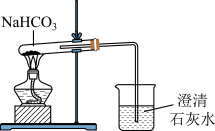
①试管中发生的化学反应方程式为_______ 。
②指出该学生设计的装置图的错误之处,并改正(文字说明即可)_______ 。
(3)测定Na2CO3样品(含氯化钠杂质)中Na2CO3的质量分数:
①称取mg样品放入烧杯内加水溶解。
②加入过量的氯化钙溶液充分反应,反应的化学方程式为_______ 。
③过滤、洗涤、干燥,称量沉淀的质量为ng。则样品中Na2CO3的质量分数为_______ 。
(1)称取两种固体各1g分别放入两支试管中,再各加入5mL水,充分振荡,并恢复至室温。发现Na2CO3完全溶解,而NaHCO3有剩余。由此得出结论:在相同温度下,
(2)某学生设计如图所示装置进行NaHCO3的分解实验,并证实产物中有CO2产生。

①试管中发生的化学反应方程式为
②指出该学生设计的装置图的错误之处,并改正(文字说明即可)
(3)测定Na2CO3样品(含氯化钠杂质)中Na2CO3的质量分数:
①称取mg样品放入烧杯内加水溶解。
②加入过量的氯化钙溶液充分反应,反应的化学方程式为
③过滤、洗涤、干燥,称量沉淀的质量为ng。则样品中Na2CO3的质量分数为
您最近一年使用:0次
名校
7 . Ⅰ.现有一定量含有Na2O杂质的Na2O2试样,用如下图所示的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量。可供选用的反应物:CaCO3固体、盐酸、硫酸溶液和蒸馏水)。回答下列问题。

(1)装置A中反应的离子方程式为___________ 。
(2)写出装置D中反应生成O2的化学方程式,并用双线桥法表示其电子的转移___________ 。
(3)装置E中碱石灰的作用是___________ 。
Ⅱ.纯碱是一种重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产。“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠,再加热碳酸氢钠即可制得纯碱,查阅资料知:NH3极易溶于水,溶于水呈碱性。部分工艺流程如图1所示。

(4)纯碱属于___________ (填“酸”、“碱”或“盐”)。
(5)为了提高NaHCO3的产量,CO2和NH3通入饱和NaCl溶液的先后顺序为___________ (选填字母编号)
A.先通CO2再通NH3 B.先通NH3再通CO2
图2中导管b通入___________ (填“NH3”或“CO2”),导管a不能插入液面以下的原因是___________ ,装置c中的试剂为___________ (选填字母编号)。

A.碱石灰 B.浓硫酸 C.五氧化二磷

(1)装置A中反应的离子方程式为
(2)写出装置D中反应生成O2的化学方程式,并用双线桥法表示其电子的转移
(3)装置E中碱石灰的作用是
Ⅱ.纯碱是一种重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产。“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠,再加热碳酸氢钠即可制得纯碱,查阅资料知:NH3极易溶于水,溶于水呈碱性。部分工艺流程如图1所示。

(4)纯碱属于
(5)为了提高NaHCO3的产量,CO2和NH3通入饱和NaCl溶液的先后顺序为
A.先通CO2再通NH3 B.先通NH3再通CO2
图2中导管b通入

A.碱石灰 B.浓硫酸 C.五氧化二磷
您最近一年使用:0次
名校
解题方法
8 . 制作馒头时常加入泡打粉,以便产生CO2,使馒头变得松软可口。某兴趣小组对泡打粉的发面原理产生兴趣,进行了以下实验探究。
查阅资料:泡打粉是一种复合膨松剂,用于实验的泡打粉的主要成分是小苏打和酒石酸氢钾。
(1)提出问题加入泡打粉后制作馒头为什么会产生CO2?
(2)猜想:
猜想1:小苏打受热分解产生CO2;
猜想2:酒石酸氢钾受热分解产生CO2;
猜想3:小苏打和酒石酸氢钾在溶液中发生反应,产生CO2。
(1)实验探究
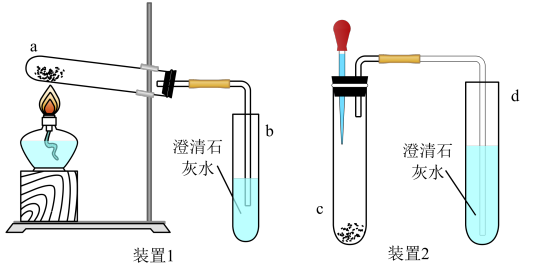
兴趣小组首先利用如图所示实验装置进行探究。
(2)实验拓展
兴趣小组认为纯碱和小苏打的类别一样(从组成和性质上划分),猜想纯碱和酒石酸氢钾在溶液中也可以发生反应并产生CO2,为充分利用上述实验完成后的装置及所涉及试剂,请你设计实验方案加以验证兴趣小组的猜想,你的实验方案为:___ 。
(3)某失效膨松剂样品的主要成分是NaHCO3和Na2CO3。为测定该样品中Na2CO3质量分数,设计并实施了以下实验。
实验1:利用如图装置进行实验并通过测定干燥管的增重来测量CO2的质量。

①试剂X的化学名称为___ 。
②某同学认为装置中干燥管的增重并不能准确表示混合物与稀硫酸反应产生的CO2的质量,其理由是___ 。
实验2:取ag样品加热、冷却、称重,重复以上操作至样品固体质量不再变化,称量其质量为bg。
③写出加热过程中发生反应的化学方程式____ 。
④样品中Na2CO3质量分数为(用a、b表示)____ 。
查阅资料:泡打粉是一种复合膨松剂,用于实验的泡打粉的主要成分是小苏打和酒石酸氢钾。
(1)提出问题加入泡打粉后制作馒头为什么会产生CO2?
(2)猜想:
猜想1:小苏打受热分解产生CO2;
猜想2:酒石酸氢钾受热分解产生CO2;
猜想3:小苏打和酒石酸氢钾在溶液中发生反应,产生CO2。
(1)实验探究
兴趣小组首先利用如图所示实验装置进行探究。

| 实验 | 实验方案及操作 | 实验现象 | 实验解释或结论 |
| 实验Ⅰ | 在装置1的a试管中放入小苏打,加热 | a试管口内壁有无色液滴产生;b试管中主要观察到的现象有 | b试管中发生反应的化学方程式为 |
| 实验Ⅱ | 在装置1的a试管中放入酒石酸氢钾,加热 | a试管口内壁有无色液滴产生;b试管中澄清石灰水不变浑浊 | 猜想2 |
| 实验Ⅲ | 在装置2的c试管中放入小苏打和酒石酸氢钾的混合物,滴加 | d试管中澄清石灰水变浑浊 | 猜想3正确 |
兴趣小组认为纯碱和小苏打的类别一样(从组成和性质上划分),猜想纯碱和酒石酸氢钾在溶液中也可以发生反应并产生CO2,为充分利用上述实验完成后的装置及所涉及试剂,请你设计实验方案加以验证兴趣小组的猜想,你的实验方案为:
(3)某失效膨松剂样品的主要成分是NaHCO3和Na2CO3。为测定该样品中Na2CO3质量分数,设计并实施了以下实验。
实验1:利用如图装置进行实验并通过测定干燥管的增重来测量CO2的质量。

①试剂X的化学名称为
②某同学认为装置中干燥管的增重并不能准确表示混合物与稀硫酸反应产生的CO2的质量,其理由是
实验2:取ag样品加热、冷却、称重,重复以上操作至样品固体质量不再变化,称量其质量为bg。
③写出加热过程中发生反应的化学方程式
④样品中Na2CO3质量分数为(用a、b表示)
您最近一年使用:0次
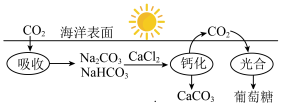
9 . 海洋是一个巨大的化学资源宝库,其中钠元素是海洋中含量较高的元素。
(1)已知在太阳光作用下,绿色植物体内的叶绿素能将水、CO2转化为葡萄糖。海水吸收CO2并进行碳循环的原理示意图如下:
(2)某同学欲用碳酸钠晶体(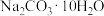 )配制220mL1mol/L的Na2CO3溶液。
)配制220mL1mol/L的Na2CO3溶液。
①所需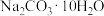 的质量为
的质量为___________ g。
②实验中除需要托盘天平(带砝码)、药匙、量筒、烧杯、玻璃棒、试剂瓶外,还需要的玻璃仪器有___________ 。
③配制溶液时正确的操作顺序是:_________ (填字母,下同)
计算→称量→___________→___________→___________→___________→___________→装瓶贴标签。
a.转移 b.定容 c.摇匀 d.洗涤 e.溶解
④下列实验操作会使配制溶液浓度偏高的是___________ 。
A.容量瓶清洗后,未经过干燥处理
B.定容时,俯视刻度线
C.定容后倒转容量瓶几次,发现液面最低点低于刻度线,再补加几滴水至刻度线
D.所用碳酸钠晶体失去结晶水
(1)已知在太阳光作用下,绿色植物体内的叶绿素能将水、CO2转化为葡萄糖。海水吸收CO2并进行碳循环的原理示意图如下:
| A.CO2是碱性氧化物 |
| B.等质量的NaHCO3和Na2CO3分别与足量的盐酸反应,前者产生的二氧化碳气体较多 |
C.碳酸氢钠的电离方程式为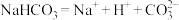 |
| D.该循环过程中未涉及氧化还原反应 |
(2)某同学欲用碳酸钠晶体(
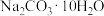 )配制220mL1mol/L的Na2CO3溶液。
)配制220mL1mol/L的Na2CO3溶液。①所需
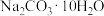 的质量为
的质量为②实验中除需要托盘天平(带砝码)、药匙、量筒、烧杯、玻璃棒、试剂瓶外,还需要的玻璃仪器有
③配制溶液时正确的操作顺序是:
计算→称量→___________→___________→___________→___________→___________→装瓶贴标签。
a.转移 b.定容 c.摇匀 d.洗涤 e.溶解
④下列实验操作会使配制溶液浓度偏高的是
A.容量瓶清洗后,未经过干燥处理
B.定容时,俯视刻度线
C.定容后倒转容量瓶几次,发现液面最低点低于刻度线,再补加几滴水至刻度线
D.所用碳酸钠晶体失去结晶水
您最近一年使用:0次
2024-01-25更新
|
58次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高一上学期1月考试化学试卷
10 . 工业上以粗盐(含 、
、 杂质)为原料生产
杂质)为原料生产 ,工艺流程如图所示:
,工艺流程如图所示:

(1)向粗盐水加入 的目的是
的目的是_______ ,滤渣A为_______ (写化学式),加入 和
和 的顺序
的顺序_______ (填“能”或“不能”)互换。
(2)先通入 再通入
再通入 的目的是
的目的是_______ 。
(3)“碳酸化”时没有 晶体析出,原因是
晶体析出,原因是_______ 。
(4)滤液B中溶质的主要成分是_______ (写化学式),该物质在农业上的用途是_______ 。
(5)“煅烧”发生的化学反应方程式为_______ 。
(6)得到的 产品中常含有
产品中常含有 ,可用加热分解的方法测定产品中
,可用加热分解的方法测定产品中 的质量分数。若取a g产品,充分加热后固体的质量变为b g,
的质量分数。若取a g产品,充分加热后固体的质量变为b g, 在产品中的质量分数为
在产品中的质量分数为_______ 。(列出计算式)。
 、
、 杂质)为原料生产
杂质)为原料生产 ,工艺流程如图所示:
,工艺流程如图所示:
(1)向粗盐水加入
 的目的是
的目的是 和
和 的顺序
的顺序(2)先通入
 再通入
再通入 的目的是
的目的是(3)“碳酸化”时没有
 晶体析出,原因是
晶体析出,原因是(4)滤液B中溶质的主要成分是
(5)“煅烧”发生的化学反应方程式为
(6)得到的
 产品中常含有
产品中常含有 ,可用加热分解的方法测定产品中
,可用加热分解的方法测定产品中 的质量分数。若取a g产品,充分加热后固体的质量变为b g,
的质量分数。若取a g产品,充分加热后固体的质量变为b g, 在产品中的质量分数为
在产品中的质量分数为
您最近一年使用:0次



