1 . 下列有关方程式错误的是
A.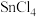 加入水中生成沉淀: 加入水中生成沉淀: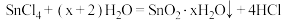 |
B.硫代硫酸钠与稀硫酸反应: |
C.向碳酸钠溶液中滴加少量的稀盐酸: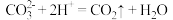 |
D.将 通入水中: 通入水中: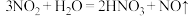 |
您最近一年使用:0次
2024-04-15更新
|
245次组卷
|
2卷引用:2024届贵州省高三下学期二模化学试题
名校
解题方法
2 . 下列选项描述与对应图像相符的是
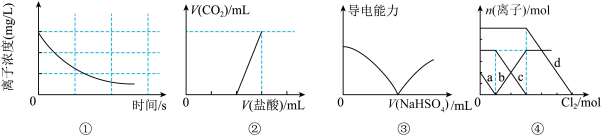

A.图①为新制氯水在阳光直射时,溶液中 浓度随着时间变化的曲线 浓度随着时间变化的曲线 |
B.图②为往 与 与 的物质的量之比为 的物质的量之比为 的混合液中滴加盐酸的体积与产生 的混合液中滴加盐酸的体积与产生 体积变化的图像 体积变化的图像 |
C.图③为往 溶液中滴加 溶液中滴加 溶液的体积与导电性变化的图像 溶液的体积与导电性变化的图像 |
D.图④为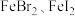 混合液中部分离子的物质的量随氯气通入的变化图像,其中a代表的是 混合液中部分离子的物质的量随氯气通入的变化图像,其中a代表的是 |
您最近一年使用:0次
2023-12-27更新
|
536次组卷
|
3卷引用:湖北省(T8联考)2024届高三上学期第一次学业质量评价化学试题
名校
3 . 某实验小组欲探究 和
和 的性质,发现实验室里盛放两种固体的试剂瓶丢了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
的性质,发现实验室里盛放两种固体的试剂瓶丢了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为___________ 。
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现 固体完全溶解,而
固体完全溶解,而 固体有剩余,由此得出结论:
固体有剩余,由此得出结论:___________ 。
②同学们在两烧杯中还观察到以下现象。其中,盛放 的烧杯中出现的现象是
的烧杯中出现的现象是___________ (填字母序号)
a.溶液温度升高 b.溶液温度下降
c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置I和II中分别放入药品,将气球内的固体同时倒入试管中。
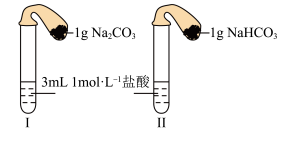
①两试管中均产生气体,___________ 的反应程度更为剧烈。(填“I”或“II”)
②反应结束后,恢复至室温,下列说法正确的是___________ 。
a.装置I的气球体积较大 b.装置II的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成 的溶液,设计如下方案并对反应现象做出预测:
的溶液,设计如下方案并对反应现象做出预测:
实施实验后,发现操作1的现象与预测有差异:产生白色沉淀和二氧化碳气体。则该条件下, 溶液与
溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为___________ 。
 和
和 的性质,发现实验室里盛放两种固体的试剂瓶丢了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
的性质,发现实验室里盛放两种固体的试剂瓶丢了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现
 固体完全溶解,而
固体完全溶解,而 固体有剩余,由此得出结论:
固体有剩余,由此得出结论:②同学们在两烧杯中还观察到以下现象。其中,盛放
 的烧杯中出现的现象是
的烧杯中出现的现象是a.溶液温度升高 b.溶液温度下降
c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置I和II中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体,
②反应结束后,恢复至室温,下列说法正确的是
a.装置I的气球体积较大 b.装置II的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成
 的溶液,设计如下方案并对反应现象做出预测:
的溶液,设计如下方案并对反应现象做出预测:| 实验方案 | 预测现象 | 预测依据 |
操作1:向 溶液中滴加 溶液中滴加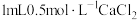 溶液 溶液 | 无白色沉淀 |  溶液中的 溶液中的 浓度很小,不能与 浓度很小,不能与 反应 反应 |
操作2:向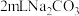 溶液中滴加 溶液中滴加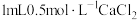 溶液 溶液 | 有白色沉淀 |  溶液中的 溶液中的 浓度较大,能与 浓度较大,能与 发生反应 发生反应 |
 溶液与
溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为
您最近一年使用:0次
4 . 学习小组为了探究Na2CO3溶液与盐溶液反应的规律,设计了如下实验:
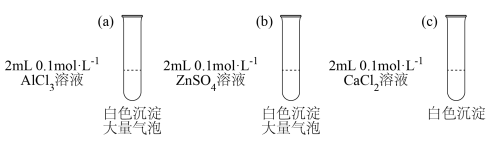
(1)分别向如下3支试和中加入2mL0.1mol·L-1Na2CO3溶液,现象记录如图。试管(a)中发生反应的离子方程式为_____ 。
(2)设计热分解实验,探究白色沉淀的成分:

将(1)中所得三种沉淀,分别置于B中。实验结束后,数据记录如下:
装置B的名称是_____ ,装置E的作用是_____ 。计算可得(b)中沉淀的化学式为_____ ,(c)中样品最终确定为CaCO3,试分析CaCO3未分解的原因_____ 。
(3)查表,得到几种物质的溶解度(20℃)数据如下:
(c)中沉淀是碳酸盐的原因是_____ 。根据探究的结论预测,物质的量浓度均为0.1mo1·L-1的CdSO4溶液和Na2CO3溶液等体积混合,得到的沉淀的化学式可能为_____ 。
(1)分别向如下3支试和中加入2mL0.1mol·L-1Na2CO3溶液,现象记录如图。试管(a)中发生反应的离子方程式为

(2)设计热分解实验,探究白色沉淀的成分:

将(1)中所得三种沉淀,分别置于B中。实验结束后,数据记录如下:
| 样品 | 加热前样品质量/g | 加热后样品质量/g | C质量增重/g | D质量增重/g |
| a | 5.2 | 3.4 | 1.8 | 0 |
| b | 11.2 | 8.1 | 0.9 | 2.2 |
| c | 5.0 | 5.0 | 0 | 0 |
(3)查表,得到几种物质的溶解度(20℃)数据如下:
| 物质 | 溶解度/g | 物质 | 溶解度/g | 物质 | 溶解度/g | 物质 | 溶解度/g |
| Al(OH)3 | 1.5×10-8 | Zn(OH)2 | 1.4×10-5 | Ca(OH)2 | 0.160 | Cd(OH)2 | 1.9×10-4 |
| Al2(CO3)3 | 易水解 | ZnCO3 | 4.7×10-5 | CaCO3 | 5.3×10-4 | CdCO3 | 4.3×10-5 |
您最近一年使用:0次
5 . 下图是为测定过氧化钠样品(只含Na2CO3杂质)纯度而设计的装置,气球Q弹性良好。


下列说法正确的是
A.Q中反应的离子方程式为 +2H+=H2O+CO2↑,2 +2H+=H2O+CO2↑,2 +4H+=2H2O+O2↑ +4H+=2H2O+O2↑ |
| B.测量气体体积时应先关闭K1、K2,打开K3,反应完毕后再缓缓打开K1 |
| C.没有导管a稀硫酸不易滴下来,而且会导致测量气体的体积偏大 |
D.若操作正确,量筒I、Ⅱ分别收集xmL、ymL水,则Na2O2的质量分数为 |
您最近一年使用:0次
名校
6 . 向100mLNaOH溶液中通入一定量的 气体,充分反应后再向所得溶液中逐滴加入0.2mol/L的盐酸,产生
气体,充分反应后再向所得溶液中逐滴加入0.2mol/L的盐酸,产生 的体积与所加盐酸体积之间的关系如图所示。下列判断正确的是
的体积与所加盐酸体积之间的关系如图所示。下列判断正确的是
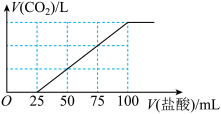
 气体,充分反应后再向所得溶液中逐滴加入0.2mol/L的盐酸,产生
气体,充分反应后再向所得溶液中逐滴加入0.2mol/L的盐酸,产生 的体积与所加盐酸体积之间的关系如图所示。下列判断正确的是
的体积与所加盐酸体积之间的关系如图所示。下列判断正确的是
| A.NaOH溶液的浓度为0.1mol/L |
B.通入的 在常温常压下的体积为336mL 在常温常压下的体积为336mL |
C.滴入0~25mL盐酸,溶液中的离子方程式为 |
D.所得溶液的溶质各成分的物质的量之比为 |
您最近一年使用:0次
7 . 上世纪30~40年代,侯德榜率技术团队突破外国公司垄断的索维尔制碱法的生成工艺,另辟蹊径,发明了侯氏联合制碱法,开创了世界制碱工业的新纪元。已知侯氏制碱法的主要原理为:
a. NaCl + NH3 + H2O + CO2 = NH4Cl + NaHCO3↓
b.2NaHCO3 Na2CO3 + CO2↑+ H2O
Na2CO3 + CO2↑+ H2O
(1)如图是某化学兴趣小组模拟“侯氏制碱法”制取NaHCO3的部分装置。为了提高CO2的利用率,须先向___________ (填“a”或“b”)管通入NH3,装置c中的试剂为___________ (填“碱石灰”“浓硫酸” 或“无水氯化钙”)。

(2)实验室给该兴趣小组提供了一份Na2CO3样品,为测定其纯度,小组成员设计了如下实验装置: B装置中盛有m1g碳酸钠样品( 假设杂质不参加反应,原装置中的CO2含量忽略不计,忽略CO2的溶解,各装置内反应完全)。实验室可供选择的试剂和药品还有Zn粒、稀硫酸、稀盐酸、CaCO3(s)。
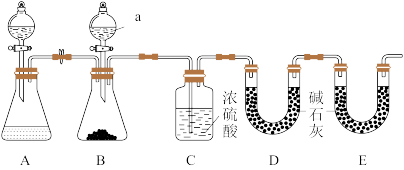
①仪器a的名称是___________ ,仪器a中所盛放的最佳试剂为___________ ,原因是___________ 。
②装置A的作用是___________ 。
③装置B中发生反应的离子方程式为___________ 。
④若无装置E,实验测定结果将___________ (填“偏高”“偏低”或“不变”),其原因是___________ 。若实验后,装置D增重m2g,则该碳酸钠样品的质量分数为___________ (用含m1、m2的代数式表示)。
a. NaCl + NH3 + H2O + CO2 = NH4Cl + NaHCO3↓
b.2NaHCO3
 Na2CO3 + CO2↑+ H2O
Na2CO3 + CO2↑+ H2O(1)如图是某化学兴趣小组模拟“侯氏制碱法”制取NaHCO3的部分装置。为了提高CO2的利用率,须先向

(2)实验室给该兴趣小组提供了一份Na2CO3样品,为测定其纯度,小组成员设计了如下实验装置: B装置中盛有m1g碳酸钠样品( 假设杂质不参加反应,原装置中的CO2含量忽略不计,忽略CO2的溶解,各装置内反应完全)。实验室可供选择的试剂和药品还有Zn粒、稀硫酸、稀盐酸、CaCO3(s)。

①仪器a的名称是
②装置A的作用是
③装置B中发生反应的离子方程式为
④若无装置E,实验测定结果将
您最近一年使用:0次
名校
8 . 某碳酸钾和碳酸氢钾组成的混合物样品61.4 g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到如图所示的曲线。下列说法不正确的是


| A.该过程所发生反应的化学方程式:K2CO3+HCl =KCl+KHCO3;KHCO3+HCl=KCl+H2O+CO2↑ |
| B.混合物样品中含碳酸钾20.0g |
| C.混合物中碳元素的质量分数为9. 77% |
| D.若将61.4 g原混合物样品充分加热,放出CO2的质量为4.40g |
您最近一年使用:0次
2022-06-15更新
|
1266次组卷
|
4卷引用:新疆维吾尔自治区2022届高三第二次适应性检测理科综合化学试题
新疆维吾尔自治区2022届高三第二次适应性检测理科综合化学试题(已下线)第三章 金属及其化合物(测)-2023年高考化学一轮复习讲练测(全国通用)辽宁省沈阳市东北育才学校高三上学期10月第一次模拟考试化学试题新疆维吾尔自治区塔城市第三中学2022-2023学年高一上学期11月期中化学试题
名校
解题方法
9 . 取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol·L-1的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液体积之间的关系如图所示。下列有关说法正确的是


| A.A溶液中溶质为Na2CO3和NaHCO3 |
| B.BC段对应离子方程式为OH-+H+=H2O |
| C.通入CO2气体在标况下的体积为56mL |
| D.原NaOH溶液物质的量浓度为0.065mol·L-1 |
您最近一年使用:0次
2022-01-14更新
|
653次组卷
|
3卷引用:浙江省东阳市横店高级中学2022-2023学年高三上学期10月份检测化学试题
10 . 某同学在两个相同的特制容器中分别加入20mL0.4mol·L-1Na2CO3溶液和40mL0.2mol·L-1NaHCO3溶液,再分别用0.4mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如图曲线:
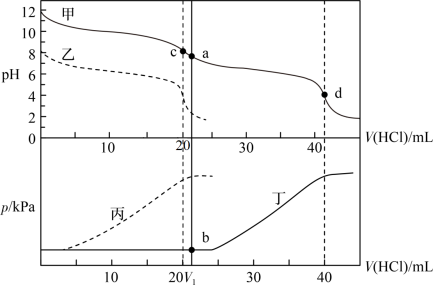
下列说法正确的的是

下列说法正确的的是
| A.图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸 |
B.当滴加盐酸的体积为V1mL时(a点、b点),所发生的反应用离子方程式表示为:HCO +H+=CO2↑+H2O +H+=CO2↑+H2O |
| C.根据pH—V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点 |
D.Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(CO )=c(OH-)-c(H+) )=c(OH-)-c(H+) |
您最近一年使用:0次
2022-01-12更新
|
9191次组卷
|
24卷引用:2022 年1月浙江省普通高校招生选考科目考试化学试题
2022 年1月浙江省普通高校招生选考科目考试化学试题(已下线)卷09 水溶液中的离子平衡-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)天津市第一中学2021-2022学年高三下学期4月月考化学试题(已下线)2022年浙江1月高考真题变式题(21-25)(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第32练 盐类的水解-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第25讲 盐类水解(练)-2023年高考化学一轮复习讲练测(全国通用)湖南省怀化市沅陵县第一中学2022届高三下学期第四次模拟考试化学试题(已下线)第22讲 水的电离与溶液的pH(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题41 水溶液中的三大守恒和浓度大小比较-备战2023年高考化学一轮复习考点微专题上海市七宝中学2022-2023学年高三上学期9月月考化学试题(已下线)专题06 水溶液中的离子平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)题型133 酸碱中和滴定实验及误差分析(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)湖南省株洲南方中学2022-2023学年高二上学期期中考试化学试题(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)章末检测卷(三) 水溶液中的离子反应与平衡第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 第2课时 酸碱中和滴定



