名校
1 . 某兴趣小组同学制定如下三个方案对含有NaCl杂质的碳酸氢钠的含量进行测定:
方案一:用如图装置测定样品与足量酸反应生成CO2的体积。

(1)若实验测得样品中小苏打含量低于样品实际含量,可能的原因是 ___________。
方案二:测定上述样品中碳酸氢钠的质量分数还可通过如图装置进行测定。
(2)写出涉及的化学方程式__________ 。
(3)实际操作中还需要用到_______ (填仪器名称)。
方案三:通过以下流程测定样品中碳酸氢钠的含量。

(4)操作Ⅰ的名称为___________ ,根据以上实验过程,含有氯化钠的碳酸氢钠样品中碳酸氢钠的质量分数可表示为:___________ 。(样品为m1g,恒重后固体质量为m2g)
方案一:用如图装置测定样品与足量酸反应生成CO2的体积。

(1)若实验测得样品中小苏打含量低于样品实际含量,可能的原因是 ___________。
| A.CO2气体中含有水蒸气 | B.测定气体体积时未冷却至室温 |
| C.Y型管中留有反应生成的气体 | D.测定气体体积时水准管的液面高于量气管的液面 |
方案二:测定上述样品中碳酸氢钠的质量分数还可通过如图装置进行测定。

(2)写出涉及的化学方程式
(3)实际操作中还需要用到
方案三:通过以下流程测定样品中碳酸氢钠的含量。

(4)操作Ⅰ的名称为
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为_______ 。
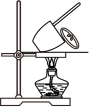
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 Na2CO3的含量。
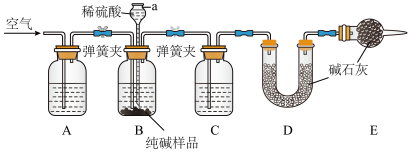
(2)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若_______ ,说明装置不漏气。
(3)装置A中的试剂为_______ ,装置C中的试剂为_______ 。装置E的作用是_______ 。
(4)实验前称取28.80 g样品,实验后测得D装置增重8.80 g,则样品中Na2CO3的质量分数为_______ (保留一位小数);若缺少E装置,会使测定结果_______ (填“偏高”或“偏低”)。

已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 Na2CO3的含量。

(2)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若
(3)装置A中的试剂为
(4)实验前称取28.80 g样品,实验后测得D装置增重8.80 g,则样品中Na2CO3的质量分数为
您最近一年使用:0次
2023-11-26更新
|
222次组卷
|
3卷引用:山西省实验中学2023-2024学年高一上学期期中考试化学试题
3 . Ⅰ.现代工业常以NaCl为原料制备纯碱,部分工艺流程如图:
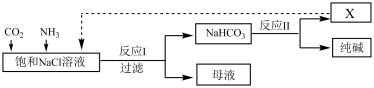
(1)产物X为_______________ (填化学式)。
(2)反应Ⅰ的化学方程式为________________________________________ 。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。其中碱石灰的主要成分为氧化钙和氢氧化钠。

(3)装置a的仪器名称是_____________ ,装置①中X试剂的作用为_____________ 。
(4)若装置③中Ba(OH)2不足,则该装置中发生反应的离子方程式为_____________ 。
(5)实验结束后继续通入空气的目的是_________________________________ 。
(6)实验前称取25.0 g样品,③中产生BaCO3质量为39.4 g,则样品中Na2CO3的质量分数为__________ (保留小数点后一位);若缺少④装置,会使测定结果__________ (填“偏高”或“偏低”)。

(1)产物X为
(2)反应Ⅰ的化学方程式为
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。其中碱石灰的主要成分为氧化钙和氢氧化钠。

(3)装置a的仪器名称是
(4)若装置③中Ba(OH)2不足,则该装置中发生反应的离子方程式为
(5)实验结束后继续通入空气的目的是
(6)实验前称取25.0 g样品,③中产生BaCO3质量为39.4 g,则样品中Na2CO3的质量分数为
您最近一年使用:0次
4 . 碳酸钠和碳酸氢钠是生活中比较常见的两种物质。某学校的课外化学学习兴趣小组对两者性质进行探究,并测定碳酸钠和碳酸氢钠混合物中各成分的含量。
实验I:
(1)取两支试管分别加入各约1g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是_______ (填化学式,下同)。
(2)继续向两支试管中分别加入10mL水,充分振荡,最先溶解完全的是_______ ;再分别加入几滴酚酞试液,溶液变红,但颜色较浅的是_______ 。
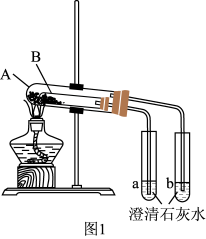
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后,接下来的操作是_______ ,再往试管中添加药品,则试管A中盛放的药品是_______ ,澄清石灰水变浑浊的是_______ (填“a”或“b”)。
实验III:混合物中碳酸钠含量的测定
(4)为确定碳酸钠和碳酸氢钠混合物样品的组成,甲化学探究小组设计实验1:利用如图2所示的装置进行实验。
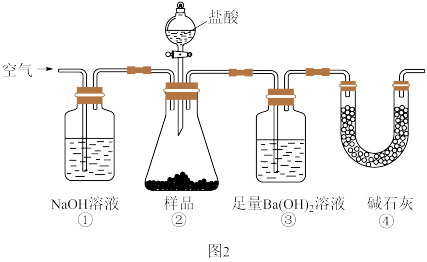
下列说法错误的是_______(填字母,单选)。
(5)乙化学探究小组设计实验2:取ag样品加热、冷却、称重,重复以上操作至样品固体质量不再变化,称量其质量为bg。样品中 质量分数为
质量分数为_______ ×100%(用a、b表示)。
(6)丙化学探究小组设计实验3:步骤ⅰ。称取一定量的混合物样品;步骤ⅱ。向其中逐滴滴入0.1000mol/L稀盐酸,记录生成的气体体积和滴入盐酸体积,如图3所示。
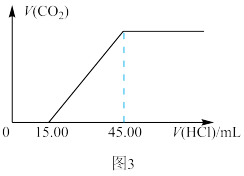
计算:①生成的 在标况下的体积为
在标况下的体积为_______ mL;
②该混合物中 的质量分数
的质量分数_______ %(保留两位小数)。
实验I:
(1)取两支试管分别加入各约1g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是
(2)继续向两支试管中分别加入10mL水,充分振荡,最先溶解完全的是
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后,接下来的操作是

实验III:混合物中碳酸钠含量的测定
(4)为确定碳酸钠和碳酸氢钠混合物样品的组成,甲化学探究小组设计实验1:利用如图2所示的装置进行实验。

下列说法错误的是_______(填字母,单选)。
A.滴入盐酸前,应先将装置中含有 的空气排尽 的空气排尽 |
B.装置①、④的作用是防止空气中的 进入装置③中 进入装置③中 |
C.在装置②、③间需添加盛有饱和 溶液的洗气瓶,以除去挥发的HCl气体 溶液的洗气瓶,以除去挥发的HCl气体 |
D.反应结束时,应继续通入空气将装置②中的 转移到装置③中 转移到装置③中 |
 质量分数为
质量分数为(6)丙化学探究小组设计实验3:步骤ⅰ。称取一定量的混合物样品;步骤ⅱ。向其中逐滴滴入0.1000mol/L稀盐酸,记录生成的气体体积和滴入盐酸体积,如图3所示。

计算:①生成的
 在标况下的体积为
在标况下的体积为②该混合物中
 的质量分数
的质量分数
您最近一年使用:0次
名校
解题方法
5 . 测定某样品中小苏打(主要成分为 )的含量有多种方法。
)的含量有多种方法。
I.重量法:
(1)某小组欲通过加热样品以测定小苏打的含量,化学方程式为:_________________ ;
为了测定某发酵剂样品中碳酸氢钠的含量,取样品ng,充分灼烧以后,称得残留固体质量为mg(假设其他成分不分解)。则样品中碳酸氢钠的含量:______________ (填含n、m的计算式)。
(2)另一化学兴趣小组的同学用重量法测定某品牌小苏打中 的质量分数,进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生汽泡为止,测得的有关数据如下表所示。
的质量分数,进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生汽泡为止,测得的有关数据如下表所示。
生成 的质量为
的质量为__________ :样品中的 的质量分数
的质量分数__________ (以小数点表示,保留小数点后3位)。
II.量气法:
(3)通过测得__________ 的体积,从而通过换算求得小苏打的含量。
方案II的装置如图所示(在标准状况下):

操作步骤:.
①使A和B液面相平,记录A的液面位置 ;
;
②待烧瓶中不再有气体产生并恢复至室温后,使A和B液面相平;
③再次记录A的液面位置 ;
;
④将足量试剂Y和样品加入Y型管中;
⑤检查装置气密性;
⑥倾斜Y形管,使样品全部进入样品的支管中反应;
⑦将A和B错开高度固定在滴定管夹上,从B中注入一定量的水在0至100mL之间。
(4)该实验的操作顺序是__________ (用序号表示)。
(5)A装置的名称是__________ ,B装置的名称是__________ 。
(6)有同学认为试剂Y选用稀盐酸不够好,你认为可能的原因是:__________ 。
(7)用图所示实验装置测定气体摩尔体积,相关叙述正确的是__________ (填字母)。
a.用 代替水,测得二氧化碳的体积更准确
代替水,测得二氧化碳的体积更准确
b.A压入B的水过多而溢出,会导致测定失败
c.不一定需要体系温度降低到室温也可进行读数
d.上提水准管,量气管液面高度不断改变,说明装置漏气
 )的含量有多种方法。
)的含量有多种方法。I.重量法:
(1)某小组欲通过加热样品以测定小苏打的含量,化学方程式为:
为了测定某发酵剂样品中碳酸氢钠的含量,取样品ng,充分灼烧以后,称得残留固体质量为mg(假设其他成分不分解)。则样品中碳酸氢钠的含量:
(2)另一化学兴趣小组的同学用重量法测定某品牌小苏打中
 的质量分数,进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生汽泡为止,测得的有关数据如下表所示。
的质量分数,进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生汽泡为止,测得的有关数据如下表所示。| 物质 | 样品 | 消耗的稀盐酸 | 反应后的溶液 |
| 质量(g) | 4.5g | 37.7g | 40g |
 的质量为
的质量为 的质量分数
的质量分数II.量气法:
(3)通过测得
方案II的装置如图所示(在标准状况下):

操作步骤:.
①使A和B液面相平,记录A的液面位置
 ;
;②待烧瓶中不再有气体产生并恢复至室温后,使A和B液面相平;
③再次记录A的液面位置
 ;
;④将足量试剂Y和样品加入Y型管中;
⑤检查装置气密性;
⑥倾斜Y形管,使样品全部进入样品的支管中反应;
⑦将A和B错开高度固定在滴定管夹上,从B中注入一定量的水在0至100mL之间。
(4)该实验的操作顺序是
(5)A装置的名称是
(6)有同学认为试剂Y选用稀盐酸不够好,你认为可能的原因是:
(7)用图所示实验装置测定气体摩尔体积,相关叙述正确的是
a.用
 代替水,测得二氧化碳的体积更准确
代替水,测得二氧化碳的体积更准确b.A压入B的水过多而溢出,会导致测定失败
c.不一定需要体系温度降低到室温也可进行读数
d.上提水准管,量气管液面高度不断改变,说明装置漏气
您最近一年使用:0次
名校
解题方法
6 . I.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

已知NaHCO3在低温下溶解度较小。
(1)反应I的化学方程式为_____________________________________________ 。
(2)反应II的化学方程式为________________ 。
II.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。

(3)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若_________________________ ,说明装置不漏气。
(4)装置A中的试剂为_______________ ,装置C中的试剂为______________ 。
(5)实验结束后通入空气的目的:______________________________________ 。
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为_________ (保留小数点后一位);若缺少E装置,会使测定结果____________ (填“偏高”或“偏低”)。

已知NaHCO3在低温下溶解度较小。
(1)反应I的化学方程式为
(2)反应II的化学方程式为
II.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。

(3)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若
(4)装置A中的试剂为
(5)实验结束后通入空气的目的:
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为
您最近一年使用:0次
2021-11-26更新
|
568次组卷
|
3卷引用:山西省运城市2021-2022学年高一上学期11月期中检测化学试题
名校
解题方法
7 . 有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,实验班的某同学设计如图实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。(提示固体干燥剂主要有:碱石灰、无水CaCl2、P2O5等)
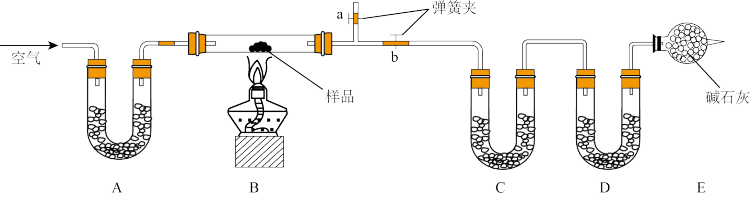
(1)装置A、C中盛放的试剂分别为A__ ,C___ 。
(2)E装置的作用是__ ,若无该装置,则测定结果中NaHCO3的含量将___ (填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将___ 。
(3)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3质量分数为___ (用含w、m1g、m2g的代数式表示)

(1)装置A、C中盛放的试剂分别为A
(2)E装置的作用是
(3)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3质量分数为
您最近一年使用:0次
解题方法
8 . I.为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置。实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部。预热后在大试管底部加热。
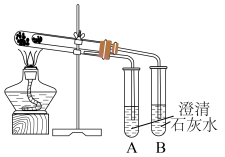
回答下列问题:
(1)小试管中放置___________ 药品(填化学名称)。
(2)开始加热一段时间后,试管___________ (填“A”或“B”)中会出现浑浊现象。实验现象证明,加热条件下,Na2CO3比NaHCO3更___________ (填“稳定”或“不稳定”)。
II.为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下,请回答:
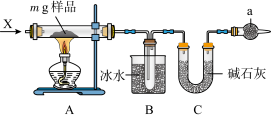
(3)仪器a的名称是___________ 。
(4)装置B中冰水的作用是___________ 。
(5)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是___________。

回答下列问题:
(1)小试管中放置
(2)开始加热一段时间后,试管
II.为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下,请回答:

(3)仪器a的名称是
(4)装置B中冰水的作用是
(5)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是___________。
| A.样品分解不完全 |
| B.装置B、C之间缺少CO2的干燥装置 |
| C.产生CO2气体的速率太快,没有被碱石灰完全吸收 |
| D.反应完全后停止加热,通入过量的空气 |
您最近一年使用:0次
名校
9 . 现有一不纯的小苏打样品(含杂质 、
、 ),为测定
),为测定 的质量分数,设计如图所示的实验装置(夹持仪器未画出)。
的质量分数,设计如图所示的实验装置(夹持仪器未画出)。
说明:碱石灰为 、
、 的混合物,常用作干燥剂,也可以吸收
的混合物,常用作干燥剂,也可以吸收 气体。
气体。

实验步骤如下:
①按图组装好实验装置并检查气密性。
②称取一定质量的样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞 、
、 ,关闭
,关闭 ,缓缓鼓入空气数分钟。
,缓缓鼓入空气数分钟。
④关闭活塞 、
、 ,打开
,打开 ,点燃酒精灯加热至不再产生气体。
,点燃酒精灯加热至不再产生气体。
⑤打开活塞 ,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。
,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。
回答下列问题:
(1)仪器E的名称是___________ ,其中盛放的药品是___________ ;若无该装置,则会导致测得的 的质量分数
的质量分数__________ 。(填“偏大”“偏小”或“无影响”)
(2)步骤③的目的是_____________________________________________________ 。
(3)装置B中发生反应的化学方程式为___________________ ,________________ 。
(4)若实验中称取样品的质量为50.0g,反应后C、D装置增加的质量分别为12.6g、8.8g,则混合物中 的质量分数为
的质量分数为________ ,杂质 的质量为
的质量为________ g。
 、
、 ),为测定
),为测定 的质量分数,设计如图所示的实验装置(夹持仪器未画出)。
的质量分数,设计如图所示的实验装置(夹持仪器未画出)。说明:碱石灰为
 、
、 的混合物,常用作干燥剂,也可以吸收
的混合物,常用作干燥剂,也可以吸收 气体。
气体。
实验步骤如下:
①按图组装好实验装置并检查气密性。
②称取一定质量的样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞
 、
、 ,关闭
,关闭 ,缓缓鼓入空气数分钟。
,缓缓鼓入空气数分钟。④关闭活塞
 、
、 ,打开
,打开 ,点燃酒精灯加热至不再产生气体。
,点燃酒精灯加热至不再产生气体。⑤打开活塞
 ,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。
,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。回答下列问题:
(1)仪器E的名称是
 的质量分数
的质量分数(2)步骤③的目的是
(3)装置B中发生反应的化学方程式为
(4)若实验中称取样品的质量为50.0g,反应后C、D装置增加的质量分别为12.6g、8.8g,则混合物中
 的质量分数为
的质量分数为 的质量为
的质量为
您最近一年使用:0次
名校
解题方法
10 . 钠及其化合物的生产、应用,是化工生产与研究的重要组成部分。
Ⅰ.Na2O2用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备Na2O2并检验其纯度的实验流程如图所示。回答下列问题:

(1)生成Na2O2的化学方程式是___________ ,其中Na2O2是___________ (填“氧化产物”或“还原产物”或“既是氧化产物又是还原产物”)。
(2)向Na2O2样品中加水溶解的离子方程式为___________ 。
(3)样液中加入MnO2后产生能使带火星木条复燃的气体,则说明Na2O2与水反应的过程中还生成了___________ (化学式)。
(4)滤液中加入BaCl2溶液产生白色沉淀,说明熔融Na与空气反应生成的Na2O2样品中含有___________ 杂质。
Ⅱ.侯氏制碱法生产纯碱的主要流程如图所示:
(5)请结合流程图判断下列说法正确的是___________。
(6)若有ag的NaHCO3和Na2CO3固体混合物,充分加热后质量减少到bg,则混合物中Na2CO3的质量分数为___________ 。
Ⅰ.Na2O2用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备Na2O2并检验其纯度的实验流程如图所示。回答下列问题:

(1)生成Na2O2的化学方程式是
(2)向Na2O2样品中加水溶解的离子方程式为
(3)样液中加入MnO2后产生能使带火星木条复燃的气体,则说明Na2O2与水反应的过程中还生成了
(4)滤液中加入BaCl2溶液产生白色沉淀,说明熔融Na与空气反应生成的Na2O2样品中含有
Ⅱ.侯氏制碱法生产纯碱的主要流程如图所示:

(5)请结合流程图判断下列说法正确的是___________。
| A.该流程中未涉及氧化还原反应 |
| B.该流程中可以循环利用的物质为CO2 |
| C.该流程中步骤①和②可以调整顺序 |
| D.③“加热”说明纯碱的热稳定性低于NaHCO3 |
(6)若有ag的NaHCO3和Na2CO3固体混合物,充分加热后质量减少到bg,则混合物中Na2CO3的质量分数为
您最近一年使用:0次



