名校
解题方法
1 . 钠及其化合物的生产、应用,是化工生产与研究的重要组成部分。
Ⅰ.Na2O2用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备Na2O2并检验其纯度的实验流程如图所示。回答下列问题:

(1)生成Na2O2的化学方程式是___________ ,其中Na2O2是___________ (填“氧化产物”或“还原产物”或“既是氧化产物又是还原产物”)。
(2)向Na2O2样品中加水溶解的离子方程式为___________ 。
(3)样液中加入MnO2后产生能使带火星木条复燃的气体,则说明Na2O2与水反应的过程中还生成了___________ (化学式)。
(4)滤液中加入BaCl2溶液产生白色沉淀,说明熔融Na与空气反应生成的Na2O2样品中含有___________ 杂质。
Ⅱ.侯氏制碱法生产纯碱的主要流程如图所示:
(5)请结合流程图判断下列说法正确的是___________。
(6)若有ag的NaHCO3和Na2CO3固体混合物,充分加热后质量减少到bg,则混合物中Na2CO3的质量分数为___________ 。
Ⅰ.Na2O2用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备Na2O2并检验其纯度的实验流程如图所示。回答下列问题:

(1)生成Na2O2的化学方程式是
(2)向Na2O2样品中加水溶解的离子方程式为
(3)样液中加入MnO2后产生能使带火星木条复燃的气体,则说明Na2O2与水反应的过程中还生成了
(4)滤液中加入BaCl2溶液产生白色沉淀,说明熔融Na与空气反应生成的Na2O2样品中含有
Ⅱ.侯氏制碱法生产纯碱的主要流程如图所示:

(5)请结合流程图判断下列说法正确的是___________。
| A.该流程中未涉及氧化还原反应 |
| B.该流程中可以循环利用的物质为CO2 |
| C.该流程中步骤①和②可以调整顺序 |
| D.③“加热”说明纯碱的热稳定性低于NaHCO3 |
(6)若有ag的NaHCO3和Na2CO3固体混合物,充分加热后质量减少到bg,则混合物中Na2CO3的质量分数为
您最近一年使用:0次
2 . Ⅰ.现代工业常以NaCl为原料制备纯碱,部分工艺流程如图:
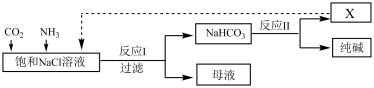
(1)产物X为_______________ (填化学式)。
(2)反应Ⅰ的化学方程式为________________________________________ 。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。其中碱石灰的主要成分为氧化钙和氢氧化钠。

(3)装置a的仪器名称是_____________ ,装置①中X试剂的作用为_____________ 。
(4)若装置③中Ba(OH)2不足,则该装置中发生反应的离子方程式为_____________ 。
(5)实验结束后继续通入空气的目的是_________________________________ 。
(6)实验前称取25.0 g样品,③中产生BaCO3质量为39.4 g,则样品中Na2CO3的质量分数为__________ (保留小数点后一位);若缺少④装置,会使测定结果__________ (填“偏高”或“偏低”)。

(1)产物X为
(2)反应Ⅰ的化学方程式为
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。其中碱石灰的主要成分为氧化钙和氢氧化钠。

(3)装置a的仪器名称是
(4)若装置③中Ba(OH)2不足,则该装置中发生反应的离子方程式为
(5)实验结束后继续通入空气的目的是
(6)实验前称取25.0 g样品,③中产生BaCO3质量为39.4 g,则样品中Na2CO3的质量分数为
您最近一年使用:0次
名校
解题方法
3 . 膨松剂在面包制作过程中发生反应产生气体,使面包变得松软。已知某膨松剂含碳酸氢钠、碳酸氢铵中的一种或两种,化学兴趣小组对该膨松剂进行如下探究:
【查阅资料】:碱石灰不与氨气反应,常用于吸收水蒸气和二氧化碳;常用浓硫酸吸收氨气。
实验一:检验膨松剂成分
在玻璃管中加入该膨松剂,按下图连接好装置(铁架台略去,下同)。点燃酒精灯:
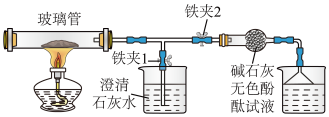
(1)关闭铁夹2,打开铁夹1,观察到现象:___________ ,说明产物中有二氧化碳;
(2)打开铁夹2,关闭铁夹1,观察到的现象:___________ ,说明产物中有氨气;
(3)充分加热后,玻璃管中仍有固体,结论:该膨松剂的成分是___________ (化学式)。
实验二:测定膨松剂受热产生气体的量
用下图装置测定该膨松剂样品产生的二氧化碳气体的质量(整套装置气密性良好,各装置中气体吸收剂足量)
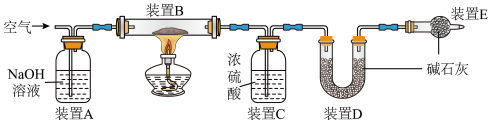
(4)将8g膨松剂装入装置B中,通过测定实验前后装置___________ (填字母序号)的质量,其质量差即为样品产生的二氧化碳气体的质量。加热前,先对已连接好的装置A、B和C通一段时间的空气,再连接上装置D、E;加热过程中,装置C的作用是___________ ;停止加热后,应继续通入空气一段时间的目的是___________ 。
(5)测定氨气的质量:将上图装置中___________ (填字母)的连接顺序对调。另取8g膨松剂装入装置B中,通过测定实验前后装置C的质量,其质量差即为样品产生的氨气的质量。
【解释与结论】同学们进一步对实验结果进行分析后,认为该膨松剂质量良好。
【反思与评价】实验II中,若没有装置E,造成测定结果可能会___________ (填“偏大”、“不变”或“偏小”)
【查阅资料】:碱石灰不与氨气反应,常用于吸收水蒸气和二氧化碳;常用浓硫酸吸收氨气。
实验一:检验膨松剂成分
在玻璃管中加入该膨松剂,按下图连接好装置(铁架台略去,下同)。点燃酒精灯:

(1)关闭铁夹2,打开铁夹1,观察到现象:
(2)打开铁夹2,关闭铁夹1,观察到的现象:
(3)充分加热后,玻璃管中仍有固体,结论:该膨松剂的成分是
实验二:测定膨松剂受热产生气体的量
用下图装置测定该膨松剂样品产生的二氧化碳气体的质量(整套装置气密性良好,各装置中气体吸收剂足量)

(4)将8g膨松剂装入装置B中,通过测定实验前后装置
(5)测定氨气的质量:将上图装置中
【解释与结论】同学们进一步对实验结果进行分析后,认为该膨松剂质量良好。
【反思与评价】实验II中,若没有装置E,造成测定结果可能会
您最近一年使用:0次
2021-01-01更新
|
356次组卷
|
2卷引用:山东省青岛第五十八中学2020-2021学年高一上学期期中考试化学试题
名校
4 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。
(1)装置甲中反应的离子方程式 为_________ ;装置乙的作用是_________ ,反应的化学方程式为________ 。
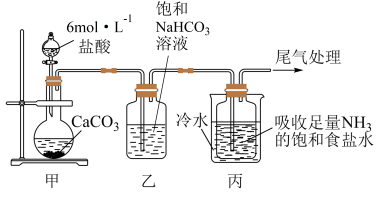
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的离子方程式为__________ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有__________ 、洗涤固体、__________ ,最后一步发生反应的化学方程式为_______________ 。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

(5)测定该纯碱样品的纯度:称取m1g样品,置于试管中,充分加热,得到固体的质量为m2 g。则该纯碱样品的纯度为_______ 。(填字母代号)
A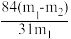 B
B 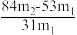 C
C  D
D 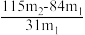
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。
(1)装置甲中反应的

(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的离子方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

| 选择的装置(填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
A
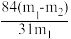 B
B 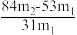 C
C  D
D 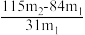
您最近一年使用:0次
真题
5 . 碳酸氢钠俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。
(1)某碳酸氢钠样品中含有少量氯化钠。称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸____________ mL(保留两位小数)。
(2)某溶液组成如表一:
问该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二:
计算析出的碳酸氢钠晶体的质量(保留1位小数)。____________
(3)将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留1位小数)。____________
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg。通过计算确定该晶体的化学式____________
(1)某碳酸氢钠样品中含有少量氯化钠。称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸
(2)某溶液组成如表一:
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 814.8 | 400.3 | 97.3 |
问该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二:
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 137.7 | 428.8 | 97.3 |
计算析出的碳酸氢钠晶体的质量(保留1位小数)。
(3)将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留1位小数)。
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg。通过计算确定该晶体的化学式
您最近一年使用:0次
2016-12-09更新
|
1512次组卷
|
2卷引用:上海市静安区彭浦高级中学2017-2018学年高三上学期期中考试化学试题



