解题方法
1 . 加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,则混合物中碳酸钠的质量分数
| A.42% | B.58% | C.29% | D.50% |
您最近一年使用:0次
2022-09-19更新
|
288次组卷
|
3卷引用:黑龙江省齐齐市拜泉县第一中学2021-2022学年高一上学期期中考试化学试题
黑龙江省齐齐市拜泉县第一中学2021-2022学年高一上学期期中考试化学试题广东省惠州市博罗县2022-2023学年高一上学期期中考试化学试题(已下线)【2022】【高一上】【期中考】【杭九】【高中化学】【赵优萍收集】
2022高三·全国·专题练习
名校
解题方法
2 . 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示。

下列判断正确的是

下列判断正确的是
| A.原NaOH溶液的浓度为0.2mol•L-1 |
| B.通入的CO2在标准状况下的体积为448mL |
| C.所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3 |
| D.所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶2 |
您最近一年使用:0次
2022-08-26更新
|
286次组卷
|
8卷引用:黑龙江省牡丹江市第一高级中学2022-2023学年高一上学期11月期中考试化学试题
黑龙江省牡丹江市第一高级中学2022-2023学年高一上学期11月期中考试化学试题黑龙江省七台河市勃利县高级中学2023-2024学年高三上学期9月月考化学试题(已下线)第04练 钠及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第06讲 钠及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)天津市新华中学2022-2023学年高三上学期学科练习(一)化学试题江西省丰城中学2022-2023学年高三上学期月考化学试题云南省富宁县第一中学2021-2022学年高一下学期开学考试化学试题湖北省武汉海淀外国语实验学校2022-2023学年高三上学期10月月考化学试题
名校
解题方法
3 . 下列说法正确的是
①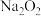 投入到紫色石蕊试液中,溶液先变蓝,后褪色;
投入到紫色石蕊试液中,溶液先变蓝,后褪色;
②质量相等的 与
与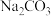 分别与足量相同浓度盐酸完全反应时,产生
分别与足量相同浓度盐酸完全反应时,产生 的物质的量相等;
的物质的量相等;
③取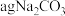 和
和 混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定
混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定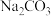 和
和 混合物中
混合物中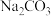 质量分数;
质量分数;
④区别 与
与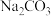 溶液,可用
溶液,可用 溶液;
溶液;
⑤ 固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
⑥ 粉末中混有
粉末中混有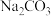 ,可配制成溶液通入过量的
,可配制成溶液通入过量的 ,再低温结晶提纯得到。
,再低温结晶提纯得到。
①
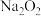 投入到紫色石蕊试液中,溶液先变蓝,后褪色;
投入到紫色石蕊试液中,溶液先变蓝,后褪色;②质量相等的
 与
与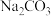 分别与足量相同浓度盐酸完全反应时,产生
分别与足量相同浓度盐酸完全反应时,产生 的物质的量相等;
的物质的量相等;③取
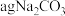 和
和 混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定
混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定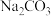 和
和 混合物中
混合物中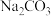 质量分数;
质量分数;④区别
 与
与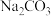 溶液,可用
溶液,可用 溶液;
溶液;⑤
 固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
固体可以做干粉灭火剂,金属钠起火可以用它来灭火;⑥
 粉末中混有
粉末中混有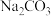 ,可配制成溶液通入过量的
,可配制成溶液通入过量的 ,再低温结晶提纯得到。
,再低温结晶提纯得到。| A.②④ | B.②⑤ | C.①⑥ | D.③④ |
您最近一年使用:0次
2022-08-25更新
|
251次组卷
|
15卷引用:黑龙江省饶河县高级中学2021-2022学年高一上学期期中考试化学试题
黑龙江省饶河县高级中学2021-2022学年高一上学期期中考试化学试题黑龙江省鹤岗市第一中学2022-2023学年高一上学期11月期中化学试题安徽省蚌埠市第二中学2020-2021学年高一上学期期中考试化学(理科)试题湖北省沙市中学2021-2022学年高一上学期期中考试化学试题天津市耀华中学2021-2022学年高一上学期期中考试化学试题(已下线)必考点07 钠盐及焰色试验-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)甘肃省兰州市西北师范大学附属中学2022-2023学年高三上学期期中考试化学试题天津市第二十中学2023-2024学年高一上学期期中考试化学试题河南省镇平县第一高级中学2020-2021学年高一上学期第二次月考化学试题(已下线)第08练 钠及其化合物-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)(已下线)衔接点15 钠的化合物-2022年初升高化学无忧衔接?江西省宜春市万载中学2021-2022学年高一上学期第三次月考化学试题山东省威海乳山市银滩高级中学2022-2023学年高一10月第二次考试化学试题江西省丰城中学2023-2024学年高三上学期开学考试化学试题新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题
名校
4 . 下列试验方案中,不能测定出Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是
| A.取ag混合物充分加热,质量减少bg |
| B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体 |
| C.取ag混合物与足量CaCl2溶液反应,过滤、洗涤、烘干得到bg固体 |
| D.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加bg |
您最近一年使用:0次
2021-12-04更新
|
1011次组卷
|
7卷引用:黑龙江省鹤岗市第一中学2022-2023学年高一上学期11月期中化学试题
黑龙江省鹤岗市第一中学2022-2023学年高一上学期11月期中化学试题湖南省石门县第一中学2021-2022学年高一上学期期中段考化学试题宁夏回族自治区银川一中2023-2024学年高一上学期期中考试化学试题(已下线)专题36 碳酸钠质量分数测定的实验探究-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)江西省宜春市铜鼓中学2021-2022学年高一下学期开学考化学试题陕西省西安中学 2023 届高三上学期第二次质量检测化学试题河南省顶级名校2023届高三上学期10月月考化学试题
名校
5 . 纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
(1)实验室中需0.2mol/L的 溶液980mL,配制时应选用容量瓶的规格和称取
溶液980mL,配制时应选用容量瓶的规格和称取 的质量分别是_______。
的质量分别是_______。
(2)碳酸钠和碳酸氢钠的鉴别与稳定性探究。
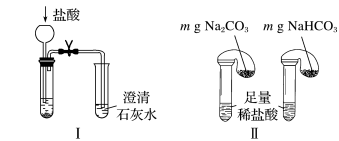
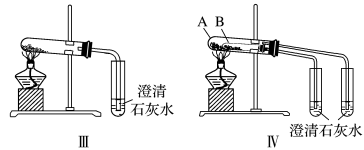
①只根据图Ⅰ、Ⅱ所示实验,能够达到鉴别目的的是_______ (填装置序号)。
②图Ⅲ、Ⅳ中_______ 能更好说明二者的稳定性(填装置序号)。Ⅳ中受热处发生反应的化学方程式:_______ 。
(3)利用图Ⅲ的装置加热 和
和 的混合物,剩余固体成分会随二者物质的量不同而发生变化。当
的混合物,剩余固体成分会随二者物质的量不同而发生变化。当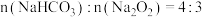 充分混合后,加热至完全反应,试管内剩余的固体是
充分混合后,加热至完全反应,试管内剩余的固体是_______ (填化学式)。
(1)实验室中需0.2mol/L的
 溶液980mL,配制时应选用容量瓶的规格和称取
溶液980mL,配制时应选用容量瓶的规格和称取 的质量分别是_______。
的质量分别是_______。| A.500mL;21.2g | B.900mL;20.1g | C.1000mL;20.1g | D.1000mL;21.2g |


①只根据图Ⅰ、Ⅱ所示实验,能够达到鉴别目的的是
②图Ⅲ、Ⅳ中
(3)利用图Ⅲ的装置加热
 和
和 的混合物,剩余固体成分会随二者物质的量不同而发生变化。当
的混合物,剩余固体成分会随二者物质的量不同而发生变化。当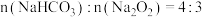 充分混合后,加热至完全反应,试管内剩余的固体是
充分混合后,加热至完全反应,试管内剩余的固体是
您最近一年使用:0次
2021-12-02更新
|
446次组卷
|
2卷引用:黑龙江省大庆实验中学2021-2022学年高一上学期期中考试化学试题
名校
6 . 将一定物质的量的 、
、 组成的混合物溶于水配成1L溶液,取出50mL溶液,然后滴加一定物质的量浓度的盐酸与它反应,得到的图象如图所示。下列说法错误的是
组成的混合物溶于水配成1L溶液,取出50mL溶液,然后滴加一定物质的量浓度的盐酸与它反应,得到的图象如图所示。下列说法错误的是
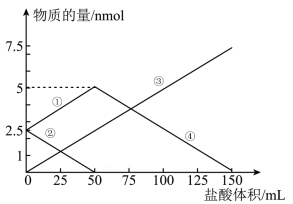
 、
、 组成的混合物溶于水配成1L溶液,取出50mL溶液,然后滴加一定物质的量浓度的盐酸与它反应,得到的图象如图所示。下列说法错误的是
组成的混合物溶于水配成1L溶液,取出50mL溶液,然后滴加一定物质的量浓度的盐酸与它反应,得到的图象如图所示。下列说法错误的是
| A.图象中③线代表的物质是NaCl |
B.④线发生的离子反应: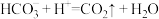 |
| C.盐酸的物质的量浓度是0.05 mol/L |
D.原混合物中 与 与 的物质的量之比为1:2 的物质的量之比为1:2 |
您最近一年使用:0次
名校
7 . 下列关于Na2CO3、NaHCO3的叙述正确的是
| A.Na2CO3溶液、NaHCO3溶液可以用澄清石灰水鉴别 |
| B.分别向Na2CO3溶液和NaHCO3溶液中滴加少量盐酸,产生CO2气体较快的为Na2CO3溶液 |
| C.充分加热agNa2CO3和NaHCO3的混合固体,根据固体质量减重bg,可以计算出混合固体中Na2CO3的质量分数 |
| D.溶解度:Na2CO3<NaHCO3 |
您最近一年使用:0次
名校
8 . 侯氏制碱法是在索尔维制碱法的基础上创造出的一种新的制造纯碱的方法。具体工艺流程图如下:
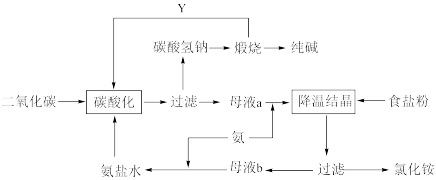
Ⅰ.根据以上流程回答下列问题:
(1)与索尔维制碱法相比,侯氏制碱法最突出的优点是___________
A.原料利用率高 B.设备少 C.生产方便
(2)碳酸化这一步的原理是(用化学方程式表示)___________
(3)侯氏制碱法副产品的一种用途为___________ 。
(4)Y物质是___________ 。
Ⅱ.工业上碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少的NaCl,现欲测定某碳酸钠样品中 的质量分数,某探究性学习小组取样品b g设计了如下实验方案。
的质量分数,某探究性学习小组取样品b g设计了如下实验方案。
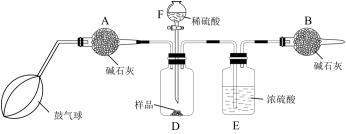
该实验的操作步骤如下:
①如图连接装置(除B外)并加入所需药品。
②称量并记录B的质量( )。
)。
③按动鼓气球,持续约1分钟。
④连接上B。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质( )。
)。
⑧计算
(5)操作⑥中,鼓入空气的作用是___________ ;
(6)根据题干所给的数据列出样品中 的质量分数表达式
的质量分数表达式___________ 。
(7)经实验发现最终所得的 的质量分数超过100%,其可能的原因是
的质量分数超过100%,其可能的原因是___________ 。

Ⅰ.根据以上流程回答下列问题:
(1)与索尔维制碱法相比,侯氏制碱法最突出的优点是
A.原料利用率高 B.设备少 C.生产方便
(2)碳酸化这一步的原理是(用化学方程式表示)
(3)侯氏制碱法副产品的一种用途为
(4)Y物质是
Ⅱ.工业上碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少的NaCl,现欲测定某碳酸钠样品中
 的质量分数,某探究性学习小组取样品b g设计了如下实验方案。
的质量分数,某探究性学习小组取样品b g设计了如下实验方案。
该实验的操作步骤如下:
①如图连接装置(除B外)并加入所需药品。
②称量并记录B的质量(
 )。
)。③按动鼓气球,持续约1分钟。
④连接上B。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质(
 )。
)。⑧计算
(5)操作⑥中,鼓入空气的作用是
(6)根据题干所给的数据列出样品中
 的质量分数表达式
的质量分数表达式(7)经实验发现最终所得的
 的质量分数超过100%,其可能的原因是
的质量分数超过100%,其可能的原因是
您最近一年使用:0次
名校
9 . 如图中,A为一种常见的金属单质,B、C、D、E是含有A元素的常见化合物。它们的焰色反应均为黄色。
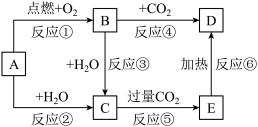
(1)写出下列物质的化学式:B_______ ;E_______ 。
(2)写出B→C反应的化学方程式:_______ ;E→D的化学方程式:_______ 。
(3)加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量为_______ 。

(1)写出下列物质的化学式:B
(2)写出B→C反应的化学方程式:
(3)加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量为
您最近一年使用:0次
2021-10-09更新
|
225次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2021-2022学年高一上学期期中考试化学试题
名校
10 . 现有含 、
、 和
和 的混合物,某同学设计如图所示的实验装置,通过测量反应产生的
的混合物,某同学设计如图所示的实验装置,通过测量反应产生的 和
和 的质量,来确定该混合物中各组分的质量分数。
的质量,来确定该混合物中各组分的质量分数。
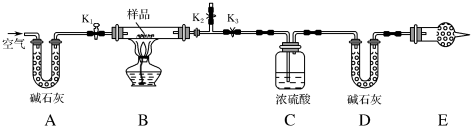
(1)实验步骤:
①按图(夹持装置已省略)组装好实验装置后,首先进行的操作是___________ 。
②称取样品,并将其放入硬质玻璃管中;称量盛装浓硫酸的洗气瓶C的质量和盛装碱石灰的U形管D的质量。
③打开 、
、 ,关闭
,关闭 ,缓缓鼓入空气数分钟,其目的是
,缓缓鼓入空气数分钟,其目的是___________ 。
④关闭 、
、 ,打开
,打开 ,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为
,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为___________ 、___________ 。
⑤打开 ,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题:
①若加热反应后不鼓入空气,对测定结果的影响是___________ 。
②E处干燥管中盛放的药品是___________ ,其作用是___________ ,如果实验中没有该装置,则会导致测量结果中 的质量分数
的质量分数___________ (填“偏大”“偏小”或“无影响”)。
 、
、 和
和 的混合物,某同学设计如图所示的实验装置,通过测量反应产生的
的混合物,某同学设计如图所示的实验装置,通过测量反应产生的 和
和 的质量,来确定该混合物中各组分的质量分数。
的质量,来确定该混合物中各组分的质量分数。
(1)实验步骤:
①按图(夹持装置已省略)组装好实验装置后,首先进行的操作是
②称取样品,并将其放入硬质玻璃管中;称量盛装浓硫酸的洗气瓶C的质量和盛装碱石灰的U形管D的质量。
③打开
 、
、 ,关闭
,关闭 ,缓缓鼓入空气数分钟,其目的是
,缓缓鼓入空气数分钟,其目的是④关闭
 、
、 ,打开
,打开 ,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为
,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为⑤打开
 ,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。(2)关于该实验方案,请回答下列问题:
①若加热反应后不鼓入空气,对测定结果的影响是
②E处干燥管中盛放的药品是
 的质量分数
的质量分数
您最近一年使用:0次
2021-09-29更新
|
306次组卷
|
3卷引用:黑龙江省齐齐哈尔市齐齐哈尔中学2020-2021学年高一上学期期中考试化学试卷



