名校
1 . 下列有关说法正确的是
| A.碳酸钠能与酸反应,不仅可用它来调节面团的酸度,还可用作膨松剂 |
| B.用活性炭漂白红墨水和用臭氧漂白纸浆,二者漂白原理相同 |
C.可以用84消毒液和淀粉检验加碘盐中添加的是碘化钾 还是碘酸钾 还是碘酸钾 |
D.向 还原 还原 得到的黑色固体中,先加入盐酸再加入 得到的黑色固体中,先加入盐酸再加入 溶液,溶液不显红色,说明黑色固体中无 溶液,溶液不显红色,说明黑色固体中无 |
您最近一年使用:0次
名校
2 . 实验室有一包含有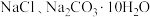 和
和 的混合物。某同学利用下图所示装置进行实验,通过测量反应前后装置丙和丁的增重,测定该混合物中各组分的质量分数。下列说法正确的是
的混合物。某同学利用下图所示装置进行实验,通过测量反应前后装置丙和丁的增重,测定该混合物中各组分的质量分数。下列说法正确的是

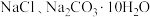 和
和 的混合物。某同学利用下图所示装置进行实验,通过测量反应前后装置丙和丁的增重,测定该混合物中各组分的质量分数。下列说法正确的是
的混合物。某同学利用下图所示装置进行实验,通过测量反应前后装置丙和丁的增重,测定该混合物中各组分的质量分数。下列说法正确的是
| A.甲、丁、戊中碱石灰的作用相同 |
| B.装置丙中药品氯化钙也可以换成浓硫酸 |
C.若将装置甲换为盛放 溶液的洗气瓶,则测得 溶液的洗气瓶,则测得 的质量分数偏高 的质量分数偏高 |
D.若实验结束测得丙、丁中分别增重 和 和 ,则 ,则 的质量分数为 的质量分数为 |
您最近一年使用:0次
名校
解题方法
3 . 某兴趣小组的同学模拟侯德榜制碱法制取纯碱,流程如图:

(1)向饱和NaCl溶液中通入 和氨气时,应先通入
和氨气时,应先通入___________ (填化学式)。操作①的名称为___________ 。
(2)写出反应①的化学方程式:___________ 。
(3)该流程中可循环利用的物质是___________ (填化学式)。
(4)现将 和
和 的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中
的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中 和
和 的物质的量之比为
的物质的量之比为___________ 。
(5)下列选项中哪种方法可以鉴别 溶液和
溶液和 溶液___________。
溶液___________。
(6)下列实验方案中,不能测定出 和
和 的混合物中
的混合物中 质量分数的是_______。
质量分数的是_______。
(7)钠是一种典型的碱金属元素,下列性质的递变规律正确,且能作为碱金属元素金属性递变规律判断依据的是___________(填字母)。

(1)向饱和NaCl溶液中通入
 和氨气时,应先通入
和氨气时,应先通入(2)写出反应①的化学方程式:
(3)该流程中可循环利用的物质是
(4)现将
 和
和 的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中
的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中 和
和 的物质的量之比为
的物质的量之比为(5)下列选项中哪种方法可以鉴别
 溶液和
溶液和 溶液___________。
溶液___________。| A.加入澄清石灰水 | B.加入氢氧化钠溶液 |
| C.加热 | D.逐滴加入稀盐酸 |
(6)下列实验方案中,不能测定出
 和
和 的混合物中
的混合物中 质量分数的是_______。
质量分数的是_______。| A.取ag混合物充分加热,质量减少bg |
| B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体 |
| C.取ag混合物与足量NaOH溶液充分反应,得到bg溶液 |
| D.取ag混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加bg |
(7)钠是一种典型的碱金属元素,下列性质的递变规律正确,且能作为碱金属元素金属性递变规律判断依据的是___________(填字母)。
| A.Li、Na、K的原子半径和密度都随原子序数的增加而增大 |
B.碱性: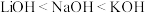 |
C.还原性: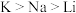 ,故K可以从NaCl溶液中置换出金属钠 ,故K可以从NaCl溶液中置换出金属钠 |
D.熔、沸点: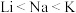 |
您最近一年使用:0次
2023-12-23更新
|
142次组卷
|
3卷引用:湖南省长沙市南雅中学2023-2024学年高一上学期第三次12月月考化学试卷
名校
4 . 下列方案设计、现象和结论正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 比较 和 和 溶液碱性强弱 溶液碱性强弱 | 同温下,向等浓度的两溶液中分别滴入3滴酚酞,观察现象 | 观察到红色较深的是 ,说明碱性 ,说明碱性 大于 大于 |
| B | 区别 和 和 固体 固体 | 分别在两支试管中分别加入少量待检验固体,再加入几滴水,用温度计测定变化 | 温度升高的是 固体,温度降低的是 固体,温度降低的是 固体 固体 |
| C | 检验纯碱溶液中是否存在NaCl | 向待测液中加入 溶液,观察现象 溶液,观察现象 | 若有白色沉淀产生,则溶液中存在 |
| D | 检验 是否有漂白性 是否有漂白性 | 将干燥的 通入装有潮湿有色布条的广口瓶中,观察现象 通入装有潮湿有色布条的广口瓶中,观察现象 | 若有色布条颜色逐渐褪去,则说明 有漂白性 有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-29更新
|
584次组卷
|
3卷引用:浙江省杭州市富阳区实验中学2023-2024学年高一上学期12月月考化学试卷
名校
5 . 向均为a个的NaOH、 混合溶液中通入b个
混合溶液中通入b个 气体,则下列条件下对应的离子方程式
气体,则下列条件下对应的离子方程式不正确 的是
 混合溶液中通入b个
混合溶液中通入b个 气体,则下列条件下对应的离子方程式
气体,则下列条件下对应的离子方程式A.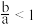 时, 时, |
B.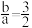 时, 时,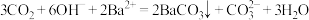 |
C.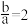 时, 时, |
D.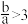 时, 时, |
您最近一年使用:0次
2023-10-23更新
|
522次组卷
|
6卷引用:浙江金华第一中学2023-2024学年高一上学期10月月考化学试题
名校
解题方法
6 . 现有一份Na2CO3和NaHCO3固体混合物,某化学兴趣小组设计如图所示实验装置(夹持仪器省略),测定固体混合物中NaHCO3的质量分数。实验步骤如下:

①组装好实验装置,并_______;
②加药品,称取mg样品放入硬质玻璃管中;称量装有碱石灰的U形管D的质量为m1g;。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟;
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体;
⑤打开活塞K1,缓缓鼓入空气数分钟后拆下装置,称量U形管D的质量为m2g。
请回答下列问题:
(1)补充实验步骤①的操作为_______ 。
(2)装置E中实验仪器的名称为_______ 。
(3)装置B中发生反应的化学方程式为_______ 。
(4)实验步骤⑤中“缓缓鼓入空气数分钟”的目的是_______ 。
(5)若缺少实验步骤③会导致测定结果_______ (填“偏大”“偏小”或“无影响”)。
(6)能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是_______ 。

A. 将Na2CO3和NaHCO3配制成同浓度的溶液,用pH试纸测定pH值并做比较
B. 两支试管中均盛有3mL等浓度的稀盐酸,将少量等质量的Na2CO3、NaHCO3粉末同时倒入试管中,比较反应快慢(如图)。
C. 分别在这两种物质的溶液中,加入少量Ca(OH)2溶液
(7)下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是_______。

①组装好实验装置,并_______;
②加药品,称取mg样品放入硬质玻璃管中;称量装有碱石灰的U形管D的质量为m1g;。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟;
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体;
⑤打开活塞K1,缓缓鼓入空气数分钟后拆下装置,称量U形管D的质量为m2g。
请回答下列问题:
(1)补充实验步骤①的操作为
(2)装置E中实验仪器的名称为
(3)装置B中发生反应的化学方程式为
(4)实验步骤⑤中“缓缓鼓入空气数分钟”的目的是
(5)若缺少实验步骤③会导致测定结果
(6)能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是

A. 将Na2CO3和NaHCO3配制成同浓度的溶液,用pH试纸测定pH值并做比较
B. 两支试管中均盛有3mL等浓度的稀盐酸,将少量等质量的Na2CO3、NaHCO3粉末同时倒入试管中,比较反应快慢(如图)。
C. 分别在这两种物质的溶液中,加入少量Ca(OH)2溶液
(7)下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是_______。
| A.取a g混合物充分加热,减重b g |
| B.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体 |
| C.取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g |
| D.取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体 |
您最近一年使用:0次
名校
7 . 类比是学习化学的重要方法,下列类比结果合理的是
| 选项 | 已知 | 推理 |
| A | 电解熔融的MgCl2冶炼镁 | 电解熔融的AlCl3也能冶炼铝 |
| B | CO2能使澄清石灰水变浑浊 | SO2也能使澄清石灰水变浑浊 |
| C | C2H2分子的空间结构为直线形 | H2O2分子的空间结构也为直线形 |
| D | 溶解度:Ca(HCO3)2>CaCO3 | 溶解度:NaHCO3 >Na2CO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-20更新
|
482次组卷
|
2卷引用:湖北省部分学校2024届高三上学期8月起点考试化学试题
名校
8 . Ⅰ.探究金属钠与水反应实验过程中,某课外小组同学记录了如下实验现象和实验结论:
①有碱生成;②溶液变红;③钠四处游动;④钠浮在水面上;⑤有气体产生;⑥钠的密度比水小;⑦钠熔成光亮的小球;⑧反应放热,钠熔点低。
(1)请填写下表中的空格(从①~⑧中选择,填序号):
(2)写出钠与水反应的离子方程式:________ 。
Ⅱ.某课外活动小组设计下列装置,验证二氧化碳跟过氧化钠反应时,需要与水接触。
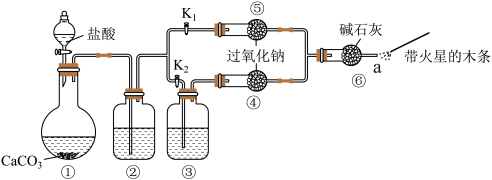
【装置分析】
(3)装置①中反应的离子方程式是________ 。
(4)已知盐酸具有挥发性。装置②中的试剂是________ ,②中反应的离子方程式是________ 。
(5)装置③中的试剂是________ 。
【进行实验】
步骤1:打开弹簧夹 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。
步骤2:打开弹簧夹 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。
(6)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是________ 、________ 。
(7)写出过氧化钠跟二氧化碳反应的化学方程式并标出反应过程中的电子转移方向和数目:________ 。
Ⅲ.欲探究 和
和 稳定性的相对强弱,两同学分别设计以下两组装置:
稳定性的相对强弱,两同学分别设计以下两组装置:
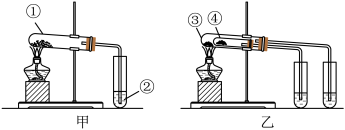
(8)如甲图所示,分别用 和
和 做实验,试管②中的试剂是
做实验,试管②中的试剂是________ 。试管①中发生反应的化学方程式是________ 。
(9)如乙图所示,试管④中装入的固体应该是________ (填化学式)。
(10)通过上述实验,得出的结论是; 比
比 的稳定性
的稳定性________ (填“强”或“弱”)。
(11)向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的 后,均稀释至100mL。向稀释后的溶液中,逐滴滴加0.1mol/L盐酸,产生
后,均稀释至100mL。向稀释后的溶液中,逐滴滴加0.1mol/L盐酸,产生 的体积(已折合至标准状况)与所加盐酸的体积关系如图所示。
的体积(已折合至标准状况)与所加盐酸的体积关系如图所示。
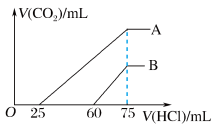
①A曲线表明,原溶液通入 后,所得溶质与盐酸反应产生
后,所得溶质与盐酸反应产生 的最大体积为
的最大体积为________ mL(标准状况)。
②B曲线表明,原溶液通入 后,所得溶液中溶质的化学式为
后,所得溶液中溶质的化学式为________ 。
③原NaOH溶液的物质的量浓度为________ 。
①有碱生成;②溶液变红;③钠四处游动;④钠浮在水面上;⑤有气体产生;⑥钠的密度比水小;⑦钠熔成光亮的小球;⑧反应放热,钠熔点低。
(1)请填写下表中的空格(从①~⑧中选择,填序号):
实验现象 | ⑦ | ③ | ||
实验结论 | ⑥ | ① |
Ⅱ.某课外活动小组设计下列装置,验证二氧化碳跟过氧化钠反应时,需要与水接触。

【装置分析】
(3)装置①中反应的离子方程式是
(4)已知盐酸具有挥发性。装置②中的试剂是
(5)装置③中的试剂是
【进行实验】
步骤1:打开弹簧夹
 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。步骤2:打开弹簧夹
 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在处。(6)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是
(7)写出过氧化钠跟二氧化碳反应的化学方程式并标出反应过程中的电子转移方向和数目:
Ⅲ.欲探究
 和
和 稳定性的相对强弱,两同学分别设计以下两组装置:
稳定性的相对强弱,两同学分别设计以下两组装置:
(8)如甲图所示,分别用
 和
和 做实验,试管②中的试剂是
做实验,试管②中的试剂是(9)如乙图所示,试管④中装入的固体应该是
(10)通过上述实验,得出的结论是;
 比
比 的稳定性
的稳定性(11)向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的
 后,均稀释至100mL。向稀释后的溶液中,逐滴滴加0.1mol/L盐酸,产生
后,均稀释至100mL。向稀释后的溶液中,逐滴滴加0.1mol/L盐酸,产生 的体积(已折合至标准状况)与所加盐酸的体积关系如图所示。
的体积(已折合至标准状况)与所加盐酸的体积关系如图所示。
①A曲线表明,原溶液通入
 后,所得溶质与盐酸反应产生
后,所得溶质与盐酸反应产生 的最大体积为
的最大体积为②B曲线表明,原溶液通入
 后,所得溶液中溶质的化学式为
后,所得溶液中溶质的化学式为③原NaOH溶液的物质的量浓度为
您最近一年使用:0次
名校
9 . 下列说法正确的是
① 投入到紫色石蕊试液中,溶液先变蓝,后褪色;
投入到紫色石蕊试液中,溶液先变蓝,后褪色;
②足量 和质量相等的
和质量相等的 在常温和加热条件下反应,转移的电子数相等;
在常温和加热条件下反应,转移的电子数相等;
③质量相等的 与
与 分别与足量的相同浓度盐酸完全反应时,产生
分别与足量的相同浓度盐酸完全反应时,产生 的物质的量相等;
的物质的量相等;
④取 和
和 混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重
混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重 ,能测定混合物中
,能测定混合物中 质量分数;
质量分数;
⑤鉴别 与
与 溶液,可用
溶液,可用 溶液;
溶液;
⑥除去 粉末中混有的
粉末中混有的 ,可配制成溶液通入过量的
,可配制成溶液通入过量的 ,再低温结晶。
,再低温结晶。
①
 投入到紫色石蕊试液中,溶液先变蓝,后褪色;
投入到紫色石蕊试液中,溶液先变蓝,后褪色;②足量
 和质量相等的
和质量相等的 在常温和加热条件下反应,转移的电子数相等;
在常温和加热条件下反应,转移的电子数相等;③质量相等的
 与
与 分别与足量的相同浓度盐酸完全反应时,产生
分别与足量的相同浓度盐酸完全反应时,产生 的物质的量相等;
的物质的量相等;④取
 和
和 混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重
混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重 ,能测定混合物中
,能测定混合物中 质量分数;
质量分数;⑤鉴别
 与
与 溶液,可用
溶液,可用 溶液;
溶液;⑥除去
 粉末中混有的
粉末中混有的 ,可配制成溶液通入过量的
,可配制成溶液通入过量的 ,再低温结晶。
,再低温结晶。| A.②③④ | B.①②⑥ | C.②④⑤ | D.③④⑥ |
您最近一年使用:0次
2023-02-16更新
|
896次组卷
|
2卷引用:河南省遂平县第一高级中学2023-2024学年高一上学期第一次月考化学试题
名校
10 . 下列“类比”合理的是
A. 可以作为膨松剂,则 可以作为膨松剂,则 也可以作为膨松剂 也可以作为膨松剂 |
B. 溶解度小于 溶解度小于 ,则 ,则 溶解度小于 溶解度小于 |
C.少量 与澄清石灰水生成白色沉淀,则少量 与澄清石灰水生成白色沉淀,则少量 与澄清石灰水也生成白色沉淀 与澄清石灰水也生成白色沉淀 |
D. 与 与 生成 生成 和 和 ,则 ,则 与 与 生成 生成 和 和 |
您最近一年使用:0次
2023-02-12更新
|
604次组卷
|
3卷引用:安徽省六安第一中学2022-2023学年高一下学期第一次阶段检测化学试题



