1 . 白钠镁矾(mNa2SO4⋅nMgSO4⋅xH2O)俗称硝板,工业上用白钠镁矾制备碱式碳酸镁[4MgCO3⋅Mg(OH)2⋅4H2O]晶须的过程如下:向碳酸钠溶液中加入白钠镁矾,保持50℃加热0.5h,有大量的5MgCO3⋅3H2O生成,然后升高温度到85℃加热2h发生热解反应,过滤得碱式碳酸镁晶须。
(1)热解反应的方程式为___ 。
(2)碱式碳酸镁可用作化学冷却剂,原因是___ 。
(3)为测定白钠镁矾的组成,进行下列实验:
①取白钠镁矾3.340g溶于水配成100.00mL溶液A;
②取25.00mL溶液A,加入足量的氯化钡溶液,得BaSO41.165g;为进一步确认沉淀是否已完全,可采取的操作是___ 。
③另取25.00mL溶液A,调节pH=10,用浓度为0.1000mol⋅L-1的EDTA标准溶液滴定Mg2+(离子方程式为Mg2++H2Y =MgY2-+2H+),滴定至终点,消耗标准溶液25.00mL。通过计算确定白钠镁矾的化学式。
=MgY2-+2H+),滴定至终点,消耗标准溶液25.00mL。通过计算确定白钠镁矾的化学式。___ (写出计算过程)。
(1)热解反应的方程式为
(2)碱式碳酸镁可用作化学冷却剂,原因是
(3)为测定白钠镁矾的组成,进行下列实验:
①取白钠镁矾3.340g溶于水配成100.00mL溶液A;
②取25.00mL溶液A,加入足量的氯化钡溶液,得BaSO41.165g;为进一步确认沉淀是否已完全,可采取的操作是
③另取25.00mL溶液A,调节pH=10,用浓度为0.1000mol⋅L-1的EDTA标准溶液滴定Mg2+(离子方程式为Mg2++H2Y
 =MgY2-+2H+),滴定至终点,消耗标准溶液25.00mL。通过计算确定白钠镁矾的化学式。
=MgY2-+2H+),滴定至终点,消耗标准溶液25.00mL。通过计算确定白钠镁矾的化学式。
您最近一年使用:0次
解题方法
2 . 氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
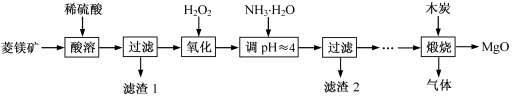
(1)酸溶时发生反应的离子方程式为_______ 。
(2)加入H2O2氧化时,发生反应的化学方程式为________ 。
(3)滤渣2 的成分是_______ (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
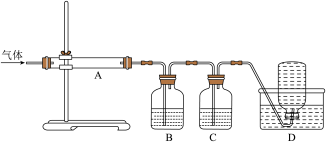
①D中收集的气体可以是_______ (填化学式)。
②B中盛放的溶液可以是______ (填字母)。
a.KMnO4溶液 b.稀硝酸 c.NaOH 溶液 d.Na2CO3溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:_______ 。

(1)酸溶时发生反应的离子方程式为
(2)加入H2O2氧化时,发生反应的化学方程式为
(3)滤渣2 的成分是
(4)煅烧过程存在以下反应:
2MgSO4+C
 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑MgSO4+C
 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑ MgSO4+3C
 MgO+S↑+3CO↑
MgO+S↑+3CO↑利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体可以是
②B中盛放的溶液可以是
a.KMnO4溶液 b.稀硝酸 c.NaOH 溶液 d.Na2CO3溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:
您最近一年使用:0次
解题方法
3 . 下列选项所示的物质间转化不能实现的是
A.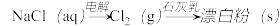 |
B. |
C.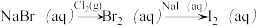 |
D.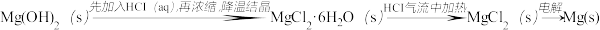 |
您最近一年使用:0次
20-21高三上·江苏南通·阶段练习
4 . 在给定条件下,下列选项所示的物质间转化均能实现的是
A.NH3 NO2 NO2 HNO3 HNO3 |
B.NaClO(aq) HClO(aq) HClO(aq) Cl2(g) Cl2(g) |
C.CuO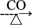 Cu Cu CuSO4 CuSO4 |
D.Mg2(OH)2CO3 MgCl2(aq) MgCl2(aq) Mg Mg |
您最近一年使用:0次
名校
解题方法
5 . 下列变化不能通过一步化学反应实现的是
| A.BaCl2→BaSO4 | B.CuO→Cu(OH)2 |
| C.NaOH→Na2CO3 | D.MgSO4→Mg(OH)2 |
您最近一年使用:0次
2020-10-09更新
|
415次组卷
|
10卷引用:江苏省扬州中学2020-2021学年高一上学期10月月考化学试题
江苏省扬州中学2020-2021学年高一上学期10月月考化学试题吉林省长春市榆树市实验高级中学2020-2021学年高一上学期第一次月考化学试题河北省唐山市丰润二中2020-2021学年高一上学期10月月考化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高一上学期10月月考化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高一上学期第一次月考化学试题北京师范大学附属中学2023-2024学年高一上学期10月月考化学试题云南省宣威市第三中学2023-2024学年高一上学期第一次月考化学试题(已下线)练习2 物质的转化-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)河北省张家口市宣化第一中学2021-2022学年高一上学期期初考试化学试题陕西省延安市富县高级中学2021-2022学年高一上学期期中考试化学试卷
6 . 下列选项所示的物质间转化均能实现的是
A.N2(g)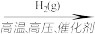 NH3(g) NH3(g)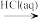 NH4Cl(aq) NH4Cl(aq) |
B.Fe(s)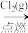 FeCl2(s) FeCl2(s) Fe(OH)2(s) Fe(OH)2(s) |
C.MgO(s)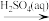 MgSO4(aq) MgSO4(aq)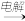 Mg(S) Mg(S) |
D.S(s)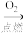 SO2(g) SO2(g) BaSO3(s) BaSO3(s) |
您最近一年使用:0次
2020-09-15更新
|
169次组卷
|
3卷引用:江苏省启东市吕四中学2020-2021学年高一下学期第二次月考化学试题
名校
解题方法
7 . 下列变化不能通过一步化学反应实现的是( )
| A.BaCl2→BaSO4 | B.CuO→Cu(OH)2 | C.NaOH→Na2SO3 | D.MgSO4→Mg(OH)2 |
您最近一年使用:0次
2020-09-10更新
|
2535次组卷
|
31卷引用:江苏省淮安市涟水县第一中学2022-2023学年高一上学期第二次阶段检测化学试题
江苏省淮安市涟水县第一中学2022-2023学年高一上学期第二次阶段检测化学试题辽宁省阜新市海州高级中学2019-2020学年高一10月月考化学试题江苏省启东中学2020-2021学年高一上学期期初考试化学试题(已下线)【浙江新东方】hzomo化学001辽宁省庄河市高级中学2021-2022学年高一10月月考化学试题山东省济南市平阴县第一中学2021-2022学年高一上学期10月阶段检测化学试题福建省南安市侨光中学2021-2022学年高一上学期第一次阶段考化学试题甘肃省甘南舟曲县第一中学2021-2022学年高一上学期第一次月考化学试卷黑龙江省海林市朝鲜族中学2020-2021学年高一上学期第一次月考化学试题青海省西宁市湟中区多巴高级中学2021-2022学年高一下学期第一次月考化学试题河南省许昌市鄢陵县职业教育中心2021—2022学年高一上学期升学班第一次月考化学试题广西梧州市藤县第七中学2021-2022学年高一10月月考化学试题贵州省桐梓县育才中学2019-2020学年高二上学期开学考试化学试题2020年春季苏教版高中化学必修1专题一《化学家眼中的物质世界》测试卷云南省昭通市巧家县第四中学2019-2020学年高一上学期期末考试化学试题人教版(2019)高一必修第一册第一章 物质及其变化 第一节 物质的分类及转化课时2 物质的转化(已下线)1.1.2 物质的转化(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)高一必修第一册(苏教2019版)专题1 第一单元 物质及其反应的分类云南省昆明师范专科学校附属中学2020-2021学年高一上学期期中考试化学试题广西岑溪市2020-2021学年高二上学期期中考试化学(理)试题(已下线)【浙江新东方】【2020】【高一上】【期中】【hd-lp414】【化学】新疆维吾尔族自治区哈密市第十五中学2020-2021学年高一上学期期末考试化学试题新疆维吾尔自治区疏勒县2022 届高三第一次调研测试化学试题(已下线)专题05元素及其化合物-2022年高考真题+模拟题汇编(全国卷)(已下线)专题05元素及其化合物-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题05元素及其化合物-五年(2018~2022)高考真题汇编(全国卷)(已下线)衔接点05 物质间的相互转化-2022年初升高化学无忧衔接黑龙江省佳木斯市第八中学2021-2022学年高一上学期期中考试化学试题吉林省舒兰市第十八中学校2022-2023学年高一上学期期中考试化学试题(已下线)第2讲 物质的转化-【暑假自学课】2023年新高一暑假精品课(苏教版2019必修第一册)广东省梅州市大埔县虎山中学2023-2024学年高一上学期11月期中化学试题
名校
8 . 在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.CaCO3 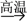 CaO CaO 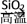 CaSiO3 CaSiO3 |
B.Mg(OH)2 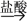 MgCl2(aq) MgCl2(aq)  Mg Mg |
C.MnO2 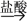 MnCl2(aq) MnCl2(aq) 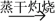 MnCl2(s) MnCl2(s) |
D.S 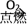 SO2 SO2 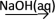 Na2SO4(aq) Na2SO4(aq) |
您最近一年使用:0次
解题方法
9 . 碳酸镁晶须是一种新型吸波隐形材料中的增强剂。某工厂以MgCl2(含少量杂质FeCl2、FeCl3)为原料制备碳酸镁晶须(MgCO3·H2O)的工艺流程如下:
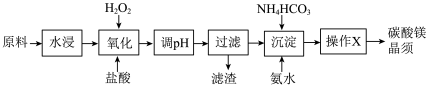
已知:Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH
注:Fe(OH)2沉淀呈絮状,不易从溶液中除去。
(1)写出“氧化”过程中发生的离子反应方程式_______________ 。
(2)pH调节的范围___________ ,滤渣的主要成分___________ (填化学式)。
(3)操作X包括过滤、洗涤、烘干,证明碳酸镁晶须已经洗涤干净的方法______________ 。
(4)水浸后溶液中Fe2+、Fe3+含量的测定
①取水浸后溶液100.00 mL,测得Cl-的浓度为0.455 mol·L-1,向其中缓缓通入氯气使Fe2+恰好完全转化为Fe3+,测得此时溶液中Cl-的浓度为0.460 mol·L-1(溶液体积变化忽略不计)。
②另取水浸后溶液100.00 mL,向其中加入过量的1 mol·L-1 NaOH溶液,充分反应后过滤、洗涤、灼烧,冷却后,称得固体粉末的质量为0.96 g。试通过计算确定水浸后溶液中Fe2+、Fe3+的物质的量浓度(写出计算过程)。_______________________

已知:Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH
注:Fe(OH)2沉淀呈絮状,不易从溶液中除去。
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.9 | 11.0 |
(2)pH调节的范围
(3)操作X包括过滤、洗涤、烘干,证明碳酸镁晶须已经洗涤干净的方法
(4)水浸后溶液中Fe2+、Fe3+含量的测定
①取水浸后溶液100.00 mL,测得Cl-的浓度为0.455 mol·L-1,向其中缓缓通入氯气使Fe2+恰好完全转化为Fe3+,测得此时溶液中Cl-的浓度为0.460 mol·L-1(溶液体积变化忽略不计)。
②另取水浸后溶液100.00 mL,向其中加入过量的1 mol·L-1 NaOH溶液,充分反应后过滤、洗涤、灼烧,冷却后,称得固体粉末的质量为0.96 g。试通过计算确定水浸后溶液中Fe2+、Fe3+的物质的量浓度(写出计算过程)。
您最近一年使用:0次
名校
解题方法
10 . 以下物质间的每步转化不能通过一步反应实现的是 ( )
| A.Al2O3→Al(OH)3→NaAlO2 | B.MgCl2→Mg(OH)2→MgO |
| C.Na→Na2O2→O2 | D.HCl→FeCl3→FeCl2 |
您最近一年使用:0次
2019-12-12更新
|
157次组卷
|
2卷引用:扬州市邗江中学2019~2020学年高一上学期第二次调研检测化学试题



