名校
解题方法
1 . 镁的化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是________ ,还生成少量的________ (填化学式)。
(2)物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为_____________
A.3.2g B.4.0g C.4.2g D.4.6g
(3)镁作为一种强还原剂,还用于钛和铀的生产,写出镁与TiCl4在高温条件下制取钛的化学方程式_______________ 。
(4)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077),Mg2Cu与H2反应的化学方程式为___________ 。
(5)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是__________ ,该化合物水解时生成甲烷、氯化镁和氢氧化镁,请写出该反应的化学方程式______________________ 。
(1)单质镁在空气中燃烧的主要产物是
(2)物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为
A.3.2g B.4.0g C.4.2g D.4.6g
(3)镁作为一种强还原剂,还用于钛和铀的生产,写出镁与TiCl4在高温条件下制取钛的化学方程式
(4)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077),Mg2Cu与H2反应的化学方程式为
(5)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是
您最近一年使用:0次
名校
解题方法
2 . 碱式碳酸镁和无水氯化镁具有广泛用途。用白云石(CaCO3• MgCO3)为原料生产碱式碳酸镁和无水氯化镁的流程如下:
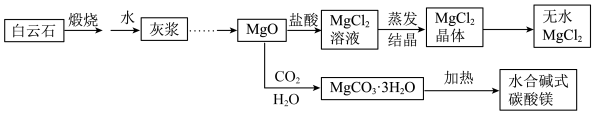
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有:_________________ 。
(2)为探究所制得的水合碱式碳酸镁(m MgCO3•n Mg(OH)2• xH2O )的组成。某同学组装仪器如图所示:

实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,此水合碱式碳酸镁的化学式为:_______________________ 。
(3)A框中装置的作用是_____________________________________ 。
(4)在装好试剂后,加热前应进行的操作是___________________________________ 。

回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有:
(2)为探究所制得的水合碱式碳酸镁(m MgCO3•n Mg(OH)2• xH2O )的组成。某同学组装仪器如图所示:

实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,此水合碱式碳酸镁的化学式为:
(3)A框中装置的作用是
(4)在装好试剂后,加热前应进行的操作是
您最近一年使用:0次
名校
3 . 下列有关常见的几种金属氧化物的性质和用途的说法不正确的是
| A.氧化钙可用作干燥剂 | B.Fe2O3可用于制作红色油漆和涂料 |
| C.MgO和Al2O3可用作耐高温材料 | D.Na2O2、CuO、FeO都能溶于水,且与水反应都生成相应的碱 |
您最近一年使用:0次
2018高三上·全国·专题练习
名校
4 . 镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
(1)氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,能与水反应,常用作触媒,实验室欲用如图1所示装置和药品制备少量氮化镁。
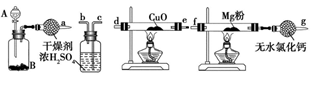
①A中盛装的是浓氨水,B中可盛装___ ,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接___ 、___ 接___ 、___ 接___ 。
③已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分,该反应的化学方程式为____________________ 。
④如果没有装有无水氯化钙的装置,可能发生反应的化学方程式为____________________ 。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。合成碳酸镁晶须的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到碳酸镁晶须产品(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1 MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、_____ 。
②步骤3中加氨水后反应的离子方程式为______________ 。
测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。
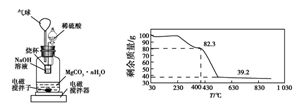
③图中气球的作用是__________________ 。
④上述反应后期要升温到30 ℃,主要目的是________________ 。
⑤若实验测得1.000 g碳酸镁晶须产生CO2的平均物质的量为a mol,则n为___ (用含a的表达式表示)。
⑥称取100 g上述晶须产品进行热重分析,得到的热重曲线如图所示,则合成的晶须中n=______ 。
(1)氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,能与水反应,常用作触媒,实验室欲用如图1所示装置和药品制备少量氮化镁。

①A中盛装的是浓氨水,B中可盛装
②按照气流的方向从左至右连接装置:a接
③已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分,该反应的化学方程式为
④如果没有装有无水氯化钙的装置,可能发生反应的化学方程式为
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。合成碳酸镁晶须的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到碳酸镁晶须产品(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1 MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、
②步骤3中加氨水后反应的离子方程式为
测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。

③图中气球的作用是
④上述反应后期要升温到30 ℃,主要目的是
⑤若实验测得1.000 g碳酸镁晶须产生CO2的平均物质的量为a mol,则n为
⑥称取100 g上述晶须产品进行热重分析,得到的热重曲线如图所示,则合成的晶须中n=
您最近一年使用:0次
2018-11-23更新
|
849次组卷
|
3卷引用:湖南省常德市芷兰实验学校2020届高三第二次月考化学试题
湖南省常德市芷兰实验学校2020届高三第二次月考化学试题(已下线)2018年11月25日 《每日一题》 人教版一轮复习-每周一测【全国百强校】湖南省长沙市长郡中学2019届高三上学期第五次调研考试化学试题
名校
解题方法
5 . 用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:
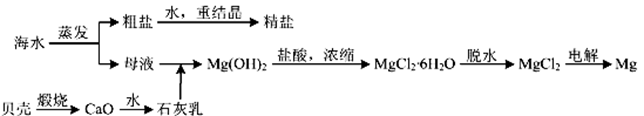
(1)在实验室中由粗盐“重结晶”的操作包括溶解、过滤、蒸发、_________ (填操作方法)、洗涤等步骤;有关其中“蒸发”步骤的叙述错误的是____________ 。
a. 蒸发的目的是得到热饱和溶液 b. 蒸发的目的是析出晶体
c. 应用余热蒸干溶液 d. 应蒸发至有较多晶体析出时为止
(2)由MgCl2溶液得到MgCl2·6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是_________ 。
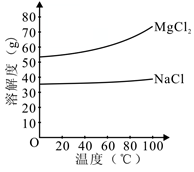
a. 得到热饱和溶液 b. 析出晶体
(3)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:__________ 。
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是_____________________________________ 。
(5)MgCl2可电解制Mg,MgO则是重要的耐火材料。在550℃时,MgCl2·6H2O会分解生成MgO、MgCl2、HCl和H2O,若不补充其它原料,使一定量的MgCl2·6H2O全部生成a mol MgO、b mol MgCl2和36.5%的盐酸,则a∶b为______________ (取整数值)。

(1)在实验室中由粗盐“重结晶”的操作包括溶解、过滤、蒸发、
a. 蒸发的目的是得到热饱和溶液 b. 蒸发的目的是析出晶体
c. 应用余热蒸干溶液 d. 应蒸发至有较多晶体析出时为止
(2)由MgCl2溶液得到MgCl2·6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是

a. 得到热饱和溶液 b. 析出晶体
(3)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是
(5)MgCl2可电解制Mg,MgO则是重要的耐火材料。在550℃时,MgCl2·6H2O会分解生成MgO、MgCl2、HCl和H2O,若不补充其它原料,使一定量的MgCl2·6H2O全部生成a mol MgO、b mol MgCl2和36.5%的盐酸,则a∶b为
您最近一年使用:0次
12-13高三上·浙江宁波·期中
6 . 下列物质与其用途完全符合的有条
①Na2CO3—制玻璃;②SiO2—太阳能电池;③AgI—人工降雨;④NaCl—制纯碱;
⑤Al2O3— 焊接钢轨;⑥NaClO—消毒剂⑦Fe2O3—红色油漆或涂料 ⑧MgO—耐火材料
①Na2CO3—制玻璃;②SiO2—太阳能电池;③AgI—人工降雨;④NaCl—制纯碱;
⑤Al2O3— 焊接钢轨;⑥NaClO—消毒剂⑦Fe2O3—红色油漆或涂料 ⑧MgO—耐火材料
| A.4 | B.5 | C.6 | D.7 |
您最近一年使用:0次
2016-12-09更新
|
245次组卷
|
8卷引用:2015届河南省周口中英文学校高三上学期12月月考化学试卷
2015届河南省周口中英文学校高三上学期12月月考化学试卷2016届福建省莆田九中高三上学期第二次月考化学试卷2016届河南省偃师高级中学高三上学期第二次月考化学试卷(已下线)2013届浙江省宁波市效实中学高三上学期期中考试化学试卷(已下线)2013-2014黑龙江省双鸭山一中高三上学期期中化学试卷2015-2016学年河北省石家庄一中高二下期末化学试卷2017届河北省故城县高级中学高三上学期期中化学试卷新疆哈密市第八中学2020届高三上学期期中考试化学试题
解题方法
7 . 镁的化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁常用来制造信号弹和焰火,是因为___ ,一种白色难溶于水的含镁化合物因为熔点高,是优质的耐高温材料,其化学式为___ 。
(2)镁条在空气中燃烧可以生成多种产物,写出其中所有不含氧元素的固体产物化学式___ ;某部分被氧化的镁条1.6 g与足量的盐酸反应,在标准状况下生成1.12 L H2,则反应前被氧化的镁的质量是___ 。
(1)单质镁常用来制造信号弹和焰火,是因为
(2)镁条在空气中燃烧可以生成多种产物,写出其中所有不含氧元素的固体产物化学式
您最近一年使用:0次
名校
解题方法
8 . 镁的化合物在化工生产和药物合成上有重要用途。某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量Fe的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
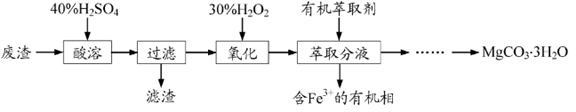
(1)废渣的成分为_________ (填化学式),过滤装置在使用一段时间后需用NaOH溶液清洗,用化学方程式表示其清洗原理_____________________ 。
(2)加入H2O2的目的是__________________ ,一段时间后,溶液中有气泡出现并放热,则产生气泡的原因是____________ 。
(3)萃取分液中要用到分液漏斗,分液漏斗在使用前须洗干净并________________ 。萃取分液的目的是____________ 。(填序号)
A、除去水溶液中的铁离子
B、增加镁离子在水中的溶解性
C、富集铁元素,可以回收利用
(4)萃取后得到的水溶液制备MgCO3·3H2O的实验操作:边搅拌边向溶液中滴加Na2CO3溶液至有大量沉淀生成,静置,________ ,确定沉淀完全后,过滤、____________ ,得到MgCO3·3H2O。

(1)废渣的成分为
(2)加入H2O2的目的是
(3)萃取分液中要用到分液漏斗,分液漏斗在使用前须洗干净并
A、除去水溶液中的铁离子
B、增加镁离子在水中的溶解性
C、富集铁元素,可以回收利用
(4)萃取后得到的水溶液制备MgCO3·3H2O的实验操作:边搅拌边向溶液中滴加Na2CO3溶液至有大量沉淀生成,静置,
您最近一年使用:0次
2017-03-09更新
|
860次组卷
|
2卷引用:吉林省实验中学2016-2017学年高二下学期第二次月考(5月)化学试题
解题方法
9 . 镁及其化合物有着广泛用途。工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如下:

(1)滤渣1为____________________ 。
(2)加入H2O2氧化时,发生反应的离子方程式为____________________ 。
(3)在实验室煅烧滤渣2制得的金属氧化物为____________________ (填化学式),需要的仪器除酒精灯、三脚架、泥三角以外,还需要____________________ (填名称)。
(4)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,该反应中反应物的质量之比为____________________ 。
(5)25℃时,加入CO(NH2)2至开始产生沉淀,当Mg2+全部沉淀时溶液的c(OH-)=____________________ (已知25℃,Ksp[Mg(OH)2]=1.96×10-11)。
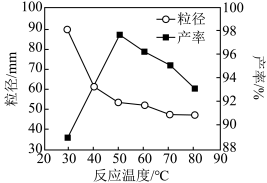
(6)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制备 纳米MgO。取少量制得的该物质溶于某种液体溶剂中(两者不反应),能说明是纳米MgO存在的简单方法是____________________ 。如图为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为____________________ 。

(1)滤渣1为
(2)加入H2O2氧化时,发生反应的离子方程式为
(3)在实验室煅烧滤渣2制得的金属氧化物为
(4)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,该反应中反应物的质量之比为
(5)25℃时,加入CO(NH2)2至开始产生沉淀,当Mg2+全部沉淀时溶液的c(OH-)=
(6)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制备 纳米MgO。取少量制得的该物质溶于某种液体溶剂中(两者不反应),能说明是纳米MgO存在的简单方法是

您最近一年使用:0次
10 . 以橄榄石(主要成分是Mg9FeSi5O20)等为原料生产硅胶、碱式碳酸镁[Mg2(OH)2CO3]的部分工艺流程如下图所示:
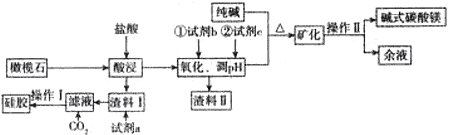
(1)Mg9FeSi5O20中铁元素的化合价为 ,为提高镁的浸出率,可采用的两种主要措施是 渣料II的成分是 。
(2)若试剂b是氯碱工业中的某种气体产物,写出加入b后反应的离子方程式 。试剂c的用途是调节溶液的pH,比较恰当的物质是 (写化学式,后同),余液中溶质的主要成分是 。
(3)操作I的名称是 ,写出生成碱式碳酸镁(同时有气体生成)的离子方程式 。

(1)Mg9FeSi5O20中铁元素的化合价为 ,为提高镁的浸出率,可采用的两种主要措施是 渣料II的成分是 。
(2)若试剂b是氯碱工业中的某种气体产物,写出加入b后反应的离子方程式 。试剂c的用途是调节溶液的pH,比较恰当的物质是 (写化学式,后同),余液中溶质的主要成分是 。
(3)操作I的名称是 ,写出生成碱式碳酸镁(同时有气体生成)的离子方程式 。
您最近一年使用:0次



