1 . 过氧化镁( )不溶于水,与酸反应生成
)不溶于水,与酸反应生成 ,在医学上可作解酸剂。常温下
,在医学上可作解酸剂。常温下 较稳定,加热时会分解生成
较稳定,加热时会分解生成 和MgO。MgO与
和MgO。MgO与 反应可制得
反应可制得 ,同时放出大量热。一种制备
,同时放出大量热。一种制备 的流程如图所示:请回答下列问题:
的流程如图所示:请回答下列问题:
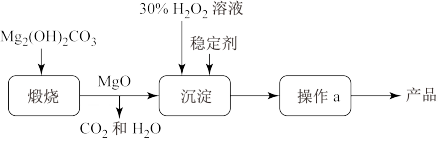
(1)过氧化镁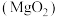 中氧元素的价态为
中氧元素的价态为_______ 。煅烧 的化学反应方程式
的化学反应方程式_______ 。
(2)上述制备过程中加入稳定剂的作用是_______ ;操作a为_______ 。
 产品中常会混有少量MgO,实验室可通过多种方案测定样品中
产品中常会混有少量MgO,实验室可通过多种方案测定样品中 的含量。某研究小组拟用下图装置测定样品(含
的含量。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。
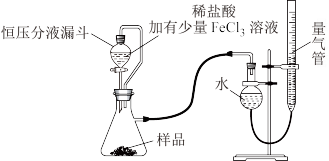
(3)研究小组的实验原理是(用化学方程式表示)
①_______ ;
②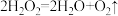 ,稀盐酸中加入
,稀盐酸中加入 溶液的作用是
溶液的作用是_______ 。
(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、_______ 。
(5)该小组记录的实验数据如下,样品的质量为mg;反应开始前量气管的读数为amL;反应结束后量气管的读数为bmL,则样品中过氧化镁的质量分数为_______ 。(该实验条件下 密度为
密度为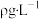 )
)
 )不溶于水,与酸反应生成
)不溶于水,与酸反应生成 ,在医学上可作解酸剂。常温下
,在医学上可作解酸剂。常温下 较稳定,加热时会分解生成
较稳定,加热时会分解生成 和MgO。MgO与
和MgO。MgO与 反应可制得
反应可制得 ,同时放出大量热。一种制备
,同时放出大量热。一种制备 的流程如图所示:请回答下列问题:
的流程如图所示:请回答下列问题:
(1)过氧化镁
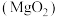 中氧元素的价态为
中氧元素的价态为 的化学反应方程式
的化学反应方程式(2)上述制备过程中加入稳定剂的作用是
 产品中常会混有少量MgO,实验室可通过多种方案测定样品中
产品中常会混有少量MgO,实验室可通过多种方案测定样品中 的含量。某研究小组拟用下图装置测定样品(含
的含量。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。
(3)研究小组的实验原理是(用化学方程式表示)
①
②
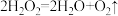 ,稀盐酸中加入
,稀盐酸中加入 溶液的作用是
溶液的作用是(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、
(5)该小组记录的实验数据如下,样品的质量为mg;反应开始前量气管的读数为amL;反应结束后量气管的读数为bmL,则样品中过氧化镁的质量分数为
 密度为
密度为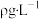 )
)
您最近一年使用:0次
2 . 下列四个选项对应的图像能正确反映对应变化关系的是
A. 在密闭容器中用红磷测定空气中氧气的含量 在密闭容器中用红磷测定空气中氧气的含量 |
B.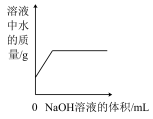 常温下向一定量的稀硫酸滴加氢氧化钠溶液 常温下向一定量的稀硫酸滴加氢氧化钠溶液 |
C.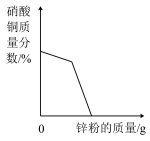 在一定量的硝酸银和硝酸铜的混合溶液中加入锌粉至过量 在一定量的硝酸银和硝酸铜的混合溶液中加入锌粉至过量 |
D.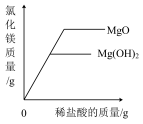 向等质量的氧化镁、氢氧化镁固体中,分别加入质量分数相同的稀盐酸至过量 向等质量的氧化镁、氢氧化镁固体中,分别加入质量分数相同的稀盐酸至过量 |
您最近一年使用:0次
3 . 某工厂生产硼砂产生的固体废料,主要含有MgCO3、CaCO3、SiO2、Al2O3和Fe2O3等,其中MgCO3质量分数为84%。采用以下工艺流程可回收固体废料中的镁资源。
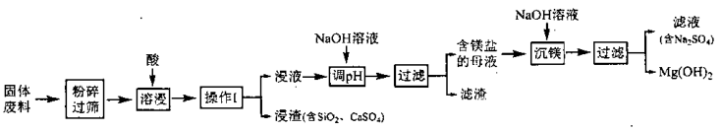
该工艺条件下,溶液中金属离子开始生成氢氧化物沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)将固体废料“粉碎过筛”后再进入“溶浸”环节的目的是______________________ 。
(2)“溶浸”时MgCO3发生反应的化学方程式为______________________ 。
(3) 下图是某学生在实验室模拟进行“操作I”的示意图,其操作不规范的是_______ (填标号)。
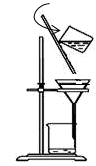
a.漏斗末端颈尖未紧靠烧杯壁 b. 玻璃棒用作引流
c. 将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(4)在“调pH”之前,“浸液”的pH______ 7 (填“>”、“<”或“=”);将该溶液的pH范围应调节为_____ ~8.9之间, 所得“滤渣”的主要成分是________ (填化学式)。
(5)写出“沉镁”的化学方程式_________________________ 。
(6)已知固体废料质量为m g,理论上可生产Mg(OH)2的质量为___ g。

该工艺条件下,溶液中金属离子开始生成氢氧化物沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀pH | 1.9 | 3.0 | 8.9 |
| 完全沉淀pH | 3.2 | 4.7 | 10.9 |
回答下列问题:
(1)将固体废料“粉碎过筛”后再进入“溶浸”环节的目的是
(2)“溶浸”时MgCO3发生反应的化学方程式为
(3) 下图是某学生在实验室模拟进行“操作I”的示意图,其操作不规范的是

a.漏斗末端颈尖未紧靠烧杯壁 b. 玻璃棒用作引流
c. 将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(4)在“调pH”之前,“浸液”的pH
(5)写出“沉镁”的化学方程式
(6)已知固体废料质量为m g,理论上可生产Mg(OH)2的质量为
您最近一年使用:0次
4 . 已知28gCuO和MgO的固体混合物与200mL某H2SO4溶液恰好完全反应,将反应后的溶液小心蒸干,得到固体68g。则原H2SO4溶液的物质的量浓度和原固体混合物中氧元素的质量分数分别是
| A.2.5 mol·L-1 28.57% | B.2.2 mol·L-1 23.07% |
| C.2.2 mol·L-1 24.55% | D.2.5 mol·L-1 18.37% |
您最近一年使用:0次
2020-09-05更新
|
515次组卷
|
6卷引用:上海市部分重点高中2020-2021学年高一上学期10月阶段性测试化学试题
名校
解题方法
5 . 镁的化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是________ ,还生成少量的________ (填化学式)。
(2)物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为_____________
A.3.2g B.4.0g C.4.2g D.4.6g
(3)镁作为一种强还原剂,还用于钛和铀的生产,写出镁与TiCl4在高温条件下制取钛的化学方程式_______________ 。
(4)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077),Mg2Cu与H2反应的化学方程式为___________ 。
(5)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是__________ ,该化合物水解时生成甲烷、氯化镁和氢氧化镁,请写出该反应的化学方程式______________________ 。
(1)单质镁在空气中燃烧的主要产物是
(2)物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为
A.3.2g B.4.0g C.4.2g D.4.6g
(3)镁作为一种强还原剂,还用于钛和铀的生产,写出镁与TiCl4在高温条件下制取钛的化学方程式
(4)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077),Mg2Cu与H2反应的化学方程式为
(5)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是
您最近一年使用:0次
名校
6 . 下列说法不正确的是
| A.“水玻璃”是建筑行业常用的一种黏合剂 |
| B.碘化银可用于人工降雨 |
| C.海水中氯的含量很高,因此被称作“海洋元素” |
| D.氧化镁具有很高的熔点,可做耐高温材料 |
您最近一年使用:0次
名校
7 . 氯酸镁常用作催熟剂、除草剂等,实验室制备Mg(C1O3)2·6H2O 的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
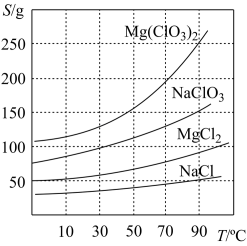
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
(1)过滤所需要的主要玻璃仪器有_________ 。
(2)加MgO后过滤所得滤渣的主要成分的化学式为_________ 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为__________ ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①________ ;______ ;洗涤;②将滤液冷却结晶;③过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299 g/mol)
步骤1:准确称量3.50g产品配成100 mL溶液。
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL1.000mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7 溶液滴定剩余的Fe2+至终点。反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00mL。
① 写出步骤2中发生反应的离子方程式__________ ;
② 产品中Mg(ClO3)2·6H2O的质量分数为_______ 。(保留到小数点后一位)

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有
(2)加MgO后过滤所得滤渣的主要成分的化学式为
(3)加入NaClO3饱和溶液后发生反应的化学方程式为
(4)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299 g/mol)
步骤1:准确称量3.50g产品配成100 mL溶液。
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL1.000mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7 溶液滴定剩余的Fe2+至终点。反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00mL。
① 写出步骤2中发生反应的离子方程式
② 产品中Mg(ClO3)2·6H2O的质量分数为
您最近一年使用:0次
名校
8 . 镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
(1)氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,能与水反应,常用作触媒,实验室欲用如图1所示装置和药品制备少量氮化镁。
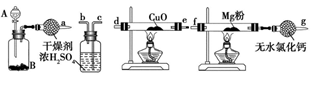
①A中盛装的是浓氨水,B中可盛装___ ,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接___ 、___ 接___ 、___ 接___ 。
③已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分,该反应的化学方程式为____________________ 。
④如果没有装有无水氯化钙的装置,可能发生反应的化学方程式为____________________ 。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。合成碳酸镁晶须的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到碳酸镁晶须产品(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1 MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、_____ 。
②步骤3中加氨水后反应的离子方程式为______________ 。
测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。
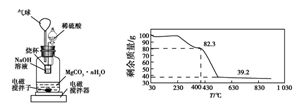
③图中气球的作用是__________________ 。
④上述反应后期要升温到30 ℃,主要目的是________________ 。
⑤若实验测得1.000 g碳酸镁晶须产生CO2的平均物质的量为a mol,则n为___ (用含a的表达式表示)。
⑥称取100 g上述晶须产品进行热重分析,得到的热重曲线如图所示,则合成的晶须中n=______ 。
(1)氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,能与水反应,常用作触媒,实验室欲用如图1所示装置和药品制备少量氮化镁。

①A中盛装的是浓氨水,B中可盛装
②按照气流的方向从左至右连接装置:a接
③已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分,该反应的化学方程式为
④如果没有装有无水氯化钙的装置,可能发生反应的化学方程式为
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。合成碳酸镁晶须的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到碳酸镁晶须产品(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1 MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、
②步骤3中加氨水后反应的离子方程式为
测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。

③图中气球的作用是
④上述反应后期要升温到30 ℃,主要目的是
⑤若实验测得1.000 g碳酸镁晶须产生CO2的平均物质的量为a mol,则n为
⑥称取100 g上述晶须产品进行热重分析,得到的热重曲线如图所示,则合成的晶须中n=
您最近一年使用:0次
2018-11-23更新
|
837次组卷
|
3卷引用:湖南省常德市芷兰实验学校2020届高三第二次月考化学试题
湖南省常德市芷兰实验学校2020届高三第二次月考化学试题(已下线)2018年11月25日 《每日一题》 人教版一轮复习-每周一测【全国百强校】湖南省长沙市长郡中学2019届高三上学期第五次调研考试化学试题
9 . 无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:


步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5 MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________ 。
实验中不能用干燥空气代替干燥N2,原因是___________ 。
(2)如将装置B改为装置C(图2),可能会导致的后果是___________ 。
(3)步骤3中,第一次过滤除去的物质是___________ 。
(4)有关步骤4的说法,正确的是___________ 。
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++ Y4-="===Mg" Y2-
①滴定前润洗滴定管的操作方法是__________ 。
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________ (以质量分数表示)。


步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5
 MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5请回答:
(1)仪器A的名称是
实验中不能用干燥空气代替干燥N2,原因是
(2)如将装置B改为装置C(图2),可能会导致的后果是
(3)步骤3中,第一次过滤除去的物质是
(4)有关步骤4的说法,正确的是
| A.可用95%的乙醇代替苯溶解粗品 | B.洗涤晶体可选用0℃的苯 |
| C.加热至160℃的主要目的是除去苯 | D.该步骤的目的是除去乙醚和可能残留的溴 |
Mg2++ Y4-="===Mg" Y2-
①滴定前润洗滴定管的操作方法是
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是
您最近一年使用:0次
2016-12-09更新
|
1494次组卷
|
6卷引用:2017届四川省成都树德中学高三10月月考化学卷
2017届四川省成都树德中学高三10月月考化学卷四川省雅安中学2018届高三上学期第一次月考化学试题【全国百强校】湖南省长沙市第一中学2019届高三下学期第七次月考理科综合化学试题2016年全国普通高等学校招生统一考试化学(浙江卷精编版)2016年全国普通高等学校招生统一考试化学(浙江卷参考版)(已下线)专题22.综合实验设计与评价-十年(2012-2021)高考化学真题分项汇编(浙江专用)
10 . 体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果。某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究。
已知:MgO+2HCl=MgCl2+H2O、MgCO3+2HCl=MgCl2+H2O+CO2↑。
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有______ 。
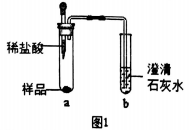
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是______________ 。小明按照修改后的实验方案重复上述实验,观察到b试管中无明显现象,证明“镁粉”中______________ 。
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5g三种固体粉末,每次取样方法如图2所示:
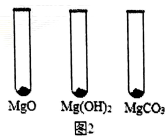
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
Mg(OH)2与盐酸发生中和反应的化学方程式为_____________ 。
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是____________________________________ 。
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5g_________ ,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL。由此可知“镁粉”中含有MgCO3的质量分数为___________ 。
已知:MgO+2HCl=MgCl2+H2O、MgCO3+2HCl=MgCl2+H2O+CO2↑。
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有

②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5g三种固体粉末,每次取样方法如图2所示:

逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5g
您最近一年使用:0次
2016-12-09更新
|
480次组卷
|
3卷引用:浙江省台州市五校联考2019年9月高一阶段性考试化学试题



