名校
1 . 为除去Fe2O3中的Al2O3,可选用的溶液是
| A.HCl | B.CH3COOH | C.NaOH | D.NH3·H2O |
您最近一年使用:0次
2018-01-11更新
|
253次组卷
|
6卷引用:上海市闵行区2018届高三上学期质量调研化学试题
上海市闵行区2018届高三上学期质量调研化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.10 金属及其化合物广东省肇庆市广宁第一中学2021届高三上学期9月月考化学试题(已下线)第15单元 实验设计与评价(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷上海市青浦区2021届高三等级考二模化学试题上海市建平中学2023-2024学年高一下学期期中教学质量检测化学试卷
名校
2 . 铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:

请回答下列问题:
(1)固体a的化学式为________ 。
(2)写出Ⅱ中加过量的烧碱涉及到的反应离子方程式______________ 、_____________ ;Ⅲ中通入足量CO2气体发生反应的离子方程式为_________________ 。
(3)由Ⅲ中得到滤液c的实验操作为__________ ,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________ 、冷却结晶、过滤洗涤。
(4)滤液c显________ 性,日常生活中常用其溶质来________________ (任写一点);
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________ 。

请回答下列问题:
(1)固体a的化学式为
(2)写出Ⅱ中加过量的烧碱涉及到的反应离子方程式
(3)由Ⅲ中得到滤液c的实验操作为
(4)滤液c显
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为
您最近一年使用:0次
2018-01-09更新
|
1556次组卷
|
3卷引用:广西陆川县中学2017-2018学年高一12月月考化学试题
名校
解题方法
3 . 下列说法正确的是( )
| A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物 |
| B.因为Al2O3是金属氧化物,所以它是碱性氧化物 |
| C.Al2O3能跟所有的酸碱溶液反应 |
| D.Al2O3能跟强的酸碱溶液反应 |
您最近一年使用:0次
2017-12-27更新
|
533次组卷
|
6卷引用:内蒙古巴彦淖尔市第一中学2017-2018学年高一12月月考化学试题(B卷)
内蒙古巴彦淖尔市第一中学2017-2018学年高一12月月考化学试题(B卷)(已下线)黄金30题系列 高一化学 小题易丢分(已下线)2018年11月2日 《每日一题》人教必修1-铝的重要化合物(已下线)第03章 铁 金属材料(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)人教版(2019)高一必修第一册 第三章 第二节课时1 合金的性质与应用河北省衡水街关中学2023-2024学年高一上学期十二月质量检测化学试题
名校
解题方法
4 . 已知铝土矿的主要成分是Al2O3,含有杂质SiO2(不溶于盐酸和水)、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)溶液A转化为溶液D发生的离子方程式为____________________ ;
(2)由物质M制取铝的化学方程式为____________________ ;
(3)溶液D中通入过量CO2生成沉淀F的离子方程式为____________________ ;
(4)沉淀C的成分是________________ ,逐滴向少量沉淀C中加入过量HI至沉淀全部溶解,所得溶液的颜色为______________ 。

请回答下列问题:
(1)溶液A转化为溶液D发生的离子方程式为
(2)由物质M制取铝的化学方程式为
(3)溶液D中通入过量CO2生成沉淀F的离子方程式为
(4)沉淀C的成分是
您最近一年使用:0次
2017-12-21更新
|
1381次组卷
|
3卷引用:江西省九江市第一中学2017-2018学年高一上学期第二次月考化学试题
江西省九江市第一中学2017-2018学年高一上学期第二次月考化学试题(已下线)【南昌新东方】江西省九江第一中学2017-2018学年高一上学期第二次月考化学试题安徽省定远县育才学校2020-2021学年高二上学期开学考试化学试题
5 . 在给定条件下,下列选项所示的物质间转化均能实现的是
A.饱和NaCl(aq)  NaHCO3 NaHCO3 Na2CO3 Na2CO3 |
B.Al2O3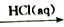 AlCl3(aq) AlCl3(aq)  无水AlCl3 无水AlCl3 |
C.H2SO4(浓) 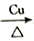 SO2 SO2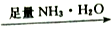 (NH4)2SO3(aq) (NH4)2SO3(aq) |
D.Cl2(g)  Ca(ClO)2 Ca(ClO)2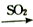 HClO HClO |
您最近一年使用:0次
2017-12-17更新
|
163次组卷
|
2卷引用:江苏省百校2018届高三12月大联考化学试题
6 . 下列说法不正确的是
A.工业制备镁的原理:MgO(熔融) Mg+O2↑ Mg+O2↑ |
| B.久置的硫酸亚铁溶液滴加KSCN溶液,溶液显淡红色 |
| C.SiO2中含Al2O3杂质,可加入足量HCl溶液然后过滤除去 |
| D.向氯化铵溶液加入浓氢氧化钠溶液,加热,产生的气体使湿润的pH试纸变蓝 |
您最近一年使用:0次
7 . 铝元素含量居金属首位,主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领域应用广泛。
Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□__________
②检验滤液B中是否还含有铁元素的方法为:_________________________
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________ (选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、__________ (填操作名称)、过滤、洗涤。
Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。
(1)明矾曾经是净水明星,用离子方程式表示其净水原理_____________________________ 。
(2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程______________ 。
Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□
②检验滤液B中是否还含有铁元素的方法为:
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、
Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。
(1)明矾曾经是净水明星,用离子方程式表示其净水原理
(2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程
您最近一年使用:0次
2017-11-30更新
|
915次组卷
|
4卷引用:山西省吕梁市2018届高三上学期第一次阶段性测试化学试题
山西省吕梁市2018届高三上学期第一次阶段性测试化学试题陕西省延安市吴起高级中学2019-2020学年高二下学期第三次质量检测化学试题(已下线)第6讲 铝及其化合物-2021年高考化学一轮复习名师精讲练安徽省定远县育才学校2021届高三8月月考化学试题
名校
8 . 既能与盐酸反应又能与氢氧化钠溶液反应的物质是
| A.Al2O3 | B.Fe2O3 | C.AlCl3 | D.Cu |
您最近一年使用:0次
2017-11-26更新
|
287次组卷
|
7卷引用:黑龙江省牡丹江市第一高级中学2017-2018学年高二上学期期中考试化学(文)试题
9 . 向铝粉中添加少量NH4Cl固体并充分混合,将其加热到1000℃时可与N2反应制备AlN,下列说法正确的是
| A.AlN是一种金属材料 |
| B.AlN与足量氢氧化钠溶液共热时生成氢氧化铝和氨气 |
| C.少量NH4Cl能够破坏Al表面的Al2O3薄膜 |
| D.AlN与足量盐酸反应的离子方程式为AlN+3H+=Al3++NH3↑ |
您最近一年使用:0次
2017-10-30更新
|
1160次组卷
|
4卷引用:江西省百所名校2018届高三第一次联合考试化学试题
10 . 轻质氧化镁是新型功能复合材料的重要添加剂,可由菱镁矿(含MgCO3、CaCO3、Fe2O3、Al2O3、SiO2)为原料制备,其制备流程如下:
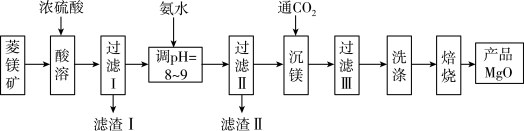
(1)酸溶时,为了提高酸溶速率可采用的措施有______ ;提高矿物的浸取率可采取的措施有______ 。(各答一条即可)
(2)浓硫酸与Al2O3反应的化学方程式为___________ ;滤渣I的主要成分为______ 和______ (填化学式)。
(3)用氨水调节溶液pH =8~9的目的是______ ,若氨水加的量较多使pH >9,则最终氧化镁的产量会______ (填“增大”“不变”或“减小”)。
(4)沉镁时发生反应的离子方程式为________________ 。
(5)流程中“焙烧”操作若在实验室中进行,样品应放在______ 中加热(填仪器名称),当______ 时,说明固体样品已分解完全。

(1)酸溶时,为了提高酸溶速率可采用的措施有
(2)浓硫酸与Al2O3反应的化学方程式为
(3)用氨水调节溶液pH =8~9的目的是
(4)沉镁时发生反应的离子方程式为
(5)流程中“焙烧”操作若在实验室中进行,样品应放在
您最近一年使用:0次
2017-09-10更新
|
732次组卷
|
2卷引用:“江淮十校”2018届高三第一次联考化学试题



