名校
1 . 金属铬常用于提升特种合金的性能。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有少量Al2O3)为原料制备金属铬的流程如图。下列说法不正确的是
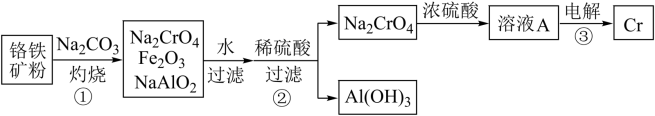

| A.①中需持续吹入空气作氧化剂 | B.A为Na2Cr2O7溶液 |
| C.②中需加入过量稀硫酸 | D.③中Cr在阴极生成 |
您最近一年使用:0次
2021-05-08更新
|
1093次组卷
|
8卷引用:湖南省益阳市箴言中学2021-2022学年高二上学期第三次月考化学试题
湖南省益阳市箴言中学2021-2022学年高二上学期第三次月考化学试题湖南省益阳市沅江市第一中学2022届高三下学期第二次模拟考试试题河南省洛阳市2021届高三5月第三次统一考试理综化学试题(已下线)基础卷02-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)(已下线)一轮巩固卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)(已下线)专题14物质的反应和转化-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题13物质的反应和转化-2022年高考真题+模拟题汇编(全国卷)(已下线)专题14物质的反应和转化-五年(2018~2022)高考真题汇编(全国卷)
2 . 下列有关物质的性质与用途具有对应关系的是
A. 硬度大,可用作光导纤维 硬度大,可用作光导纤维 |
| B.Li质量轻、比能量大,可用作电池正极材料 |
C. 有漂白性,可用作葡萄酒的添加剂 有漂白性,可用作葡萄酒的添加剂 |
D. 有弱碱性,可用于中和胃酸 有弱碱性,可用于中和胃酸 |
您最近一年使用:0次
2022-05-31更新
|
806次组卷
|
9卷引用:湖南省长沙市长郡中学2022届高三模拟考试(二)化学试题
湖南省长沙市长郡中学2022届高三模拟考试(二)化学试题(已下线)专题06 元素化合物及其性质-备战2023年高考化学母题题源解密(全国通用)(已下线)2022年江苏卷高考真题变式题1-13江苏省南京镇江八校2023届高三上学期第一次联考化学试题上海市复兴高级中学2022-2023学年高三上学期10月月考化学试题江苏省建湖高级中学2023-2024学年高三上学期暑期学情检测(一)化学试题(已下线)选择题1-5湖北省武汉市新洲区部分学校2023-2024学年高三上学期期中考试化学试题江苏省张家港市沙洲中学2023-2024学年高二下学期3月阶段性测试化学试题
3 . 由下列实验操作及现象所得结论错误的是
| 实验操作及现象 | 结论 | |
| A | 向酸性KMnO4溶液中滴加H2O2溶液,紫红色褪去 | H2O2具有漂白性 |
| B | 向待测溶液中加入淀粉溶液,无明显变化,再加入新制氯水,变蓝 | 待测溶液中有I-存在 |
| C | 向Al2(SO4)3溶液中逐滴加入NaOH溶液至过量,先生成白色沉淀,后沉淀消失 | Al(OH)3具有酸性 |
| D | 向AgCl悬浊液中,加入少量Na2S溶液,白色沉淀转化为黑色沉淀 | Ag2S溶解度小于AgCl |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-25更新
|
1323次组卷
|
7卷引用:湖南省长沙市宁乡市2021-2022学年高二下学期期末考试化学试题
湖南省长沙市宁乡市2021-2022学年高二下学期期末考试化学试题重庆市2021年普通高中学业水平选择考适应性测试化学试题四川省邻水实验学校2021届高三下学期3月开学考试理综化学试题(已下线)第27讲 物质的制备与性质实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)热点题型特训 实验方案中逻辑关系的匹配判断黑龙江省哈尔滨师范大学青冈实验中学校2023-2024学年高三上学期12月份考试化学试题
4 . 化学与生活密切相关,下列不涉及化学变化的是
| A.沙里淘金 | B.自来水加入 消毒 消毒 |
| C.粮食酿酒 | D. 治疗胃酸过多 治疗胃酸过多 |
您最近一年使用:0次
5 . 化学与生产、生活等密切相关,下列有关说法中错误的是
| A.碳酸镁和氢氧化铝等均可作抗酸胃药 | B.漂白液、漂白粉的有效成分均是次氯酸钙 |
| C.CO、甲醛等都是室内空气污染物 | D.中和法和沉淀法是常用的工业污水处理方法 |
您最近一年使用:0次
2022-06-05更新
|
209次组卷
|
4卷引用:2022年湖南卷高考真题变式题(1-10)
(已下线)2022年湖南卷高考真题变式题(1-10)湖北省新高考部分校2021-2022学年高三下学期5月质量检测化学试题湖北省九师联盟2022届高三5月质量检测化学试题(已下线)专题02 突破化学与生产生活(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
解题方法
6 . 钠、铝、铁是三种重要的金属,三种金属及其化合物在生活生产中有重要作用。请回答下列问题:
(1)将一小块钠投入到CuCl2溶液中,观察到的现象是____ 。
(2)工业上通过以下反应生产高铁酸钠(Na2FeO4):3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O,此反应中氧化剂和还原剂的物质的量之比为____ 。
(3)胃舒平是日常生活中常用的抗酸药,其成分含有Al(OH)3,其抗酸原理是(用离子方程式表示)____ 。
(4)Fe在Cl2燃烧,所得产物的化学式是____ 。将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成____ 色。
b.向另一支试管中滴加NaOH溶液,其反应的化学方程式为____ 。
(5)向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入100 mL2 mol·L-1的盐酸,恰好完全反应,放出11.2 mL(标准状况)气体,所得溶液加入KSCN溶液不变红色。用足量的CO在高温下还原相同质量的此混合物,所得铁的质量为____ g。
(1)将一小块钠投入到CuCl2溶液中,观察到的现象是
| A.钠溶解,有铜析出并有气体产生 | B.只有气体产生 |
| C.只有沉淀产生 | D.既有气体产生,又有蓝色沉淀产生 |
(3)胃舒平是日常生活中常用的抗酸药,其成分含有Al(OH)3,其抗酸原理是(用离子方程式表示)
(4)Fe在Cl2燃烧,所得产物的化学式是
a.若向其中一支试管中滴加KSCN溶液,则溶液变成
b.向另一支试管中滴加NaOH溶液,其反应的化学方程式为
(5)向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入100 mL2 mol·L-1的盐酸,恰好完全反应,放出11.2 mL(标准状况)气体,所得溶液加入KSCN溶液不变红色。用足量的CO在高温下还原相同质量的此混合物,所得铁的质量为
您最近一年使用:0次
解题方法
7 . 下列关于药物的说法正确的是
| A.药物的服用剂量越大,治疗效果越明显 |
| B.包装上印有“OTC”标志的药品属于处方药 |
| C.氢氧化铝可作为抑酸剂,用于治疗胃酸过多 |
| D.长期大量服用阿司匹林可预防某些疾病,没有副作用 |
您最近一年使用:0次
解题方法
8 . 探究氢氧化铝的两性,最适宜的试剂是
| A.AlCl3、氨水、稀盐酸 | B.Al2O3、氨水、稀盐酸 |
| C.Al、NaOH溶液、稀盐酸 | D.Al2(SO4)3溶液、NaOH溶液、稀盐酸 |
您最近一年使用:0次
名校
解题方法
9 . 下列溶液不能 和氢氧化铝反应的是
| A.盐酸 | B.氢氧化钠 | C.氯化钠 | D.硫酸 |
您最近一年使用:0次
2021-11-12更新
|
365次组卷
|
2卷引用:湖南省涟源市第二中学2021-2022学年高一上学期12月月考化学试题
解题方法
10 . 重铬酸钾( ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:
步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
步骤Ⅳ.纯度测定
利用库仑滴定法测定 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度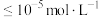 ,则认为该微粒已除尽。
,则认为该微粒已除尽。

回答下列问题:
(1)仪器A为_______(填标号)。
(2)若用 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的_______ 倍。
(3)步骤I中“分批加入”的目的是_______ 。
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是_______ 。
(5)进一步提纯步骤Ⅲ所得晶体的方法是_______ 。
(6)探究pH对 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。
(7) 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:
试解释键能 的原因
的原因_______ 。
(8) 固体样品的纯度为
固体样品的纯度为_______ (用含m的式子表示)。
 ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6
 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。步骤Ⅳ.纯度测定
利用库仑滴定法测定
 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度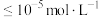 ,则认为该微粒已除尽。
,则认为该微粒已除尽。
回答下列问题:
(1)仪器A为_______(填标号)。
| A.普通坩埚 | B. 坩埚 坩埚 | C.氮化硅坩埚 | D.石英坩埚 |
 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的(3)步骤I中“分批加入”的目的是
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是
(5)进一步提纯步骤Ⅲ所得晶体的方法是
(6)探究pH对
 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。| 实验操作 | 实验现象 | 实验结论 |
向酸化的 溶液中加入一定量甲醇 溶液中加入一定量甲醇 | 溶液形成蓝紫色溶液,并产生无色无味的气体 | |
向碱化的 溶液中加入相同量甲醇 溶液中加入相同量甲醇 | 酸性条件下 溶液的氧化性更强 溶液的氧化性更强 |
 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:| 化学键 | F-F | C1-Cl | Br-Br |
键能/( ) ) | 157 | 242.7 | 193.7 |
 的原因
的原因(8)
 固体样品的纯度为
固体样品的纯度为
您最近一年使用:0次



