名校
解题方法
1 . 下列各实验的现象及结论都正确的是
| 选项 | 实验 | 现象 | 结论 |
| A | 浓硫酸滴入蔗糖中,产生的气体导入澄清石灰水 | 蔗糖变黑,体积膨胀,澄清石灰水变浑浊 | 浓硫酸具有脱水性和强氧化性 |
| B | 铜粉加入稀硫酸中,加热;再加入少量硝酸钾固体 | 加热时无明显现象,加入硝酸钾后溶液变蓝 | 硝酸钾起催化作用 |
| C | 有无色气泡产生,溶液呈血红色 | 稀硝酸将Fe氧化成Fe3+ | |
| D | 向BaCl2溶液中通入SO2气体 | 产生白色沉淀 | 沉淀为BaSO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 部分含Fe物质的分类与相应化合价的关系如图所示。下列推断不合理的是

| A.可存在a→e→b的转化 | B.e溶液可与KSCN溶液反应生成红色沉淀 |
| C.能用a制作的容器运输浓硫酸 | D.a可与稀硝酸恰好反应,生成只含b的溶液 |
您最近一年使用:0次
2024-03-21更新
|
329次组卷
|
2卷引用:广东省广州奥林匹克中学2023-2024学年高二下学期4月期中考试化学试题
解题方法
3 . 下列各组离子在溶液中能大量共存的是
A.能使石蕊试液变红的溶液中: |
B. |
C.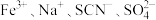 |
D.在常温下,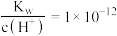 的溶液中: 的溶液中: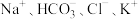 |
您最近一年使用:0次
名校
解题方法
4 . PAFC是一种水净化处理剂,常用在沉淀池,其主要成分是聚合氯化铝铁 。工业上制备该产品,是向工业废料(
。工业上制备该产品,是向工业废料( )中加入盐酸使其全部溶解,具体流程如图。
)中加入盐酸使其全部溶解,具体流程如图。
 。工业上制备该产品,是向工业废料(
。工业上制备该产品,是向工业废料( )中加入盐酸使其全部溶解,具体流程如图。
)中加入盐酸使其全部溶解,具体流程如图。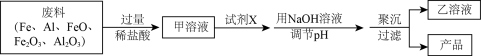
A.产品中铁元素的化合价为 | B.甲溶液不一定存在 |
| C.PAFC净水的原理是利用其较强的氧化性 | D.试剂 可以使用新制氯水 可以使用新制氯水 |
您最近一年使用:0次
2024-02-04更新
|
74次组卷
|
2卷引用:广东省深圳市高级中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
5 . 为探究 溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制:50 mL 1.0 mol⋅L-1的 溶液,测其pH约为0.7,即
溶液,测其pH约为0.7,即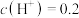 mol⋅L-1。用离子方程式解释
mol⋅L-1。用离子方程式解释 溶液呈酸性的原因:
溶液呈酸性的原因:___________ 。
(2)小组同学利用上述 溶液探究其与足量锌粉的反应。实验操作及现象如表:
溶液探究其与足量锌粉的反应。实验操作及现象如表:
已知:Zn的性质与Al相似,能发生反应:
①红褐色沉淀是:___________ (填化学式),结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:___________ 。
②反应后溶液为浅绿色,写出相关反应的离子方程式:___________ 。
③分离出黑色固体,经下列实验证实了其中含有的主要物质。
ⅰ.黑色固体可以被磁铁吸引;
ⅱ.向黑色固体中加入足量的NaOH溶液,产生气泡;
ⅲ.将ⅱ中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
ⅳ.向ⅲ反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是___________ 。
b.小组同学认为上述实验无法确定黑色固体中是否含有 ,理由是
,理由是___________ 。
(3)为进一步探究上述1.0 mol⋅L-1 溶液中
溶液中 和
和 氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
小组同学得出结论:在1.0 mol⋅L-1  溶液中,
溶液中, 的氧化性比
的氧化性比 更强。
更强。
 溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
溶液中的离子平衡和离子反应,某小组同学进行了如下实验。(1)配制:50 mL 1.0 mol⋅L-1的
 溶液,测其pH约为0.7,即
溶液,测其pH约为0.7,即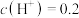 mol⋅L-1。用离子方程式解释
mol⋅L-1。用离子方程式解释 溶液呈酸性的原因:
溶液呈酸性的原因:(2)小组同学利用上述
 溶液探究其与足量锌粉的反应。实验操作及现象如表:
溶液探究其与足量锌粉的反应。实验操作及现象如表:| 操作 | 现象 |
向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L 的 的 溶液,搅拌 溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |

①红褐色沉淀是:
②反应后溶液为浅绿色,写出相关反应的离子方程式:
③分离出黑色固体,经下列实验证实了其中含有的主要物质。
ⅰ.黑色固体可以被磁铁吸引;
ⅱ.向黑色固体中加入足量的NaOH溶液,产生气泡;
ⅲ.将ⅱ中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
ⅳ.向ⅲ反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是
b.小组同学认为上述实验无法确定黑色固体中是否含有
 ,理由是
,理由是(3)为进一步探究上述1.0 mol⋅L-1
 溶液中
溶液中 和
和 氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
氧化性的相对强弱,继续实验并观察到反应开始时现象如表:| 操作 | 现象 |
将5 mL 1.0 mol⋅L-1的 溶液与0.65 g锌粉混合 溶液与0.65 g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
| 将 | 溶液中立即产生大量气泡 |
 溶液中,
溶液中, 的氧化性比
的氧化性比 更强。
更强。
您最近一年使用:0次
6 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 常温下,用pH计分别测定同浓度的CH3COONH4溶液和NaCl溶液的pH,pH均为7 | 两溶液中水的电离程度相同 |
| B | 常温下,用pH计分别测定相同浓度的NaClO溶液和CH3COONa溶液的酸碱性,NaClO溶液pH较大 | 酸性:HClO < CH3COOH |
| C | 室温下,向 FeCl3 溶液中滴加少量 KI 溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+ 的还原性比 I2 的强 |
| D | 向10 mL 0.2 mol/L NaOH溶液中滴加2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,生成红褐色沉淀 | 相同温度下Ksp:Mg(OH)2>Fe(OH)3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 回答下列问题:
【实验I】影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响。
药品: 、
、 、
、 和不同浓度的硫酸(0.5
和不同浓度的硫酸(0.5 、2
、2 、18.4
、18.4 );装置如图。
);装置如图。
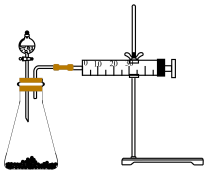
(1)实验前,检查该装置的气密性的方法是:___________ 。
(2)用此装置进行定量实验,应选用的上述实验药品是:
第一组:___________ 和___________ 。
第二组:___________ 和___________ 。
(3)应该测定的实验数据是气体从反应开始到推动活塞达到30 刻度时的
刻度时的___________ 。
(4)此实验忽视了影响反应速率的其他因素是(假设金属颗粒是均匀的):___________ 。
【实验II】已知反应: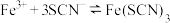
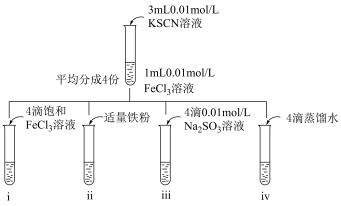
(5)i中现象为___________ 。
(6)ii中血红色褪去,结合离子反应和平衡移动解释原因___________ 。
(7)已知存在反应: ,设计实验iii和iv的目的是:
,设计实验iii和iv的目的是:___________ ,则证明iii中 影响平衡逆向移动的准确实验现象描述是
影响平衡逆向移动的准确实验现象描述是___________ 。
【实验I】影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响。
药品:
 、
、 、
、 和不同浓度的硫酸(0.5
和不同浓度的硫酸(0.5 、2
、2 、18.4
、18.4 );装置如图。
);装置如图。
(1)实验前,检查该装置的气密性的方法是:
(2)用此装置进行定量实验,应选用的上述实验药品是:
第一组:
第二组:
(3)应该测定的实验数据是气体从反应开始到推动活塞达到30
 刻度时的
刻度时的(4)此实验忽视了影响反应速率的其他因素是(假设金属颗粒是均匀的):
【实验II】已知反应:

(5)i中现象为
(6)ii中血红色褪去,结合离子反应和平衡移动解释原因
(7)已知存在反应:
 ,设计实验iii和iv的目的是:
,设计实验iii和iv的目的是: 影响平衡逆向移动的准确实验现象描述是
影响平衡逆向移动的准确实验现象描述是
您最近一年使用:0次
8 . 等体积的0.3mol/L的FeCl3溶液和0.4mol/L的NaI溶液混合,能证明溶液中存在化学平衡“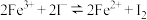 ”的试剂,除了淀粉溶液外,还需要用到下列中的
”的试剂,除了淀粉溶液外,还需要用到下列中的
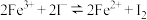 ”的试剂,除了淀粉溶液外,还需要用到下列中的
”的试剂,除了淀粉溶液外,还需要用到下列中的| A.KSCN溶液 | B.AgNO3溶液 | C.Na2SO4溶液 | D.BaCl2溶液 |
您最近一年使用:0次
解题方法
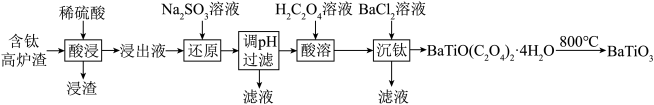
9 . 以含钛高炉渣(主要成分为 ,还含有少量CaO、Fe2O3、
,还含有少量CaO、Fe2O3、 )为原料生产
)为原料生产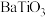 的工艺流程如下:
的工艺流程如下:
已知:
①浸出液的pH小于0.5
②相关金属离子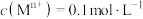 时,形成氢氧化物沉淀的pH范围如下:
时,形成氢氧化物沉淀的pH范围如下:
请回答以下问题:
(1)“浸渣”的主要成分为___________ (填化学式)。
(2)为了提高“酸浸”的浸取率,可采取的措施为___________ (任写一条)。
(3)加入 时所发生氧化还原反应的离子方程式为
时所发生氧化还原反应的离子方程式为___________ 。
 ,还含有少量CaO、Fe2O3、
,还含有少量CaO、Fe2O3、 )为原料生产
)为原料生产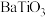 的工艺流程如下:
的工艺流程如下:
已知:
①浸出液的pH小于0.5
②相关金属离子
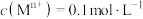 时,形成氢氧化物沉淀的pH范围如下:
时,形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |
| 开始沉淀的pH | 0.5 | 6.3 | 1.5 |
| 沉淀完全的pH | 2.5 | 8.3 | 2.8 |
(1)“浸渣”的主要成分为
(2)为了提高“酸浸”的浸取率,可采取的措施为
(3)加入
 时所发生氧化还原反应的离子方程式为
时所发生氧化还原反应的离子方程式为
您最近一年使用:0次
名校
10 . 将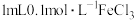 溶液与
溶液与 混合,充分反应后将溶液分成四份,分别向①、②、③、④份混合溶液中加入2滴
混合,充分反应后将溶液分成四份,分别向①、②、③、④份混合溶液中加入2滴 试液、
试液、 溶液、淀粉试液、
溶液、淀粉试液、 溶液,其中能较好地证明
溶液,其中能较好地证明 与
与 之间发生了反应且为可逆反应的实验是
之间发生了反应且为可逆反应的实验是
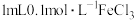 溶液与
溶液与 混合,充分反应后将溶液分成四份,分别向①、②、③、④份混合溶液中加入2滴
混合,充分反应后将溶液分成四份,分别向①、②、③、④份混合溶液中加入2滴 试液、
试液、 溶液、淀粉试液、
溶液、淀粉试液、 溶液,其中能较好地证明
溶液,其中能较好地证明 与
与 之间发生了反应且为可逆反应的实验是
之间发生了反应且为可逆反应的实验是| A.①② | B.①③ | C.②④ | D.③④ |
您最近一年使用:0次
2023-09-26更新
|
204次组卷
|
3卷引用:广东省深圳外国语学校2023-2024学年高二上学期10月月考化学试题



