名校
解题方法
1 . 无水三氯化铁是有机合成的催化剂,为棕黄色固体,易潮解产生白雾,300℃左右时升华。实验室可用氯气与铁反应制备无水三氯化铁,下图是甲组学生设计的制备装置。
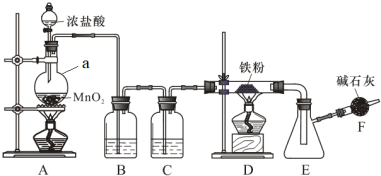
回答下列问题:
(1)仪器a的名称是___________ ;a中反应的离子方程式为___________ 。
(2)装置B的作用是___________ ,C中盛装试剂是___________ 。
(3)当出现什么现象时点燃装置D处酒精灯___________ 。装置D与E之间用粗导管连接,原因是___________ ;
(4)装置F的作用是___________ 。
(5)称取2.8 g该铁屑,最终制得无水三氯化铁6.5 g,则该反应的产率为___________ 。
(6)与甲组设计对比,乙组同学去掉了装置C.实验时无论怎样改变铁粉的用量,装置D中都有少量的黑色固体残留。乙组同学猜测该黑色固体可能是___________ 。
(7)已知氧化性: ,请设计简单实验证明该结论
,请设计简单实验证明该结论___________ 。

回答下列问题:
(1)仪器a的名称是
(2)装置B的作用是
(3)当出现什么现象时点燃装置D处酒精灯
(4)装置F的作用是
(5)称取2.8 g该铁屑,最终制得无水三氯化铁6.5 g,则该反应的产率为
(6)与甲组设计对比,乙组同学去掉了装置C.实验时无论怎样改变铁粉的用量,装置D中都有少量的黑色固体残留。乙组同学猜测该黑色固体可能是
(7)已知氧化性:
 ,请设计简单实验证明该结论
,请设计简单实验证明该结论
您最近一年使用:0次
2024-03-02更新
|
133次组卷
|
2卷引用:四川省 绵阳市东辰学校2023-2024学年高一上学期化学期末复习综合模拟试题1
2 . 三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O(M=491g/mol)是一种感光剂和高效的污水处理剂。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:
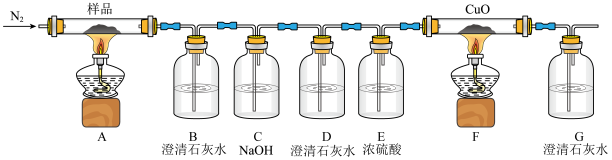
(1)C中NaOH溶液的作用为___________ ;D中澄清石灰水作用为___________ 。
(2)证明有CO产生的现象为___________ 。
(3)该装置还存在的缺陷是___________ 。
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:
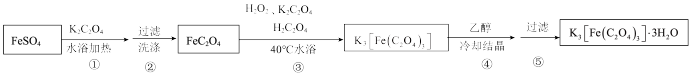
研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为___________ 。
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、 构成;
构成;
乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:___________ 。
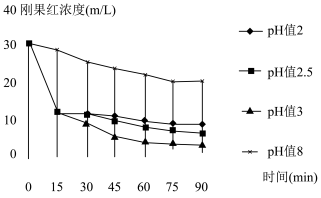
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=___________ 。
(7)关于制备流程,下列说法正确的是___________。
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O
①写出Fe2+与酸性KMnO4溶液反应的离子方程式:___________ 。
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为___________ 。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:

(1)C中NaOH溶液的作用为
(2)证明有CO产生的现象为
(3)该装置还存在的缺陷是
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:

研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、
 构成;
构成;乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=

(7)关于制备流程,下列说法正确的是___________。
| A.步骤①为复分解反应,步骤③为氧化还原反应 |
| B.步骤②判断沉淀是否洗涤干净,可以取少量最后一次洗涤液,加入氯化钡溶液,观察是否有白色沉淀产生 |
| C.步骤④,加入乙醇目的在于降低K3[Fe(C2O4)3]的溶解度,使其结晶析出 |
| D.步骤④⑤可以在日光下进行 |
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知
 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O①写出Fe2+与酸性KMnO4溶液反应的离子方程式:
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为
您最近一年使用:0次
名校
解题方法
3 . 碘化亚铁( )在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。
)在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。 )
)
(1)装置中盛碱石灰的仪器名称为___________ 。若无此装置,写出铁粉参与的副反应的化学方程式:___________ 。
(2)收集器浸泡在冷水中的原因是___________ 。
(3)试剂a为___________ ,其作用是___________ 。
Ⅱ.化学兴趣小组为了探究 的还原性,进行了如下实验:取一定量的
的还原性,进行了如下实验:取一定量的 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
甲同学认为:是因为被 氧化成
氧化成 ;乙同学认为:是因为被
;乙同学认为:是因为被 氧化成
氧化成 。
。
随后化学兴趣小组进行如下实验进行验证。
(4)上述实验②中现象为___________ 。化学兴趣小组得到的结论: 的还原性
的还原性___________  的还原性(填“>”、“<”或“=”)。
的还原性(填“>”、“<”或“=”)。
(5)依据(4)中所得结论,往含 的溶液中通入
的溶液中通入 标准状况下的氯气,充分反应,请写出该反应的离子方程式:
标准状况下的氯气,充分反应,请写出该反应的离子方程式:___________ 。
 )在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。
)在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。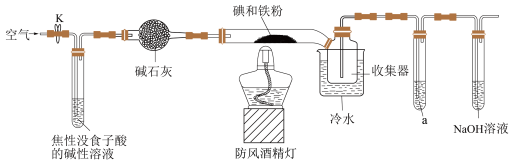
 )
)(1)装置中盛碱石灰的仪器名称为
(2)收集器浸泡在冷水中的原因是
(3)试剂a为
Ⅱ.化学兴趣小组为了探究
 的还原性,进行了如下实验:取一定量的
的还原性,进行了如下实验:取一定量的 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:甲同学认为:是因为被
 氧化成
氧化成 ;乙同学认为:是因为被
;乙同学认为:是因为被 氧化成
氧化成 。
。随后化学兴趣小组进行如下实验进行验证。
| 实验步骤 | 现象 | 结论 |
| ①取少量黄色溶液于试管中,滴加淀粉溶液 | 试管中溶液变蓝色 | 甲同学观点正确 |
| ②取少量黄色溶液于试管中,滴加KSCN溶液 | 乙同学观点不正确 |
(4)上述实验②中现象为
 的还原性
的还原性 的还原性(填“>”、“<”或“=”)。
的还原性(填“>”、“<”或“=”)。(5)依据(4)中所得结论,往含
 的溶液中通入
的溶液中通入 标准状况下的氯气,充分反应,请写出该反应的离子方程式:
标准状况下的氯气,充分反应,请写出该反应的离子方程式:
您最近一年使用:0次
2024-01-13更新
|
292次组卷
|
3卷引用:湖南省郴州市“十校联盟”2023-2024学年高一上学期期末模拟考试化学试题
解题方法
4 . 下列说法错误的是


| A.用如图所示装置可以制备Fe(OH)2 |
| B.检验红砖中的氧化铁:向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加2~3滴KSCN溶液 |
| C.向某溶液中滴加KSCN溶液,溶液不变色,滴加少量稀HNO3后溶液显红色,此现象不能确定原溶液中含有Fe2+ |
| D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
您最近一年使用:0次
解题方法
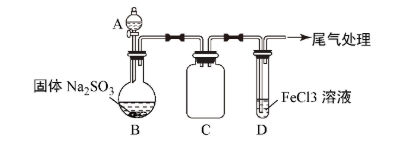
5 . 某校化学兴趣小组探究 与
与 溶液的反应,装置如下图所示。
溶液的反应,装置如下图所示。
已知:
ⅰ.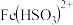 为红棕色,它可以将
为红棕色,它可以将 还原为
还原为 。
。
ⅱ.生成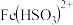 的反应为:
的反应为: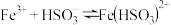 。
。
步骤一:实验准备
如上图连接装置,并配制100 mL 1.0mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D中。
(1)配制100 mL 1.0mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和___________ ,装置C的作用为___________ 。
步骤二:预测实验
(2)该小组同学预测 与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为___________ 。
步骤三:动手实验
(3)当将 通入FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
通入FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
① 与FeCl3溶液反应生成了
与FeCl3溶液反应生成了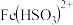 的实验证据为
的实验证据为___________ 。证明浅绿色溶液中含有 的实验操作为:
的实验操作为:___________ 。
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
综合上述实验探究过程,得出的结论为___________ 。
步骤四:反思实验
(4)在制备 的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是
的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是___________ 。
 与
与 溶液的反应,装置如下图所示。
溶液的反应,装置如下图所示。
已知:
ⅰ.
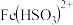 为红棕色,它可以将
为红棕色,它可以将 还原为
还原为 。
。ⅱ.生成
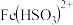 的反应为:
的反应为: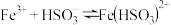 。
。步骤一:实验准备
如上图连接装置,并配制100 mL 1.0mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D中。
(1)配制100 mL 1.0mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
步骤二:预测实验
(2)该小组同学预测
 与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为
步骤三:动手实验
(3)当将
 通入FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
通入FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。①
 与FeCl3溶液反应生成了
与FeCl3溶液反应生成了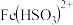 的实验证据为
的实验证据为 的实验操作为:
的实验操作为:②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
| 实验Ⅰ | 往5mL1mol·L-1 溶液中通入 溶液中通入 气体,溶液立即变为红棕色。微热3min,溶液颜色变为浅绿色。 气体,溶液立即变为红棕色。微热3min,溶液颜色变为浅绿色。 |
| 实验Ⅱ | 往5mL重新配制的1mol·L-1 溶液(用浓盐酸酸化)中通入 溶液(用浓盐酸酸化)中通入 气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
步骤四:反思实验
(4)在制备
 的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是
的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是
您最近一年使用:0次
名校
6 . 无水FeCl3呈棕红色,极易潮解,100 ℃左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。
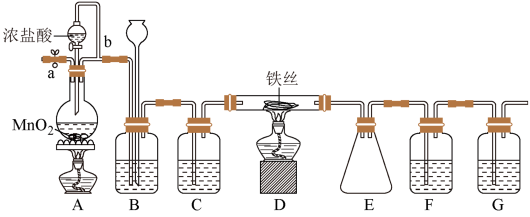
(1)装置A中反应的离子方程式为________________ 。
(2)装置C中所加的试剂为____________ 。
(3)导管b的作用为___________ ;装置G的作用为________ 。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,是因为_____ 。
(5)为检验所得产品为FeCl3,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入____________ ,___________ (填试剂和现象)。

(1)装置A中反应的离子方程式为
(2)装置C中所加的试剂为
(3)导管b的作用为
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,是因为
(5)为检验所得产品为FeCl3,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入
您最近一年使用:0次
2019-10-14更新
|
453次组卷
|
6卷引用:甘肃省甘谷第一中学2020届高三上学期第一次检测化学试题
甘肃省甘谷第一中学2020届高三上学期第一次检测化学试题海南省儋州市第一中学2020届高三上学期第二次月考化学试卷江西省南昌市第十中学2020届高三上学期期中考试化学试题河南省商丘市虞城高中2020届高三11月月考化学试题(已下线)3.1.2 铁及其化合物之间的转化关系练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)江西省丰城市第九中学2020届高三上学期期中考试化学试题
名校
解题方法
7 . 工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4 Fe2O3+SO2↑+SO3↑。为检验FeSO4高温分解的产物,进行如下实验:
Fe2O3+SO2↑+SO3↑。为检验FeSO4高温分解的产物,进行如下实验:
①取少量FeSO4高温分解得到的固体,加一定量稀盐酸溶解,向该溶液中加入适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
②将FeSO4高温分解产生的气体通入如图所示的装置中,以检验产生的气体中是否含有SO2、SO3。
请回答下列问题:

(1)写出KSCN溶液与Fe3+反应的离子方程式:____ 。
(2)操作②中观察到的现象和结论是____ ;_____ 。
(3)操作②中最后要将通过品红溶液的气体通入NaOH溶液中的原因是___ ,有关反应的离子方程式____ 。
 Fe2O3+SO2↑+SO3↑。为检验FeSO4高温分解的产物,进行如下实验:
Fe2O3+SO2↑+SO3↑。为检验FeSO4高温分解的产物,进行如下实验:①取少量FeSO4高温分解得到的固体,加一定量稀盐酸溶解,向该溶液中加入适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
②将FeSO4高温分解产生的气体通入如图所示的装置中,以检验产生的气体中是否含有SO2、SO3。
请回答下列问题:

(1)写出KSCN溶液与Fe3+反应的离子方程式:
(2)操作②中观察到的现象和结论是
(3)操作②中最后要将通过品红溶液的气体通入NaOH溶液中的原因是
您最近一年使用:0次
8 . 下列相关实验操作、实验现象描述或实验目的表达正确的是
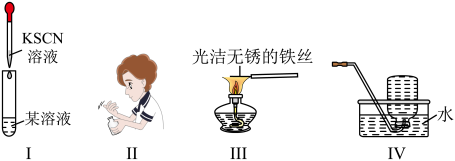
A.图Ⅰ中:证明某溶液中是否含有 | B.图Ⅱ中:闻 的气味 的气味 |
| C.图Ⅲ中:焰色试验检验固体中是否含有钾元素 | D.图Ⅳ中:实验室收集 |
您最近一年使用:0次
2024-01-26更新
|
71次组卷
|
2卷引用:湖南省岳阳市2023-2024学年高一上学期期末考试化学试题
名校
9 . 下列实验目的、方案设计和现象、结论都正确的是
| 选项 | 实验目的 | 方案设计和现象 | 结论 |
| A | 探究钠在空气中久置后所得固体成分 | 取少量固体,加入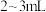 蒸馏水,有气体产生 蒸馏水,有气体产生 | 固体中一定含 |
| B | 比较 、 、 和 和 的氧化性 的氧化性 | 向酸性 溶液中滴入 溶液中滴入 溶液,紫红色溶液变浅并伴有黄绿色气体产生 溶液,紫红色溶液变浅并伴有黄绿色气体产生 | 氧化性: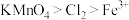 |
| C | 检验某溶液中是否含有 | 取少量待检液于试管中,滴加新制氯水后滴加 溶液,溶液变为红色 溶液,溶液变为红色 | 该溶液含有 |
| D | 验证某固体是 还是 还是 | 室温下取少量固体于试管中,插入温度计,加几滴水,温度升高 | 该固体是 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
10 . 某化学学习小组欲探究铁及其化合物的氧化性和还原性,请你协助他们完成实验报告。
实验目的:探究铁及其化合物的氧化性和还原性
实验设计及仪器:FeCl2 溶液、FeCl3 溶液、氯水、KSCN 溶液、铁粉、锌片、铜片、稀硫酸、胶头滴管、试管
(1). 实验记录(仿照①实验作答,填写划线部分)
(2). 学习小组的同学将从本实验中获得的知识推广到其他类物质的学习,请判断下列物质既有氧化性又有还原性的是_______ (填写选项字母)
A.Cl2 B.Na C.Mg2+ D.H2O2
(3). 在实验②中,有部分同学在氯化亚铁溶液中滴入硫氰化钾溶液后出现血红色,你认为是什么原因____ ,你对实验员在配制氯化亚铁溶液时提出的建议是_____ 。
(4). 在配制氯化铁溶液时,含有少量 Fe2+,为检验少量 Fe2+的存在,请从下列物质中选择合适的试剂_______ (填写选项字母)
A.AgNO3溶液 B.稀盐酸 C.KMnO4 溶液 D.NaOH溶液
实验目的:探究铁及其化合物的氧化性和还原性
实验设计及仪器:FeCl2 溶液、FeCl3 溶液、氯水、KSCN 溶液、铁粉、锌片、铜片、稀硫酸、胶头滴管、试管
(1). 实验记录(仿照①实验作答,填写划线部分)
| 序号 | 实验设计 | 实验现象 | 离子方程式 | 解释与结论 |
| ① | 在铁粉中滴入稀硫酸 | 铁粉溶解,溶液由无色变为浅绿色,生成无色无味气体 | Fe+2H+=Fe2++ H2↑ | Fe 具有还原性 |
| ② | FeCl2 溶液中滴入 KSCN 溶液再加氯水 | 滴入KSCN 溶液无明显变化,加入氯水立即变成血红色 | I | III |
| ③ | FeCl2 溶液中加入锌片 | 锌片溶解,溶液的浅绿色逐渐褪去 | Zn+Fe2+= Zn2++ Fe | IV |
| ④ | V | 铜片溶解且溶液的血红色逐渐褪去 | 2Fe3++Cu=Cu2++2Fe2+ | Fe3+具有氧化性 |
(2). 学习小组的同学将从本实验中获得的知识推广到其他类物质的学习,请判断下列物质既有氧化性又有还原性的是
A.Cl2 B.Na C.Mg2+ D.H2O2
(3). 在实验②中,有部分同学在氯化亚铁溶液中滴入硫氰化钾溶液后出现血红色,你认为是什么原因
(4). 在配制氯化铁溶液时,含有少量 Fe2+,为检验少量 Fe2+的存在,请从下列物质中选择合适的试剂
A.AgNO3溶液 B.稀盐酸 C.KMnO4 溶液 D.NaOH溶液
您最近一年使用:0次



