1 . 明矾是生活中常见的净水剂,用铝土矿 含30%SiO2、40.8%Al2O3和和少量
含30%SiO2、40.8%Al2O3和和少量 等
等 制取明矾的工艺如下:
制取明矾的工艺如下: (少部分发生类似反应),气体
(少部分发生类似反应),气体 的化学式为
的化学式为_____ 。
(2)操作①的名称是_____ ,操作①后,需洗涤固体 表面吸附的离子,判断固体
表面吸附的离子,判断固体 是否洗涤干净的实验方法是:取最后一次洗涤后的浸出液于试管中,滴加
是否洗涤干净的实验方法是:取最后一次洗涤后的浸出液于试管中,滴加 溶液,观察到
溶液,观察到_____ ,说明已洗涤干净。
(3)固体 加稀硫酸反应的离子方程式为
加稀硫酸反应的离子方程式为_____ 。
(4)固体 与
与 固体焙烧可制备防火材料,下列装置适合的是
固体焙烧可制备防火材料,下列装置适合的是_____  填字母编号
填字母编号 。
。 铝土矿,理论上可制得明矾
铝土矿,理论上可制得明矾_____  明矾的相对分子质量为474)。
明矾的相对分子质量为474)。
 含30%SiO2、40.8%Al2O3和和少量
含30%SiO2、40.8%Al2O3和和少量 等
等 制取明矾的工艺如下:
制取明矾的工艺如下: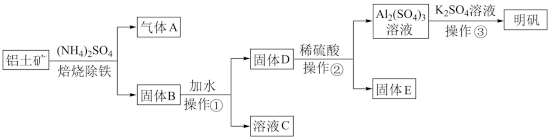
 (少部分发生类似反应),气体
(少部分发生类似反应),气体 的化学式为
的化学式为(2)操作①的名称是
 表面吸附的离子,判断固体
表面吸附的离子,判断固体 是否洗涤干净的实验方法是:取最后一次洗涤后的浸出液于试管中,滴加
是否洗涤干净的实验方法是:取最后一次洗涤后的浸出液于试管中,滴加 溶液,观察到
溶液,观察到(3)固体
 加稀硫酸反应的离子方程式为
加稀硫酸反应的离子方程式为(4)固体
 与
与 固体焙烧可制备防火材料,下列装置适合的是
固体焙烧可制备防火材料,下列装置适合的是 填字母编号
填字母编号 。
。

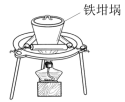


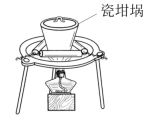
 铝土矿,理论上可制得明矾
铝土矿,理论上可制得明矾 明矾的相对分子质量为474)。
明矾的相对分子质量为474)。
您最近一年使用:0次
2 . 黑木耳富含蛋白质、铁、具有还原性的维生素C等,每100 g黑木耳含铁量高达185 mg。
I.为了确定黑木耳中含有铁元素,甲同学设计实验方案如下。____________ 。
(2)步骤④检验Fe3+所用试剂是_____________ (填化学式)溶液。
(3)已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,则滤液A中大量含有的阳离子 的离子符号为____________ 。
II.紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。本实验用KMnO4酸性溶液来测定黑木耳中铁元素的含量,乙同学设计实验方案如下。_______ (填序号)。
a.Na b.Cu c.Fe
(5)步骤⑥的离子方程式为_______________ 。
(6)若乙同学实验操作规范,但测得含铁量远远偏高,其可能的原因是_______________ 。
I.为了确定黑木耳中含有铁元素,甲同学设计实验方案如下。
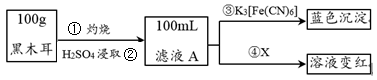
(2)步骤④检验Fe3+所用试剂是
(3)已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,则滤液A中大量含有的
II.紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。本实验用KMnO4酸性溶液来测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
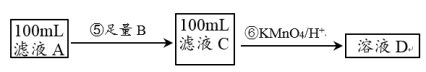
a.Na b.Cu c.Fe
(5)步骤⑥的离子方程式为
(6)若乙同学实验操作规范,但测得含铁量远远偏高,其可能的原因是
您最近一年使用:0次
解题方法
3 . 一种从腐蚀废液回收金属铜并获得氯化铁晶体的工艺流程如下。请根据流程,回答下列问题。(提示:为充分除去杂质,所加试剂均为过量)__________________ 。
(2)④所代表的物质是______ (用化学式表示)。
(3)操作方法a、b、c中是过滤的是______ (填序号)。
(4)若取2 mL溶液⑤加入试管中,然后滴加氢氧化钠溶液,产生白色沉淀,______ (补全实验现象),此过程涉及氧化还原反应的化学方程式是_________________ 。
(5)试剂⑥是 时,发生反应的化学方程式是
时,发生反应的化学方程式是__________________ 。
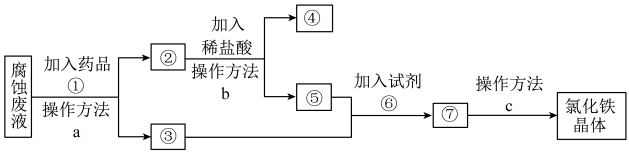
(2)④所代表的物质是
(3)操作方法a、b、c中是过滤的是
(4)若取2 mL溶液⑤加入试管中,然后滴加氢氧化钠溶液,产生白色沉淀,
(5)试剂⑥是
 时,发生反应的化学方程式是
时,发生反应的化学方程式是
您最近一年使用:0次
名校
解题方法
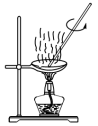
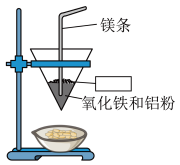
4 . 将铝与氧化铁混合制备单质铁的反应称为铝热反应,反应装置如图所示:_____ 。
(2)该铝热反应的化学方程式为_____ ,引发铝热反应的实验操作是_____ 。
(3)取少量反应所得的固体混合物,将其溶于足量稀 ,滴加KSCN溶液无明显现象,能否说明固体混合物中已无
,滴加KSCN溶液无明显现象,能否说明固体混合物中已无 ,请判断并说明理由
,请判断并说明理由_____ 。
(4)写出一种铝热反应的实际应用_____ 。
(2)该铝热反应的化学方程式为
(3)取少量反应所得的固体混合物,将其溶于足量稀
 ,滴加KSCN溶液无明显现象,能否说明固体混合物中已无
,滴加KSCN溶液无明显现象,能否说明固体混合物中已无 ,请判断并说明理由
,请判断并说明理由(4)写出一种铝热反应的实际应用
您最近一年使用:0次
名校
解题方法
5 .  溶液在工业上用于蚀刻铜箔电路板。从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示:
溶液在工业上用于蚀刻铜箔电路板。从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示: 溶液蚀刻铜箔的反应的离子方程式
溶液蚀刻铜箔的反应的离子方程式_____ 。
(2)从固体中分离出铜,试剂X是_____ 。
(3)若要使滤液再生为蚀刻液,可加入_____ 。
 溶液在工业上用于蚀刻铜箔电路板。从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示:
溶液在工业上用于蚀刻铜箔电路板。从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示: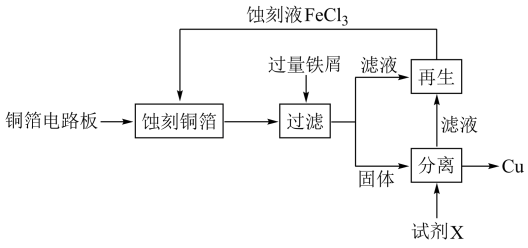
 溶液蚀刻铜箔的反应的离子方程式
溶液蚀刻铜箔的反应的离子方程式(2)从固体中分离出铜,试剂X是
(3)若要使滤液再生为蚀刻液,可加入
您最近一年使用:0次
名校
解题方法
6 . 某班同学用如下实验探究Fe2+、Fe3+的性质:
(1)甲组同学取2mL0.1mol•L-1FeSO4溶液,加1滴KSCN溶液,无明显现象,再加几滴3%H2O2溶液(用H2SO4酸化至pH=1),溶液颜色变红。甲组同学通过上述实验分析Fe2+具有______ (填“氧化”或“还原”)性。写出上面划线处操作所发生反应的离子方程式______ 。
(2)针对Fe3++3SCN- Fe(SCN)3,下列说法正确的是
Fe(SCN)3,下列说法正确的是______ 。(不定项)
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入1滴KSCN溶液和13%H2O2溶液,溶液变红,煤油的作用是______ 。
(4)同时乙组同学查阅资料发现Fe2+与SCN-可发生反应,生成无色的电中性配合物。为证实该性质,乙组同学用FeCO3进行了如图所示的a和b两组实验:
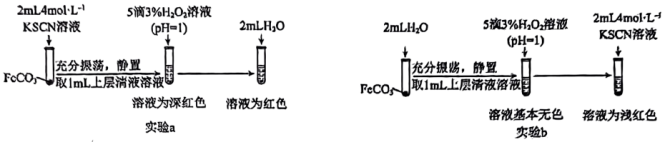
写出实验a中FeCO3与KSCN反应的离子方程式______ ,实验b的目的是______ 。
(5)反应S2O (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。
(aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。

①写出反应历程中“速率决定步骤”的热化学方程式:______ 。
②反应过程中由于Fe2+浓度较低而不容易被检测到,请回答Fe2+浓度较低的原因:______ 。
(6)溶液中Fe2+与邻二集非X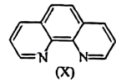 会生成橘黄色的配合物Y。
会生成橘黄色的配合物Y。
①邻二氮菲提供的配位原子是______ 。
②使用该方法时,需要控制pH在2~9之间,其原因为:______ 。
③取2.00mLc(Fe2+)=6.0×10-4mol/L的溶液,加入不同体积、浓度均为c(X)=6.0×10-4mol/L的邻二氮菲溶液,充分反应后加水定容至25mL,得到系列溶液,测其吸光度,结果如表:
已知吸光度A与有色物质的浓度 成正比。Fe2+和邻二氮菲X的吸光度近似为0。
成正比。Fe2+和邻二氮菲X的吸光度近似为0。
Fe2++nX=Y(橘黄色)
结合上面实验数据,通过计算回答Y中Fe2+的配位数(与中心原子或离子以配位键形式结合的配位原子数目):______ 。
(1)甲组同学取2mL0.1mol•L-1FeSO4溶液,加1滴KSCN溶液,无明显现象,再加几滴3%H2O2溶液(用H2SO4酸化至pH=1),溶液颜色变红。甲组同学通过上述实验分析Fe2+具有
(2)针对Fe3++3SCN-
 Fe(SCN)3,下列说法正确的是
Fe(SCN)3,下列说法正确的是| A.增大KSCN溶液的浓度,平衡常数增大 |
| B.向上述平衡体系中加入适量KCl圆体,平衡不移动 |
| C.加水稀释,平衡向左移动,且溶液的红色变浅 |
D.加入少量铁粉,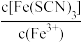 减小 减小 |
(4)同时乙组同学查阅资料发现Fe2+与SCN-可发生反应,生成无色的电中性配合物。为证实该性质,乙组同学用FeCO3进行了如图所示的a和b两组实验:

写出实验a中FeCO3与KSCN反应的离子方程式
(5)反应S2O
 (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。
(aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。
①写出反应历程中“速率决定步骤”的热化学方程式:
②反应过程中由于Fe2+浓度较低而不容易被检测到,请回答Fe2+浓度较低的原因:
(6)溶液中Fe2+与邻二集非X
 会生成橘黄色的配合物Y。
会生成橘黄色的配合物Y。①邻二氮菲提供的配位原子是
②使用该方法时,需要控制pH在2~9之间,其原因为:
③取2.00mLc(Fe2+)=6.0×10-4mol/L的溶液,加入不同体积、浓度均为c(X)=6.0×10-4mol/L的邻二氮菲溶液,充分反应后加水定容至25mL,得到系列溶液,测其吸光度,结果如表:
| V(X)/mL | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 | 8.00 |
| 吸光度/A | 0.24 | 0.36 | 0.48 | 0.60 | 0.72 | 0.72 |
 成正比。Fe2+和邻二氮菲X的吸光度近似为0。
成正比。Fe2+和邻二氮菲X的吸光度近似为0。Fe2++nX=Y(橘黄色)
结合上面实验数据,通过计算回答Y中Fe2+的配位数(与中心原子或离子以配位键形式结合的配位原子数目):
您最近一年使用:0次
名校
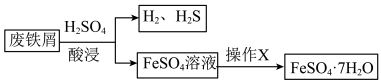
7 . 综合利用废弃物,对资源利用和环境保护具有现实意义。以废铁屑(含少量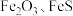 等杂质)为原料,制备硫酸亚铁晶体(
等杂质)为原料,制备硫酸亚铁晶体( ),流程示意图如下。
),流程示意图如下。
(1)酸浸过程中, 的作用是
的作用是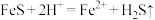 、
、 、
、___________ (用离子方程式表示)。
(2)酸浸时间对所得溶液的成分影响如下表所示。
①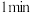 时检验,溶液变红,写出离子方程式
时检验,溶液变红,写出离子方程式___________
② 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因___________ 。
③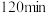 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因___________ 。
(3)已知: 受热易失水。操作X为:
受热易失水。操作X为: ___________ 。
(4)测定所得硫酸亚铁晶体中 的含量,步骤如下:
的含量,步骤如下:
Ⅰ.称取 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。
Ⅱ.取出 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入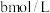 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液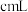 。
。
①依题意完善Ⅱ中 氧化
氧化 的离子方程式
的离子方程式________

 ___________
___________
 ___________
___________
②计算硫酸亚铁晶体样品中 的质量分数
的质量分数___________ 。
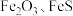 等杂质)为原料,制备硫酸亚铁晶体(
等杂质)为原料,制备硫酸亚铁晶体( ),流程示意图如下。
),流程示意图如下。
(1)酸浸过程中,
 的作用是
的作用是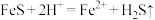 、
、 、
、(2)酸浸时间对所得溶液的成分影响如下表所示。
| 酸浸时间 |  |  |  |
用 溶液检验 溶液检验 | 变红 | 未变红 | 变红 |
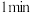 时检验,溶液变红,写出离子方程式
时检验,溶液变红,写出离子方程式②
 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因③
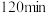 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因(3)已知:
 受热易失水。操作X为:
受热易失水。操作X为: (4)测定所得硫酸亚铁晶体中
 的含量,步骤如下:
的含量,步骤如下:Ⅰ.称取
 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。Ⅱ.取出
 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入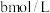 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液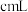 。
。①依题意完善Ⅱ中
 氧化
氧化 的离子方程式
的离子方程式
 ___________
___________
 ___________
___________②计算硫酸亚铁晶体样品中
 的质量分数
的质量分数
您最近一年使用:0次
2024-03-27更新
|
218次组卷
|
4卷引用:江西省丰城中学2023-2024学年高一下学期开学化学试题
名校
8 . 二氧化钛是一种常用的金属氧化物。工业上常用钛铁矿(主要成分为 ,其中Ti元素的化合价为
,其中Ti元素的化合价为 )来提取
)来提取 ,其中通常混有一定量的赤铁矿(主要成分为
,其中通常混有一定量的赤铁矿(主要成分为 ),该工艺流程如下:
),该工艺流程如下:

(1)结合流程,判断下列关于 的说法,错误的是_______。
的说法,错误的是_______。
(2)关于铁及其合金的性质,下列说法错误的是_______。
(3)将上述实验中得到的 溶于水,取2mL该溶液于试管中,向其中滴加几滴NaOH溶液。
溶于水,取2mL该溶液于试管中,向其中滴加几滴NaOH溶液。
①看到的现象是_______ ,写出相应的化学方程式_______ 、_______ 。
②再向上述试管中滴加足量的稀硝酸中,下列说法正确的是_______ 。
A.仅发生复分解反应
B.原试管中的沉淀可能同时含有 和
和
C.最后溶液中的盐仅有
(4)检验 中不含
中不含 的方法是
的方法是_______ ,现象是_______ 。
(5)根据②处的反应可知 的氧化性比
的氧化性比 的氧化性强,理由是
的氧化性强,理由是_______ 。
(6)经检测,某次使用的混合矿石中约含有质量分数50%的 ,40%的
,40%的 ,其它杂质中不含铁元素。若使用1吨该矿石冶炼
,其它杂质中不含铁元素。若使用1吨该矿石冶炼 ,能得到
,能得到
_______ 吨,同时得到副产物
_______ 吨(不考虑生产过程中的损失,均保留两位小数)。
 ,其中Ti元素的化合价为
,其中Ti元素的化合价为 )来提取
)来提取 ,其中通常混有一定量的赤铁矿(主要成分为
,其中通常混有一定量的赤铁矿(主要成分为 ),该工艺流程如下:
),该工艺流程如下:
(1)结合流程,判断下列关于
 的说法,错误的是_______。
的说法,错误的是_______。A. 发生复分解反应生成 发生复分解反应生成 |
B.煅烧 时,发生还原反应生成 时,发生还原反应生成 |
| C.流程中“结晶”的具体步骤是:加热浓缩、冷却结晶 |
D.保存 溶液时需要加铁粉 溶液时需要加铁粉 |
(2)关于铁及其合金的性质,下列说法错误的是_______。
| A.在元素周期表中,铁属于过渡元素 |
| B.生铁和钢的性质差异主要是碳含量的不同 |
| C.铁和不同非金属单质反应产物中的铁元素价态可能不同 |
| D.铁在氧气中燃烧后,可以使用磁铁验证是否有铁单质剩余 |
(3)将上述实验中得到的
 溶于水,取2mL该溶液于试管中,向其中滴加几滴NaOH溶液。
溶于水,取2mL该溶液于试管中,向其中滴加几滴NaOH溶液。①看到的现象是
②再向上述试管中滴加足量的稀硝酸中,下列说法正确的是
A.仅发生复分解反应
B.原试管中的沉淀可能同时含有
 和
和
C.最后溶液中的盐仅有

(4)检验
 中不含
中不含 的方法是
的方法是(5)根据②处的反应可知
 的氧化性比
的氧化性比 的氧化性强,理由是
的氧化性强,理由是(6)经检测,某次使用的混合矿石中约含有质量分数50%的
 ,40%的
,40%的 ,其它杂质中不含铁元素。若使用1吨该矿石冶炼
,其它杂质中不含铁元素。若使用1吨该矿石冶炼 ,能得到
,能得到

您最近一年使用:0次
9 . 根据下列实验操作和现象所得出的结论或解释一定正确的是
| 选项 | 实验操作和现象 | 结论或解释 |
| A | 向淀粉-KI溶液中通入Cl2,再通入SO2,溶液先出现蓝色,后蓝色褪去 | 还原性:SO2>I->Cl- |
| B | 检验SO2气体中是否混有SO3(g):将气体通入Ba(NO3)2溶液,有白色沉淀生成 | 混有SO3(g) |
| C | 取少量铁与水蒸气反应后的固体于试管中,加足量稀盐酸溶解再滴加KSCN溶液,溶液未变血红色 | 固体产物中不存在三价铁 |
| D | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中,出现白色沉淀 | 元素非金属性:C>Si |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-21更新
|
722次组卷
|
5卷引用:湖北省武汉市第十二中学2023-2024学年高一下学期3月月考化学试题
解题方法
10 . A为一种常见的金属单质,B、E、F、G是含有A元素的常见化合物。回答下列问题:

(1)写出化学式:B_______ ,F_______ 。
(2)写出E到F转化过程的化学方程式_______ 。
(3)检验G溶液中金属阳离子的常用试剂为_______ ,证明该离子存在的现象为_______ 。
(4)写出G到B转化过程的化学方程式_______ ,该反应中还原剂为_______ 。
(5)若标准状况下A与盐酸反应产生44.8L气体,则消耗A的质量为_______ g。

(1)写出化学式:B
(2)写出E到F转化过程的化学方程式
(3)检验G溶液中金属阳离子的常用试剂为
(4)写出G到B转化过程的化学方程式
(5)若标准状况下A与盐酸反应产生44.8L气体,则消耗A的质量为
您最近一年使用:0次



