解题方法
1 . 元素的“价一类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。如图为铁元素的“价一类”二维图,箭头表示部分物质间的转化关系。

请回答以下问题:
(1)K2FeO4中Fe的化合价为_____ 。
(2) 是一种新型水处理剂,将
是一种新型水处理剂,将 溶液、
溶液、 溶液与
溶液与 溶液混合可得到
溶液混合可得到 ,发生相应反应的离子方程式为
,发生相应反应的离子方程式为_____ ,当有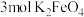 生成时,反应中转移的电子数目为
生成时,反应中转移的电子数目为_____  。
。
(3)Fe2O3是否为碱性氧化物_____ (填是或否),理由:_____ 。
(4)制备氢氧化亚铁时,观察到白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释该现象:_____ ,其中检验溶液中Fe3+的试剂是KSCN溶液,该反应的离子方程式为:_____ 。

请回答以下问题:
(1)K2FeO4中Fe的化合价为
(2)
 是一种新型水处理剂,将
是一种新型水处理剂,将 溶液、
溶液、 溶液与
溶液与 溶液混合可得到
溶液混合可得到 ,发生相应反应的离子方程式为
,发生相应反应的离子方程式为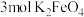 生成时,反应中转移的电子数目为
生成时,反应中转移的电子数目为 。
。(3)Fe2O3是否为碱性氧化物
(4)制备氢氧化亚铁时,观察到白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释该现象:
您最近一年使用:0次
2 . 某同学用如下实验探究Fe2+、Fe3+的性质。请回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol•L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___ 。
(2)甲同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____ 。
(3)乙同学取少量待测溶液(可能含有FeCl2、FeCl3)于试管中,滴加酸性高锰酸钾溶液,振荡后溶液紫色消失,乙同学由此得出结论:该待测溶液一定含有Fe2+。此结论不够严谨,理由是____ (结合离子方程式解释)。
(4)丙同学取10mL0.1mol•L-1KI溶液加入6mL0.1mol•L-1FeCl3溶液混合。取2mL此溶液于试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;写出发生反应的离子方程式_______________ 。
(5)丁同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液溶液变成棕黄色,发生反应的离子方程式为_______ 。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol•L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是
(2)甲同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙同学取少量待测溶液(可能含有FeCl2、FeCl3)于试管中,滴加酸性高锰酸钾溶液,振荡后溶液紫色消失,乙同学由此得出结论:该待测溶液一定含有Fe2+。此结论不够严谨,理由是
(4)丙同学取10mL0.1mol•L-1KI溶液加入6mL0.1mol•L-1FeCl3溶液混合。取2mL此溶液于试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;写出发生反应的离子方程式
(5)丁同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
3 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁粉,其目的是_______ 。
(2)甲组同学取2mlFeCl2溶液。加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是_______
(4)丙组同学在2mLFeCl2溶液中加入一定量的NaOH溶液,溶液中出现白色絮状沉淀,后变成红褐色沉淀,沉淀颜色变化涉及的化学反应方程式:_______
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_______
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁粉,其目的是
(2)甲组同学取2mlFeCl2溶液。加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学在2mLFeCl2溶液中加入一定量的NaOH溶液,溶液中出现白色絮状沉淀,后变成红褐色沉淀,沉淀颜色变化涉及的化学反应方程式:
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
解题方法
4 . 硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O,相对分子质量392]晶体又称莫尔盐,易溶易电离但却比一般的亚铁盐稳定,因此广泛应用于制药、电镀以及定量分析。回答下列与之有关的问题:
(1)在莫尔盐所涉及的五种元素中:
①S元素在门捷列夫元素周期表中的位置是______________ ;
②其中处于同主族的两种元素非金属性更强的是:_____________ 。
(2)为检验莫尔盐是否变质,可用的试剂为_______________ 。
碘是合成人体甲状腺激素的重要原料,食盐中加KIO3是我国为解决普遍性碘缺乏问题的国家规定,下图是自动电位滴定法测定食盐中碘含量的实验过程:
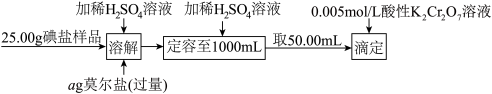
(3)已知“溶解”过程中IO3-的还原产物为碘单质,写出该反应的离子反应方程式:______________________________ 。
(4)取50. 00 mL样品,用0.005 mol/L酸性K2Cr2O7溶液滴定剩余Fe2+,滴定操作时使用的锥形瓶未干燥,导致结果_____________ (填“偏大”“偏小”或“无影响”)
(1)在莫尔盐所涉及的五种元素中:
①S元素在门捷列夫元素周期表中的位置是
②其中处于同主族的两种元素非金属性更强的是:
(2)为检验莫尔盐是否变质,可用的试剂为
碘是合成人体甲状腺激素的重要原料,食盐中加KIO3是我国为解决普遍性碘缺乏问题的国家规定,下图是自动电位滴定法测定食盐中碘含量的实验过程:

(3)已知“溶解”过程中IO3-的还原产物为碘单质,写出该反应的离子反应方程式:
(4)取50. 00 mL样品,用0.005 mol/L酸性K2Cr2O7溶液滴定剩余Fe2+,滴定操作时使用的锥形瓶未干燥,导致结果
您最近一年使用:0次
5 . 除去括号中的杂质,写出选择的试剂并写出有关离子方程式.
(1)FeCl2溶液(FeCl3),选用试剂________ ,离子方程式________
(2)氧化铜中混有少量氧化铝,选用试剂________ ,离子方程式________ .
(1)FeCl2溶液(FeCl3),选用试剂
(2)氧化铜中混有少量氧化铝,选用试剂
您最近一年使用:0次
6 . HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是_______________ (填字母编号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是______________ (填字母编号)。
A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别 D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出该反应的离子方程式:_________________________________________________ 。
(4)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式_________ :
FeSO4+K2O2=K2FeO4+K2O+K2SO4+O2↑
(5)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,发挥的作用是______ ;②_________ 。
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是
A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别 D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出该反应的离子方程式:
(4)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式
FeSO4+K2O2=K2FeO4+K2O+K2SO4+O2↑
(5)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,发挥的作用是
您最近一年使用:0次
7 . 某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42ˉ、SiO32ˉ、NO3ˉ中的一种或几种离子,取该溶液进行实验,其现象及转化如图.反应过程中有一种气体是红棕色。
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有___________________________ 。
(2)溶液X中,关于NO3—的判断一定正确的是_____________ 。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为_________________ ,并用双线桥表示电子转移的方向和数目。
(4)若转化③中D过量,通常用强碱溶液进行吸收,写出该反应的离子方程式___________________ 。
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂可选择___________________ 。
①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸 ⑤KMnO4溶液 ⑥氯水和KSCN的混合溶液

请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有
(2)溶液X中,关于NO3—的判断一定正确的是
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为
(4)若转化③中D过量,通常用强碱溶液进行吸收,写出该反应的离子方程式
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂可选择
①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸 ⑤KMnO4溶液 ⑥氯水和KSCN的混合溶液
您最近一年使用:0次



