名校
解题方法
1 . 茶是中国人喜爱的一种饮品,茶叶中含有铁元素,可以用以下实验操作检验茶叶中的铁元素:A.取少量茶叶;B.检验滤液中的 Fe3+;C.过滤得到滤液;D.将茶叶灼烧为茶叶灰;E.用足量稀盐酸溶解茶叶灰,并加蒸馏水稀释;请回答下列问题。
(1)上述实验操作的正确顺序是___________ (填字母)。
(2)操作D所用仪器有:酒精灯、三脚架、泥三角、玻璃棒、___________ 。
(3)请选择检验滤液中含有Fe3+的最佳方法并写出相关反应的离子方程式___________ 。
(4)很多人喜欢用铁壶泡茶,请写出铁壶泡茶时可能发生反应的离子方程式___________ 。
(1)上述实验操作的正确顺序是
(2)操作D所用仪器有:酒精灯、三脚架、泥三角、玻璃棒、
(3)请选择检验滤液中含有Fe3+的最佳方法并写出相关反应的离子方程式
(4)很多人喜欢用铁壶泡茶,请写出铁壶泡茶时可能发生反应的离子方程式
您最近一年使用:0次
名校
2 . 铁及其化合物在生产生活中有极其重要的用途,请回答下列问题:
(1) 溶液可用于刻蚀铜制电路板,该反应的离子方程式为
溶液可用于刻蚀铜制电路板,该反应的离子方程式为________ 。
(2)要实现 转化为
转化为 ,可选用足量的
,可选用足量的________ (填字母)。
①亚硫酸钠溶液 ②稀盐酸 ③酸性 溶液 ④铁粉 ⑤碘化钾溶液 ⑥过氧化氢溶液
溶液 ④铁粉 ⑤碘化钾溶液 ⑥过氧化氢溶液
(3)某补铁口服液中含有 ,为检验其是否被氧化变质,可取少量该口服液,向其中滴加
,为检验其是否被氧化变质,可取少量该口服液,向其中滴加________ ,若溶液变为_____ 色,则说明其已变质。向该口服液中加入维生素C可防止其被氧化变质,利用了维生素C的_____ 性。
(4)激光打印机的墨粉中含有 。
。 溶于过量的稀盐酸,反应的离子方程式为
溶于过量的稀盐酸,反应的离子方程式为___________ 。往反应后的溶液中滴加少量酸性 溶液,酸性
溶液,酸性 溶液褪色,
溶液褪色,_____ (填“能或不能”)说明反应后的溶液中含 。若不能,请说明原因:
。若不能,请说明原因:___________ 。
(5)高铁酸盐可作为饮用水的消毒剂和净水剂,工业上以 、
、 、
、 为原料制备高铁酸钾。
为原料制备高铁酸钾。
①高铁酸钠 中Fe的化合价为
中Fe的化合价为_____ 。
②配平制备 的离子方程式:
的离子方程式:______
__ +__
+__ +__=__
+__=__ +__
+__ +__
+__
每生成39.6g ,转移电子的数目为
,转移电子的数目为_____ 。
③已知 ,说明高铁酸盐既可作饮用水的消毒剂又可作净水剂的原因
,说明高铁酸盐既可作饮用水的消毒剂又可作净水剂的原因___________ 。
(1)
 溶液可用于刻蚀铜制电路板,该反应的离子方程式为
溶液可用于刻蚀铜制电路板,该反应的离子方程式为(2)要实现
 转化为
转化为 ,可选用足量的
,可选用足量的①亚硫酸钠溶液 ②稀盐酸 ③酸性
 溶液 ④铁粉 ⑤碘化钾溶液 ⑥过氧化氢溶液
溶液 ④铁粉 ⑤碘化钾溶液 ⑥过氧化氢溶液(3)某补铁口服液中含有
 ,为检验其是否被氧化变质,可取少量该口服液,向其中滴加
,为检验其是否被氧化变质,可取少量该口服液,向其中滴加(4)激光打印机的墨粉中含有
 。
。 溶于过量的稀盐酸,反应的离子方程式为
溶于过量的稀盐酸,反应的离子方程式为 溶液,酸性
溶液,酸性 溶液褪色,
溶液褪色, 。若不能,请说明原因:
。若不能,请说明原因:(5)高铁酸盐可作为饮用水的消毒剂和净水剂,工业上以
 、
、 、
、 为原料制备高铁酸钾。
为原料制备高铁酸钾。①高铁酸钠
 中Fe的化合价为
中Fe的化合价为②配平制备
 的离子方程式:
的离子方程式:__
 +__
+__ +__=__
+__=__ +__
+__ +__
+__
每生成39.6g
 ,转移电子的数目为
,转移电子的数目为③已知
 ,说明高铁酸盐既可作饮用水的消毒剂又可作净水剂的原因
,说明高铁酸盐既可作饮用水的消毒剂又可作净水剂的原因
您最近一年使用:0次
名校
解题方法
3 . 按要求书写化学方程式或离子方程式。
(1)除去氯化亚铁溶液中的氯化铁杂质,相应的离子方程式为___________ 。
(2)工业上用FeCl3溶液腐蚀铜线路板,相应的离子方程式为___________ 。
(3)浓硫酸和铜反应,相应的化学方程式为___________ 。
(4)Fe(OH)2在空气中被氧化,相应的化学方程式为___________ 。
(5)SO2能使氯水褪色,相应的离子方程式为___________ 。
(1)除去氯化亚铁溶液中的氯化铁杂质,相应的离子方程式为
(2)工业上用FeCl3溶液腐蚀铜线路板,相应的离子方程式为
(3)浓硫酸和铜反应,相应的化学方程式为
(4)Fe(OH)2在空气中被氧化,相应的化学方程式为
(5)SO2能使氯水褪色,相应的离子方程式为
您最近一年使用:0次
名校
4 . 铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是___________。
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:研细后用盐酸溶解,___________ 。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有___________ (填化学性质)。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO 、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:___________
______Fe(OH)3+_______ClO-+_______=_______FeO +_______Cl-+_______
+_______Cl-+_______
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是___________ ,操作I用到的玻璃仪器有烧杯、玻璃棒和___________ 。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________ 。
③上述流程中操作Ⅲ包括:蒸发浓缩、___________ 、过滤、洗涤。
(1)所含铁元素只有还原性的物质是___________。
| A.Fe | B.FeCl2 | C.FeCl3 | D.Fe2O3 |
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:研细后用盐酸溶解,
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO
 、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:______Fe(OH)3+_______ClO-+_______=_______FeO
 +_______Cl-+_______
+_______Cl-+_______(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为
③上述流程中操作Ⅲ包括:蒸发浓缩、
您最近一年使用:0次
名校
解题方法
5 . 如图为铁及其化合物的“价一类”二维图。

(1)填写二维图缺失的化学式②_______ 。
(2)利用以下试剂研究 性质,进行了如下预测:
性质,进行了如下预测:
a. b.
b. c.
c. d.
d. e.
e.
从物质类别上看, 属于盐,可能与
属于盐,可能与_______ 发生反应(填序号);从化合价角度看,体现 氧化性,可能与
氧化性,可能与_______ 反应(填序号)。
(3) 具有较强的还原性,容易被一些氧化剂氧化为
具有较强的还原性,容易被一些氧化剂氧化为 。
。
①向 溶液中加入
溶液中加入 溶液,无明显现象,再加入氯水,溶液变血红色。
溶液,无明显现象,再加入氯水,溶液变血红色。 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
②配制含 的溶液时,为防止
的溶液时,为防止 被氧化,应采取的措施是
被氧化,应采取的措施是_______ 。
(4)工业中常用高铁酸钾(K2FeO4)作为高效、多功能的自来水处理剂,高铁酸钾与水反应时,能生成 胶体吸附杂质净水,同时还产生一种气体,该原理的离子方程式为
胶体吸附杂质净水,同时还产生一种气体,该原理的离子方程式为 ,每生成
,每生成 该气体,
该气体, 转移的电子数目为
转移的电子数目为_______ 。

(1)填写二维图缺失的化学式②
(2)利用以下试剂研究
 性质,进行了如下预测:
性质,进行了如下预测:a.
 b.
b. c.
c. d.
d. e.
e.
从物质类别上看,
 属于盐,可能与
属于盐,可能与 氧化性,可能与
氧化性,可能与(3)
 具有较强的还原性,容易被一些氧化剂氧化为
具有较强的还原性,容易被一些氧化剂氧化为 。
。①向
 溶液中加入
溶液中加入 溶液,无明显现象,再加入氯水,溶液变血红色。
溶液,无明显现象,再加入氯水,溶液变血红色。 与
与 反应的离子方程式为
反应的离子方程式为②配制含
 的溶液时,为防止
的溶液时,为防止 被氧化,应采取的措施是
被氧化,应采取的措施是(4)工业中常用高铁酸钾(K2FeO4)作为高效、多功能的自来水处理剂,高铁酸钾与水反应时,能生成
 胶体吸附杂质净水,同时还产生一种气体,该原理的离子方程式为
胶体吸附杂质净水,同时还产生一种气体,该原理的离子方程式为 ,每生成
,每生成 该气体,
该气体, 转移的电子数目为
转移的电子数目为
您最近一年使用:0次
6 . 下图为铁元素的价类二维图,其中箭头表示部分物质间的转化关系(条件略去)。
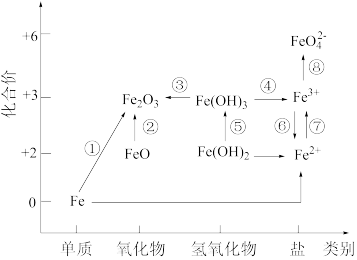
回答下列问题:
(1)工业上冶炼铁的主要方法是_______(填标号)。
(2)在潮湿的空气里,钢铁表面吸附了一薄层水膜,其中含有少量 、
、 、
、 等,它与钢铁里的铁和少量的
等,它与钢铁里的铁和少量的_______ (填化学式)形成了无数微小的原电池,使钢铁发生电化学腐蚀。
(3)检验 溶液中是否存在
溶液中是否存在 可选用的试剂是
可选用的试剂是_______ 。
(4)写出一个能实现图中转化⑦的离子方程式_______ 。
(5)高铁酸盐(含 )常用作杀菌消毒剂,从化合价的角度分析是因为其具有
)常用作杀菌消毒剂,从化合价的角度分析是因为其具有_______ 性(填“氧化”或“还原”)。用 与
与 在强碱性条件下可制取
在强碱性条件下可制取 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为_______ 。

回答下列问题:
(1)工业上冶炼铁的主要方法是_______(填标号)。
| A.热分解法 | B.高温还原法 | C.电解法 | D.物理富集法 |
 、
、 、
、 等,它与钢铁里的铁和少量的
等,它与钢铁里的铁和少量的(3)检验
 溶液中是否存在
溶液中是否存在 可选用的试剂是
可选用的试剂是(4)写出一个能实现图中转化⑦的离子方程式
(5)高铁酸盐(含
 )常用作杀菌消毒剂,从化合价的角度分析是因为其具有
)常用作杀菌消毒剂,从化合价的角度分析是因为其具有 与
与 在强碱性条件下可制取
在强碱性条件下可制取 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
7 . 细菌可以促使铁、氮两种元素进行氧化还原反应,并耦合两种元素的循环。耦合循环中的部分转化如图所示。
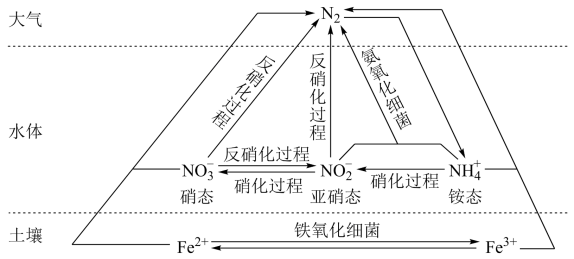
(1)如图所示氮循环中,属于氮的固定的有_______ (填字母序号)。
a.N2转化为氨态氮 b.硝化过程 c.反硝化过程
(2)农业生产过程中的铵态氮肥是水体中 的主要来源之一。
的主要来源之一。
①检验氮肥中 的实验方案是
的实验方案是_______ 。
②实验室制备少量氨气的化学方程式为_______ 。
(3)氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02mol氮气时,转移的电子的物质的量为_______ mol。
(4)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),用离子方程式说明利用土壤中的铁循环脱除水体中氨态氮的原理_______ 。
(5)Fe2+与硝态氮(NO )反应脱氮生成N2,反应后的溶液为Fe(NO3)2和Fe(NO3)3的混合溶液。为检验溶液中含有Fe2+和Fe3+,相应的实验方案为
)反应脱氮生成N2,反应后的溶液为Fe(NO3)2和Fe(NO3)3的混合溶液。为检验溶液中含有Fe2+和Fe3+,相应的实验方案为_______ (实验中可选用的试剂:KSCN溶液、0.1mol·L-1的KMnO4溶液、3%的H2O2溶液)。

(1)如图所示氮循环中,属于氮的固定的有
a.N2转化为氨态氮 b.硝化过程 c.反硝化过程
(2)农业生产过程中的铵态氮肥是水体中
 的主要来源之一。
的主要来源之一。①检验氮肥中
 的实验方案是
的实验方案是②实验室制备少量氨气的化学方程式为
(3)氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02mol氮气时,转移的电子的物质的量为
(4)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),用离子方程式说明利用土壤中的铁循环脱除水体中氨态氮的原理
(5)Fe2+与硝态氮(NO
 )反应脱氮生成N2,反应后的溶液为Fe(NO3)2和Fe(NO3)3的混合溶液。为检验溶液中含有Fe2+和Fe3+,相应的实验方案为
)反应脱氮生成N2,反应后的溶液为Fe(NO3)2和Fe(NO3)3的混合溶液。为检验溶液中含有Fe2+和Fe3+,相应的实验方案为
您最近一年使用:0次
8 . Ⅰ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下变化过程:H2O2→O2
(1)该反应中氧化剂是_______ 。
(2)发生反应的化学方程式为_______ 。
(3)如反应转移了0.6 mol电子,则产生的气体在标准状况下的体积为_______ 。
Ⅱ.加热条件下,使140 g铁粉与标准状况下67.2 L的氯气充分反应,将所得固体混合物在适量水中完全溶解,无固体剩余,再加入水将溶液稀释为2 L。
(4)固体加水溶解时,溶液中发生反应的离子方程式为_______ 。
(5)需要通入标准状况下氯气_______ L,可使2 L溶液中只含有FeCl3一种溶质。
(1)该反应中氧化剂是
(2)发生反应的化学方程式为
(3)如反应转移了0.6 mol电子,则产生的气体在标准状况下的体积为
Ⅱ.加热条件下,使140 g铁粉与标准状况下67.2 L的氯气充分反应,将所得固体混合物在适量水中完全溶解,无固体剩余,再加入水将溶液稀释为2 L。
(4)固体加水溶解时,溶液中发生反应的离子方程式为
(5)需要通入标准状况下氯气
您最近一年使用:0次
解题方法
9 . 硫元素是动植物生长不可缺少的元素,如图是硫元素的价类二维图。

(1)A的化学式为___ ;Na2SO4的电离方程式为___ 。将气体A通入SO2的水溶液中,可观察到的现象是___ 。
(2)兴趣小组依据价类二维图,设计实验实现物质间的转化。
①从“价维”角度,写出一个实现“浓H2SO4→SO2”的化学方程式:____ 。
②兴趣小组从“价维”角度设计实验处理含SO2的废气。先将废气通入Fe2(SO4)3酸性溶液中,充分吸收后,再向所得溶液中鼓入空气,得到溶液X。
ⅰ.该实验利用SO2的___ (填标号)。
a.氧化性 b.还原性 c.漂白性 d.酸性
ⅱ.溶液X中可能含Fe2+和Fe3+,为了探究其成分设计以下实验。请在答题卡上完成表中内容。
ⅲ.在处理过程中,可替代空气的最佳试剂是____ (填标号)。
a.Cl2 b.Fe c.NaOH d.H2O2
③从“类维”角度设计一个吸收废气中SO2的反应,写出相应的离子方程式。___ 。

(1)A的化学式为
(2)兴趣小组依据价类二维图,设计实验实现物质间的转化。
①从“价维”角度,写出一个实现“浓H2SO4→SO2”的化学方程式:
②兴趣小组从“价维”角度设计实验处理含SO2的废气。先将废气通入Fe2(SO4)3酸性溶液中,充分吸收后,再向所得溶液中鼓入空气,得到溶液X。
ⅰ.该实验利用SO2的
a.氧化性 b.还原性 c.漂白性 d.酸性
ⅱ.溶液X中可能含Fe2+和Fe3+,为了探究其成分设计以下实验。请在答题卡上完成表中内容。
| 实验操作 | 现象 | 结论 |
| 取少量溶液X于试管中,滴加酸性高锰酸钾溶液 | 溶液X含Fe2+ | |
| 另取少量溶液X于试管中,滴加硫氰酸钾溶液 | 溶液变红色 |
ⅲ.在处理过程中,可替代空气的最佳试剂是
a.Cl2 b.Fe c.NaOH d.H2O2
③从“类维”角度设计一个吸收废气中SO2的反应,写出相应的离子方程式。
您最近一年使用:0次
10 . 以下是高中化学中的常见物质,根据要求完成下列问题:
①钠②过氧化钠③铜④硫酸⑤氯化铁
(1)①~⑤中属于电解质的是____ (填序号)。
(2)实验室中,金属钠着火能用来灭火的是____ (填标号)。
A.二氧化碳B.水C.干沙
(3)将包有少量过氧化钠固体的棉花放在石棉网上,用滴管向棉花上滴几滴水,棉花立刻燃烧起来。产生这一现象的原因是____ (用化学方程式表示)。
(4)铜能溶于热浓硫酸,写出该反应的化学方程式____ 。
(5)能用来检验溶液里含有Fe3+的试剂是____ 。
(6)向沸水中逐滴加入饱和氯化铁溶液,至液体呈透明的红褐色,可制得____ 胶体,判断实验成功的方法是____ 。
①钠②过氧化钠③铜④硫酸⑤氯化铁
(1)①~⑤中属于电解质的是
(2)实验室中,金属钠着火能用来灭火的是
A.二氧化碳B.水C.干沙
(3)将包有少量过氧化钠固体的棉花放在石棉网上,用滴管向棉花上滴几滴水,棉花立刻燃烧起来。产生这一现象的原因是
(4)铜能溶于热浓硫酸,写出该反应的化学方程式
(5)能用来检验溶液里含有Fe3+的试剂是
(6)向沸水中逐滴加入饱和氯化铁溶液,至液体呈透明的红褐色,可制得
您最近一年使用:0次



