1 . 下图为铁元素的价类二维图,其中箭头表示部分物质间的转化关系(条件略去)。
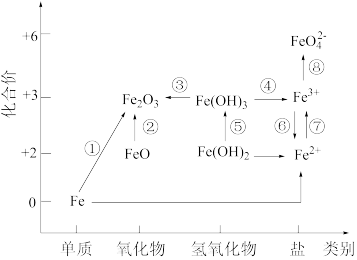
回答下列问题:
(1)工业上冶炼铁的主要方法是_______(填标号)。
(2)在潮湿的空气里,钢铁表面吸附了一薄层水膜,其中含有少量 、
、 、
、 等,它与钢铁里的铁和少量的
等,它与钢铁里的铁和少量的_______ (填化学式)形成了无数微小的原电池,使钢铁发生电化学腐蚀。
(3)检验 溶液中是否存在
溶液中是否存在 可选用的试剂是
可选用的试剂是_______ 。
(4)写出一个能实现图中转化⑦的离子方程式_______ 。
(5)高铁酸盐(含 )常用作杀菌消毒剂,从化合价的角度分析是因为其具有
)常用作杀菌消毒剂,从化合价的角度分析是因为其具有_______ 性(填“氧化”或“还原”)。用 与
与 在强碱性条件下可制取
在强碱性条件下可制取 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为_______ 。

回答下列问题:
(1)工业上冶炼铁的主要方法是_______(填标号)。
| A.热分解法 | B.高温还原法 | C.电解法 | D.物理富集法 |
 、
、 、
、 等,它与钢铁里的铁和少量的
等,它与钢铁里的铁和少量的(3)检验
 溶液中是否存在
溶液中是否存在 可选用的试剂是
可选用的试剂是(4)写出一个能实现图中转化⑦的离子方程式
(5)高铁酸盐(含
 )常用作杀菌消毒剂,从化合价的角度分析是因为其具有
)常用作杀菌消毒剂,从化合价的角度分析是因为其具有 与
与 在强碱性条件下可制取
在强碱性条件下可制取 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
2 . 细菌可以促使铁、氮两种元素进行氧化还原反应,并耦合两种元素的循环。耦合循环中的部分转化如图所示。
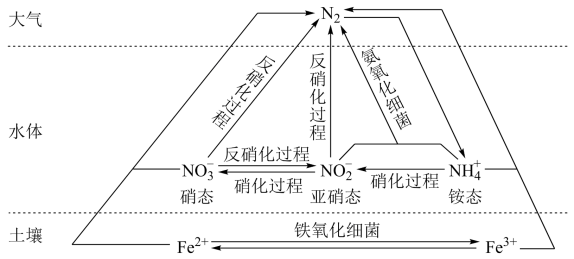
(1)如图所示氮循环中,属于氮的固定的有_______ (填字母序号)。
a.N2转化为氨态氮 b.硝化过程 c.反硝化过程
(2)农业生产过程中的铵态氮肥是水体中 的主要来源之一。
的主要来源之一。
①检验氮肥中 的实验方案是
的实验方案是_______ 。
②实验室制备少量氨气的化学方程式为_______ 。
(3)氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02mol氮气时,转移的电子的物质的量为_______ mol。
(4)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),用离子方程式说明利用土壤中的铁循环脱除水体中氨态氮的原理_______ 。
(5)Fe2+与硝态氮(NO )反应脱氮生成N2,反应后的溶液为Fe(NO3)2和Fe(NO3)3的混合溶液。为检验溶液中含有Fe2+和Fe3+,相应的实验方案为
)反应脱氮生成N2,反应后的溶液为Fe(NO3)2和Fe(NO3)3的混合溶液。为检验溶液中含有Fe2+和Fe3+,相应的实验方案为_______ (实验中可选用的试剂:KSCN溶液、0.1mol·L-1的KMnO4溶液、3%的H2O2溶液)。

(1)如图所示氮循环中,属于氮的固定的有
a.N2转化为氨态氮 b.硝化过程 c.反硝化过程
(2)农业生产过程中的铵态氮肥是水体中
 的主要来源之一。
的主要来源之一。①检验氮肥中
 的实验方案是
的实验方案是②实验室制备少量氨气的化学方程式为
(3)氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02mol氮气时,转移的电子的物质的量为
(4)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),用离子方程式说明利用土壤中的铁循环脱除水体中氨态氮的原理
(5)Fe2+与硝态氮(NO
 )反应脱氮生成N2,反应后的溶液为Fe(NO3)2和Fe(NO3)3的混合溶液。为检验溶液中含有Fe2+和Fe3+,相应的实验方案为
)反应脱氮生成N2,反应后的溶液为Fe(NO3)2和Fe(NO3)3的混合溶液。为检验溶液中含有Fe2+和Fe3+,相应的实验方案为
您最近一年使用:0次
解题方法
3 . 硫元素是动植物生长不可缺少的元素,如图是硫元素的价类二维图。

(1)A的化学式为___ ;Na2SO4的电离方程式为___ 。将气体A通入SO2的水溶液中,可观察到的现象是___ 。
(2)兴趣小组依据价类二维图,设计实验实现物质间的转化。
①从“价维”角度,写出一个实现“浓H2SO4→SO2”的化学方程式:____ 。
②兴趣小组从“价维”角度设计实验处理含SO2的废气。先将废气通入Fe2(SO4)3酸性溶液中,充分吸收后,再向所得溶液中鼓入空气,得到溶液X。
ⅰ.该实验利用SO2的___ (填标号)。
a.氧化性 b.还原性 c.漂白性 d.酸性
ⅱ.溶液X中可能含Fe2+和Fe3+,为了探究其成分设计以下实验。请在答题卡上完成表中内容。
ⅲ.在处理过程中,可替代空气的最佳试剂是____ (填标号)。
a.Cl2 b.Fe c.NaOH d.H2O2
③从“类维”角度设计一个吸收废气中SO2的反应,写出相应的离子方程式。___ 。

(1)A的化学式为
(2)兴趣小组依据价类二维图,设计实验实现物质间的转化。
①从“价维”角度,写出一个实现“浓H2SO4→SO2”的化学方程式:
②兴趣小组从“价维”角度设计实验处理含SO2的废气。先将废气通入Fe2(SO4)3酸性溶液中,充分吸收后,再向所得溶液中鼓入空气,得到溶液X。
ⅰ.该实验利用SO2的
a.氧化性 b.还原性 c.漂白性 d.酸性
ⅱ.溶液X中可能含Fe2+和Fe3+,为了探究其成分设计以下实验。请在答题卡上完成表中内容。
| 实验操作 | 现象 | 结论 |
| 取少量溶液X于试管中,滴加酸性高锰酸钾溶液 | 溶液X含Fe2+ | |
| 另取少量溶液X于试管中,滴加硫氰酸钾溶液 | 溶液变红色 |
ⅲ.在处理过程中,可替代空气的最佳试剂是
a.Cl2 b.Fe c.NaOH d.H2O2
③从“类维”角度设计一个吸收废气中SO2的反应,写出相应的离子方程式。
您最近一年使用:0次
4 . 以下是高中化学中的常见物质,根据要求完成下列问题:
①钠②过氧化钠③铜④硫酸⑤氯化铁
(1)①~⑤中属于电解质的是____ (填序号)。
(2)实验室中,金属钠着火能用来灭火的是____ (填标号)。
A.二氧化碳B.水C.干沙
(3)将包有少量过氧化钠固体的棉花放在石棉网上,用滴管向棉花上滴几滴水,棉花立刻燃烧起来。产生这一现象的原因是____ (用化学方程式表示)。
(4)铜能溶于热浓硫酸,写出该反应的化学方程式____ 。
(5)能用来检验溶液里含有Fe3+的试剂是____ 。
(6)向沸水中逐滴加入饱和氯化铁溶液,至液体呈透明的红褐色,可制得____ 胶体,判断实验成功的方法是____ 。
①钠②过氧化钠③铜④硫酸⑤氯化铁
(1)①~⑤中属于电解质的是
(2)实验室中,金属钠着火能用来灭火的是
A.二氧化碳B.水C.干沙
(3)将包有少量过氧化钠固体的棉花放在石棉网上,用滴管向棉花上滴几滴水,棉花立刻燃烧起来。产生这一现象的原因是
(4)铜能溶于热浓硫酸,写出该反应的化学方程式
(5)能用来检验溶液里含有Fe3+的试剂是
(6)向沸水中逐滴加入饱和氯化铁溶液,至液体呈透明的红褐色,可制得
您最近一年使用:0次
名校
5 . 某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如图:
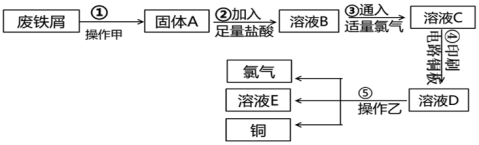
请回答下列问题:
(1)步骤①中操作甲是加饱和碳酸钠溶液并加热其作用是___________ 。
(2)写出步骤②中生成Fe2+的离子方程式___________ 。(写一个即可)
(3)若将③改加入H2O2,写出反应的离子方程式:___________ 。
(4)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是___________ (填序号)。
①先加氯水,后加KSCN溶液后显红色
②先加KSCN溶液,不显红色,再加氯水后显红色
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色
④只滴加KSCN溶液不显红色
A.①② B.②③ C.③④ D.①④
(5)溶液D中可能含有的金属阳离子___________ 。
(6)若除去氯化铜中的氯化铁可以加入试剂___________ 。(填序号,可选的试剂有A.NaOH B.CuO C.Fe粉 D.Cu(OH)2 E.CaO)

请回答下列问题:
(1)步骤①中操作甲是加饱和碳酸钠溶液并加热其作用是
(2)写出步骤②中生成Fe2+的离子方程式
(3)若将③改加入H2O2,写出反应的离子方程式:
(4)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是
①先加氯水,后加KSCN溶液后显红色
②先加KSCN溶液,不显红色,再加氯水后显红色
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色
④只滴加KSCN溶液不显红色
A.①② B.②③ C.③④ D.①④
(5)溶液D中可能含有的金属阳离子
(6)若除去氯化铜中的氯化铁可以加入试剂
您最近一年使用:0次
2021-07-26更新
|
777次组卷
|
3卷引用:福建省福州市八县一中2020-2021学年高一年下学期期末考化学试题
福建省福州市八县一中2020-2021学年高一年下学期期末考化学试题(已下线)专题3.1.3 铁盐与亚铁盐(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)江苏省海门中学2021-2022学年度高二上学期10月月考化学试题
名校
解题方法
6 . 氮、铁两种元素可以在细菌作用下发生氧化还原反应,实现两种元素在自然界的循环,循环中的部分转化如图所示。

(1)题图所示的氮循环中,属于氮的固定的有_______ (填字母)。
a.反硝化过程 b.硝化过程 c. 转化为
转化为
(2)农业生产过程中使用的铵态氮肥,是水体中铵态氮元素的来源之一、
①检验某氮肥样品中是否存在 的实验方法是
的实验方法是_______ 。
②实验室制备少量氨气反应的化学方程式为_______ 。
(3)铵态氮( )与亚硝态氮(
)与亚硝态氮( )在氨氧化细菌的作用下反应生成氮气,若产生
)在氨氧化细菌的作用下反应生成氮气,若产生 氮气,则转移电子的物质的量为
氮气,则转移电子的物质的量为_______  。
。
(4)题图所示土壤中的铁循环可用于水体脱氮(将氮元素从水体中除去),用离子方程式表示利用土壤中的铁循环脱除水体中铵态氮的原理:_______ 。
(5) 与硝态氮(
与硝态氮( )反应脱氮生成
)反应脱氮生成 ,反应后的溶液为
,反应后的溶液为 和
和 的混合溶液。为检验溶液中含有
的混合溶液。为检验溶液中含有 和
和 ,相应的实验方案为
,相应的实验方案为_______ (实验中可选用的试剂: 溶液、
溶液、 溶液、
溶液、 溶液)。
溶液)。

(1)题图所示的氮循环中,属于氮的固定的有
a.反硝化过程 b.硝化过程 c.
 转化为
转化为
(2)农业生产过程中使用的铵态氮肥,是水体中铵态氮元素的来源之一、
①检验某氮肥样品中是否存在
 的实验方法是
的实验方法是②实验室制备少量氨气反应的化学方程式为
(3)铵态氮(
 )与亚硝态氮(
)与亚硝态氮( )在氨氧化细菌的作用下反应生成氮气,若产生
)在氨氧化细菌的作用下反应生成氮气,若产生 氮气,则转移电子的物质的量为
氮气,则转移电子的物质的量为 。
。(4)题图所示土壤中的铁循环可用于水体脱氮(将氮元素从水体中除去),用离子方程式表示利用土壤中的铁循环脱除水体中铵态氮的原理:
(5)
 与硝态氮(
与硝态氮( )反应脱氮生成
)反应脱氮生成 ,反应后的溶液为
,反应后的溶液为 和
和 的混合溶液。为检验溶液中含有
的混合溶液。为检验溶液中含有 和
和 ,相应的实验方案为
,相应的实验方案为 溶液、
溶液、 溶液、
溶液、 溶液)。
溶液)。
您最近一年使用:0次
2021-07-07更新
|
479次组卷
|
6卷引用:福建省福州第四中学2021-2022学年高一下学期期末考试化学试题
7 . 在一小烧杯里混合10ml 0.01mol/L FeC13溶液和10ml 0.01mol/L KSCN溶液,溶液立即变为红色。
(1)写出反应的化学方程式:____________ 。
(2)再向溶液中滴入1mol/LFeC13溶液,现象_______________ ,平衡向_______ 反应方向移动,KSCN浓度会________________ 。
(3)在烧杯中加入KC1固体,颜色___________________ ,平衡_______ 移动。
(1)写出反应的化学方程式:
(2)再向溶液中滴入1mol/LFeC13溶液,现象
(3)在烧杯中加入KC1固体,颜色
您最近一年使用:0次
8 . 钠、铁及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有 、
、 、
、 、
、 等物质。当汽车发生碰撞时,
等物质。当汽车发生碰撞时, 迅速分解产生
迅速分解产生 和Na,同时放出大量的热,
和Na,同时放出大量的热, 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。
① 是助氧化剂,可处理产生的Na,其中氯元素的化合价是
是助氧化剂,可处理产生的Na,其中氯元素的化合价是_______ 。
② 是主氧化剂,也可处理产生的Na,反应为
是主氧化剂,也可处理产生的Na,反应为 ,反应中
,反应中 是
是_______ (填“还原产物”或“氧化产物”)。
③ 是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为
是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为_______ 。
(2)电子工业常用30%的 溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
① 溶液与金属铜发生反应的离子方程式为
溶液与金属铜发生反应的离子方程式为_______ 。
②除去 溶液中混有的
溶液中混有的 可加入
可加入_______ ,反应的离子方程式为_______ 。
③将 饱和溶液滴入沸水中,并继续加热至液体呈红褐色,制得分散系为
饱和溶液滴入沸水中,并继续加热至液体呈红褐色,制得分散系为_______ (填“溶液”“胶体”或“浊液”)。
(1)某汽车安全气囊的产气药剂主要含有
 、
、 、
、 、
、 等物质。当汽车发生碰撞时,
等物质。当汽车发生碰撞时, 迅速分解产生
迅速分解产生 和Na,同时放出大量的热,
和Na,同时放出大量的热, 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。①
 是助氧化剂,可处理产生的Na,其中氯元素的化合价是
是助氧化剂,可处理产生的Na,其中氯元素的化合价是②
 是主氧化剂,也可处理产生的Na,反应为
是主氧化剂,也可处理产生的Na,反应为 ,反应中
,反应中 是
是③
 是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为
是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为(2)电子工业常用30%的
 溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。①
 溶液与金属铜发生反应的离子方程式为
溶液与金属铜发生反应的离子方程式为②除去
 溶液中混有的
溶液中混有的 可加入
可加入③将
 饱和溶液滴入沸水中,并继续加热至液体呈红褐色,制得分散系为
饱和溶液滴入沸水中,并继续加热至液体呈红褐色,制得分散系为
您最近一年使用:0次
名校
解题方法
9 . (1)过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
①Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。Ca(OH)2+H2O2+6H2O=CaO2·8H2O,反应时通常加入过量的Ca(OH)2,其目的________________________________ 。
②向池塘水中加入一定量CaO2·8H2O后,池塘水中浓度增加的离子有________ (填序号)。
A.Ca2+ B.H+ C.CO32- D.OH-
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________ 。
A.KCl B.KClO3 C.MnO2 D.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________ (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是______________ (用离子方程式说明)。
①Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。Ca(OH)2+H2O2+6H2O=CaO2·8H2O,反应时通常加入过量的Ca(OH)2,其目的
②向池塘水中加入一定量CaO2·8H2O后,池塘水中浓度增加的离子有
A.Ca2+ B.H+ C.CO32- D.OH-
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有
A.KCl B.KClO3 C.MnO2 D.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,
您最近一年使用:0次
2020-02-14更新
|
148次组卷
|
2卷引用:福建省莆田第一中学2019-2020学年高一上学期期末复习化学试题
名校
10 . 在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义.分析下面处理方案,回答下列问题:

(1)试剂2是_____ ,固体B是_____ ,通往的气体C是_________ 。(填化学式)
(2)写出加入试剂1发生反应的离子方程式:__________ 、____________ 。

(1)试剂2是
(2)写出加入试剂1发生反应的离子方程式:
您最近一年使用:0次



