名校
1 . I.如图是利用电化学装置将SO2转化为重要的化工原料H2SO4的原理示意图。
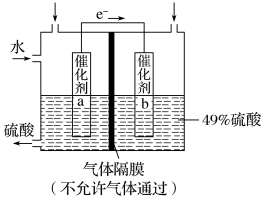
请回答下列问题:
(1)该装置将_______ 能转化为______ 能。
(2)催化剂b表面O2发生_______ 反应,其附近溶液酸性______ (填“增强”、“不变”或“减弱”)。
(3)催化剂a表面的电极反应式:_______ 。
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是______ 。
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是______ 。
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由______ 。
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为______ 。

请回答下列问题:
(1)该装置将
(2)催化剂b表面O2发生
(3)催化剂a表面的电极反应式:
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为
您最近一年使用:0次
2023-05-19更新
|
711次组卷
|
2卷引用:江西省宜春市高安市灰埠中学2022-2023学年高一下学期7月期末化学试题
解题方法
2 . 菠菜是常见食品,可以补充入体所必需的微量元素铁。某兴趣小组设计实验,探究菠菜中铁元素的价态并测定铁元素的含量,实验流程如下:

(1)上述实验中肯定不会用到下列仪器中的_______(填字母)。
(2)取少许水浸液于试管中,滴入几滴KSCN溶液,振荡,溶液颜色无明显变化,再滴加少量 和
和 ,溶液立即变红。据此探究实验可得到的结论是
,溶液立即变红。据此探究实验可得到的结论是_______ ,请写出滴加 发生反应的离子方程式
发生反应的离子方程式_______ 。
(3)该兴趣小组为了准确测得菠菜中铁的含量,设计如下实验方案:
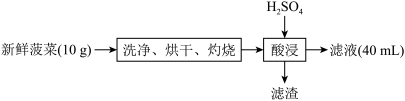
兴趣小组用“分光光度法”测得滤液中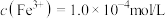 ,该菠菜中铁元素的含量为
,该菠菜中铁元素的含量为_______ mg/100g(保留三位有效数字)

(1)上述实验中肯定不会用到下列仪器中的_______(填字母)。
A. | B.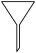 | C. | D. |
 和
和 ,溶液立即变红。据此探究实验可得到的结论是
,溶液立即变红。据此探究实验可得到的结论是 发生反应的离子方程式
发生反应的离子方程式(3)该兴趣小组为了准确测得菠菜中铁的含量,设计如下实验方案:

兴趣小组用“分光光度法”测得滤液中
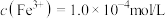 ,该菠菜中铁元素的含量为
,该菠菜中铁元素的含量为
您最近一年使用:0次
3 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是____ (填字母代号)。
(2)向沸水中逐滴滴加lmol/LFeCl3溶液,至____ ,该分散系中粒子直径的范围是____ nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:____ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:首先取少量待测溶液﹐滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是____ ,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,____ (填实验操作,下同)、洗涤、干燥,称量沉淀质量为43.05g。则待测溶液中,FeCl3的物质的量浓度为____ 。
(4)若要验证该溶液中含有Fe2+,正确的实验方法是____ (填字母代号)。
A.向试管中加入试液,滴入KSCN溶液,若显红色,证明含有Fe2+
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液,设计实验方案如图:

A.请写出上述实验中加入或生成的有关物质的化学式:①____ ;②____ ;③____ ;④____ 。
B.请写出通入⑥的化学方程式:_____ 。
(1)所含铁元素既有氧化性又有还原性的物质是
| A.Fe | B.FeCl2 | C.FeSO4 | D.Fe2O3 |
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(4)若要验证该溶液中含有Fe2+,正确的实验方法是
A.向试管中加入试液,滴入KSCN溶液,若显红色,证明含有Fe2+
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液,设计实验方案如图:

A.请写出上述实验中加入或生成的有关物质的化学式:①
B.请写出通入⑥的化学方程式:
您最近一年使用:0次
解题方法
4 . 材料与生产、生活和科技密切相关。回答下列问题:
(1)碘及其化合物主要用于医药、照相及染料等。从含碘的卤水中提取碘通常先往卤水中加CCl4,该提纯方法的名称为___________ ;为进一步分离I2和CCl4,再向其中加入浓NaOH溶液(所得水层中富含有I-和IO ),分液后再酸化,即得粗碘。写出I2与浓NaOH溶液反应的化学方程式
),分液后再酸化,即得粗碘。写出I2与浓NaOH溶液反应的化学方程式 ___________ 。
(2)金属材料的应用更是广泛。工业常用30%FeCl3溶液腐蚀绝缘板上铜箔,制造印刷电路板。腐蚀废液中含有Fe3+、Fe2+、Cu2+。当向腐蚀液中加入足量的铁粉后,一定不存在的离子是___________ 。
(1)碘及其化合物主要用于医药、照相及染料等。从含碘的卤水中提取碘通常先往卤水中加CCl4,该提纯方法的名称为
 ),分液后再酸化,即得粗碘。写出I2与浓NaOH溶液反应的化学方程式
),分液后再酸化,即得粗碘。写出I2与浓NaOH溶液反应的化学方程式 (2)金属材料的应用更是广泛。工业常用30%FeCl3溶液腐蚀绝缘板上铜箔,制造印刷电路板。腐蚀废液中含有Fe3+、Fe2+、Cu2+。当向腐蚀液中加入足量的铁粉后,一定不存在的离子是
您最近一年使用:0次
名校
解题方法
5 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是__ nm。
(2)中国古代四大发明之一的指南针是由天然磁石制成的,其主要成分是______ 。
(3)Fe跟Cl2在一定条件下反应,所得产物的化学式是________ 。将该产物溶于水配成溶液,向其中一支试管中滴加KSCN溶液,则溶液变成_______ 色。
(4)若Fe2+溶液中存在Fe3+,除去的方法是:_____ ;该反应的离子方程式:_____ 。
(5)在FeCl2溶液中逐滴滴加NaOH溶液,实验现象是____ ;所发生的离子反应方程式为:___ ;____ 。
(1)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)中国古代四大发明之一的指南针是由天然磁石制成的,其主要成分是
(3)Fe跟Cl2在一定条件下反应,所得产物的化学式是
(4)若Fe2+溶液中存在Fe3+,除去的方法是:
(5)在FeCl2溶液中逐滴滴加NaOH溶液,实验现象是
您最近一年使用:0次
解题方法
6 . 硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O,相对分子质量392]晶体又称莫尔盐,易溶易电离但却比一般的亚铁盐稳定,因此广泛应用于制药、电镀以及定量分析。回答下列与之有关的问题:
(1)在莫尔盐所涉及的五种元素中:
①S元素在门捷列夫元素周期表中的位置是______________ ;
②其中处于同主族的两种元素非金属性更强的是:_____________ 。
(2)为检验莫尔盐是否变质,可用的试剂为_______________ 。
碘是合成人体甲状腺激素的重要原料,食盐中加KIO3是我国为解决普遍性碘缺乏问题的国家规定,下图是自动电位滴定法测定食盐中碘含量的实验过程:
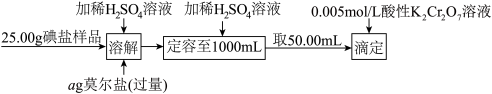
(3)已知“溶解”过程中IO3-的还原产物为碘单质,写出该反应的离子反应方程式:______________________________ 。
(4)取50. 00 mL样品,用0.005 mol/L酸性K2Cr2O7溶液滴定剩余Fe2+,滴定操作时使用的锥形瓶未干燥,导致结果_____________ (填“偏大”“偏小”或“无影响”)
(1)在莫尔盐所涉及的五种元素中:
①S元素在门捷列夫元素周期表中的位置是
②其中处于同主族的两种元素非金属性更强的是:
(2)为检验莫尔盐是否变质,可用的试剂为
碘是合成人体甲状腺激素的重要原料,食盐中加KIO3是我国为解决普遍性碘缺乏问题的国家规定,下图是自动电位滴定法测定食盐中碘含量的实验过程:

(3)已知“溶解”过程中IO3-的还原产物为碘单质,写出该反应的离子反应方程式:
(4)取50. 00 mL样品,用0.005 mol/L酸性K2Cr2O7溶液滴定剩余Fe2+,滴定操作时使用的锥形瓶未干燥,导致结果
您最近一年使用:0次
7 . I.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(1)写出符合下列条件的离子符号 :既能被氧化又能被还原的离子是______ ,加铁粉后溶液增重的是____ ;
(2)向Fe2+的溶液中滴加NaOH溶液,现象是__________________ 。
(3)除去FeCl2中FeCl3中所涉及的离子方程式:________________ 。
II.(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是:____________ ,该实验证明起漂白作用的是______ 。(填化学式)

(2)①氯气有毒,实验室吸收多余的氯气的原理是(用离子方程式表示)__________________ ;
②根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是_________ (填化学式)。
③长期露置于空气中的漂白粉会失效,失效的原因是(用化学方程式表示)___________________________ ,________________________ 。
④漂白粉是否完全失效可用稀盐酸检验,加稀盐酸后产生的气体是______ (填字母代号)。
A.O2 B.Cl2 C.CO2 D.HClO
(1)写出符合下列条件的
(2)向Fe2+的溶液中滴加NaOH溶液,现象是
(3)除去FeCl2中FeCl3中所涉及的离子方程式:
II.(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是:

(2)①氯气有毒,实验室吸收多余的氯气的原理是(用离子方程式表示)
②根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是
③长期露置于空气中的漂白粉会失效,失效的原因是(用化学方程式表示)
④漂白粉是否完全失效可用稀盐酸检验,加稀盐酸后产生的气体是
A.O2 B.Cl2 C.CO2 D.HClO
您最近一年使用:0次
名校
8 . 将铁粉、铜粉加入到盛有FeCl3、FeCl2、CuCl2的混合液的烧杯中,判断下列情况烧杯中的固体及金属阳离子(用化学式表示):
(1)若反应后铁粉有剩余,则一定有______________ 。
(2)若反应后有Cu2+和Cu,则不可能有_________ 。
(3)若反应后有Cu2+和Fe3+,则一定有_______________ 。
(1)若反应后铁粉有剩余,则一定有
(2)若反应后有Cu2+和Cu,则不可能有
(3)若反应后有Cu2+和Fe3+,则一定有
您最近一年使用:0次
2018-03-04更新
|
549次组卷
|
4卷引用:【全国百强校】江西省高安中学2017-2018学年高二下学期期末考试化学试题
【全国百强校】江西省高安中学2017-2018学年高二下学期期末考试化学试题山东省泰安市2017-2018学年高一上学期期末考试化学试题江西省会昌中学2020-2021学年高一上学期第二次月考化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》 第三单元 金属及其化合物单元测试 A卷
9 . 利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为_________ 。
②常温下,不能与M 单质发生反应的是_________ (填序号)。
a. CuSO4 溶液 b.Fe2O3c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气有多种方法,电化学法是其中之一。
该法制氢过程的示意图如下。反应池中反应物的流向采用气、液逆流方式,其目的是_____________ ;反应池中发生反应的化学方程式为_______________________________________ 。
反应后的溶液进入电解池,电解总反应的离子方程式为___________________________________ 。

(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为
②常温下,不能与M 单质发生反应的是
a. CuSO4 溶液 b.Fe2O3c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气有多种方法,电化学法是其中之一。
该法制氢过程的示意图如下。反应池中反应物的流向采用气、液逆流方式,其目的是
反应后的溶液进入电解池,电解总反应的离子方程式为

您最近一年使用:0次
解题方法
10 . 铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示:
Ⅰ.回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是______ nm。
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2,制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:___________ 。检验反应后溶液中还存在Fe3+的试剂是__________ 。
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是______ 。
Ⅱ.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(4)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是______ ,加铁粉后溶液增重的是 _____________ (填写离子符号)
(5)向Fe2+的溶液中滴加NaOH溶液,现象是___________________ 。
(6)欲除去FeCl2中FeCl3选用的试剂是________ ,并写出相应离子方程式:__________ 。
Ⅰ.回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2,制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是
Ⅱ.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(4)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是
(5)向Fe2+的溶液中滴加NaOH溶液,现象是
(6)欲除去FeCl2中FeCl3选用的试剂是
您最近一年使用:0次
2018-01-31更新
|
212次组卷
|
2卷引用:江西省临川实验学校2017-2018学年高一上学期期末质量检测化学试题



