名校
1 . 根据信息书写指定反应的方程式。
(1)请从下列试剂中选择合适的完成指定转化(试剂可以重复选择)。
试剂:稀硫酸、氨水、HI(强酸)溶液、 溶液、NaCl溶液、NaOH溶液
溶液、NaCl溶液、NaOH溶液
①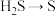 的离子方程式:
的离子方程式:____________ 。
② 的离子方程式:
的离子方程式:____________ 。
③ (两性氧化物)
(两性氧化物) 的
的化学方程式 :____________ 。
(2)CuCl常用作杀菌剂、催化剂等。一种利用废弃铜锌合金制取CuCl的流程如下图所示:化学方程式 :____________ 。
②写出氧化步骤时发生的主要反应的离子方程式:____________ 。
③写出沉铜步骤时发生的主要反应的离子方程式:____________ 。
(1)请从下列试剂中选择合适的完成指定转化(试剂可以重复选择)。
试剂:稀硫酸、氨水、HI(强酸)溶液、
 溶液、NaCl溶液、NaOH溶液
溶液、NaCl溶液、NaOH溶液①
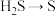 的离子方程式:
的离子方程式:②
 的离子方程式:
的离子方程式:③
 (两性氧化物)
(两性氧化物) 的
的(2)CuCl常用作杀菌剂、催化剂等。一种利用废弃铜锌合金制取CuCl的流程如下图所示:
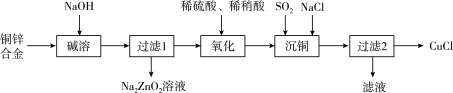
②写出氧化步骤时发生的主要反应的离子方程式:
③写出沉铜步骤时发生的主要反应的离子方程式:
您最近一年使用:0次
名校
2 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)甲组同学取2mLFeSO4溶液,加入1滴KSCN溶液,再加入几滴氯水,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为___________ 。
(2)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是___________ 。
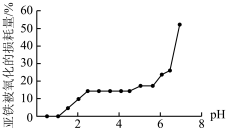
(3)丙组同学研究pH对FeSO4稳定性的影响,得到如图所示结果,增强Fe2+稳定性的措施为___________ 。(写出一条即可)
(4)丁组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:

①Fe3+与Cu反应的离子方程式为___________ 。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN-的化学性质与I-相似;
iii.2Cu2++4I-=2CuI↓+I2。
填写实验方案:
Cu2+与SCN-反应的离子方程式为___________ 。
(1)甲组同学取2mLFeSO4溶液,加入1滴KSCN溶液,再加入几滴氯水,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为
(2)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是
(3)丙组同学研究pH对FeSO4稳定性的影响,得到如图所示结果,增强Fe2+稳定性的措施为

(4)丁组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:

①Fe3+与Cu反应的离子方程式为
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN-的化学性质与I-相似;
iii.2Cu2++4I-=2CuI↓+I2。
填写实验方案:
| 实验方案 | 现象 |
| 步骤1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 无明显现象 |
| 步骤2:取4mL | 产生白色沉淀 |
您最近一年使用:0次
名校
3 . 如下图为铁及其化合物的“价一类”二维图。
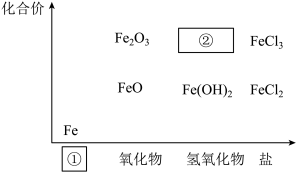
(1)填写二维图缺失的类别①___________ 和化学式②___________ 。
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:
①Cl2②Fe③NaOH④H2SO4⑤AgNO3
i.从物质类别上看,FeCl3属于___________ ,可能与___________ 发生反应(填序号)。
ii.从化合价角度看,Fe3+具有___________ 性,可能与___________ 发生反应(填序号)。
(3)某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,其化学原理为如下反应:Cu+2FeCl3=CuCl2+2FeCl2
①FeCl3在反应中作___________ 剂。
②该反应的离子方程式为___________ 。

(1)填写二维图缺失的类别①
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:
①Cl2②Fe③NaOH④H2SO4⑤AgNO3
i.从物质类别上看,FeCl3属于
ii.从化合价角度看,Fe3+具有
(3)某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,其化学原理为如下反应:Cu+2FeCl3=CuCl2+2FeCl2
①FeCl3在反应中作
②该反应的离子方程式为
您最近一年使用:0次
名校
4 . “纳米零价铁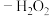 ”体系可将烟气中难溶的
”体系可将烟气中难溶的 氧化为
氧化为 或
或 。
。
(1)制备纳米零价铁:将 溶液与
溶液与 溶液混合可生成纳米零价铁、
溶液混合可生成纳米零价铁、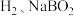 、
、 和水,该反应的化学方程式为
和水,该反应的化学方程式为___________ 。(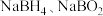 中
中 元素均为
元素均为 价)。
价)。
(2) 的氧化:在一定温度下,将
的氧化:在一定温度下,将 溶液和
溶液和 溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的
溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的 氧化。
氧化。
① 催化
催化 分解产生
分解产生 ,
, 在
在 溶液将
溶液将 氧化为
氧化为 的机理如图1所示,
的机理如图1所示, 的化学式为
的化学式为___________ 。(提示: 中
中 为
为 价,
价, 中
中 为
为 价)
价)
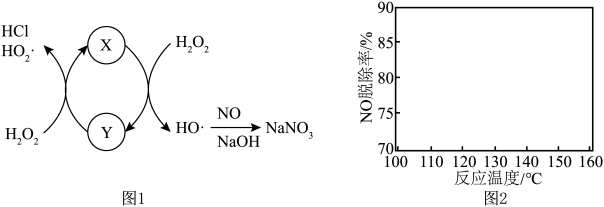
② 与
与 反应生成
反应生成 和一种液体,则化学方程式为
和一种液体,则化学方程式为___________ 。
③纳米零价铁的作用是___________ 。
④ 脱除率随温度的变化如图2所示。温度高于
脱除率随温度的变化如图2所示。温度高于 时,
时, 脱除率随温度升高呈现下降趋势的主要原因是
脱除率随温度升高呈现下降趋势的主要原因是___________ 。

(3)氧化产物的吸收:在酸性条件下 氧化后的产物被
氧化后的产物被 溶液吸收,转化为
溶液吸收,转化为___________ (填化学式)。
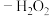 ”体系可将烟气中难溶的
”体系可将烟气中难溶的 氧化为
氧化为 或
或 。
。(1)制备纳米零价铁:将
 溶液与
溶液与 溶液混合可生成纳米零价铁、
溶液混合可生成纳米零价铁、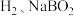 、
、 和水,该反应的化学方程式为
和水,该反应的化学方程式为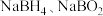 中
中 元素均为
元素均为 价)。
价)。(2)
 的氧化:在一定温度下,将
的氧化:在一定温度下,将 溶液和
溶液和 溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的
溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的 氧化。
氧化。①
 催化
催化 分解产生
分解产生 ,
, 在
在 溶液将
溶液将 氧化为
氧化为 的机理如图1所示,
的机理如图1所示, 的化学式为
的化学式为 中
中 为
为 价,
价, 中
中 为
为 价)
价)
②
 与
与 反应生成
反应生成 和一种液体,则化学方程式为
和一种液体,则化学方程式为③纳米零价铁的作用是
④
 脱除率随温度的变化如图2所示。温度高于
脱除率随温度的变化如图2所示。温度高于 时,
时, 脱除率随温度升高呈现下降趋势的主要原因是
脱除率随温度升高呈现下降趋势的主要原因是
(3)氧化产物的吸收:在酸性条件下
 氧化后的产物被
氧化后的产物被 溶液吸收,转化为
溶液吸收,转化为
您最近一年使用:0次
5 . 去除水体中砷的技术主要有物理吸附法及化学氧化法。
(1)物理吸附法
用活性面料负载纳米二氧化钛吸附水中的砷,纳米二氧化钛投加量对活性炭去除砷效果如图1所示:

①纳米二氧化钛投加量为___________ 时,砷的吸附量可达最大。随着纳米二氧化钛投加量继续增大,砷的吸附量反而减小,可能的原因是___________ 。
②未加二氧化钛时就有一定的吸附砷的能力,可能的原因是___________ 。
(2)化学氧化法
该方法须将废水中的As(Ⅲ)用空气或铁离子氧化为As(Ⅴ),然后再去除,为了探究As(Ⅲ)被哪种氧化剂氧化,设计如下实验:取含As(Ⅲ)废水,在pH分别为1~10条件下反应1h后,过滤,测定滤液中三价铁和二价铁的含量,得出不同pH下三价铁和二价铁的浓度随pH变化如图2所示:
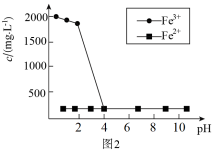
①pH在3~4时 浓度变化的主要原因为
浓度变化的主要原因为___________ 。
②由实验可知废水中的As(Ⅲ)主要被___________ 氧化为As(Ⅴ),理由为___________ 。
(1)物理吸附法
用活性面料负载纳米二氧化钛吸附水中的砷,纳米二氧化钛投加量对活性炭去除砷效果如图1所示:

①纳米二氧化钛投加量为
②未加二氧化钛时就有一定的吸附砷的能力,可能的原因是
(2)化学氧化法
该方法须将废水中的As(Ⅲ)用空气或铁离子氧化为As(Ⅴ),然后再去除,为了探究As(Ⅲ)被哪种氧化剂氧化,设计如下实验:取含As(Ⅲ)废水,在pH分别为1~10条件下反应1h后,过滤,测定滤液中三价铁和二价铁的含量,得出不同pH下三价铁和二价铁的浓度随pH变化如图2所示:

①pH在3~4时
 浓度变化的主要原因为
浓度变化的主要原因为②由实验可知废水中的As(Ⅲ)主要被
您最近一年使用:0次
名校
6 . 硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]又称莫尔盐,是一种浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如图:
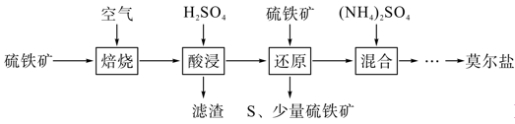
(1)“焙烧”时发生的主要反应是4FeS2+11O2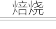 2Fe2O3+8SO2,则“酸浸”时,滤渣的主要成分是
2Fe2O3+8SO2,则“酸浸”时,滤渣的主要成分是_____ (写化学式)。
(2)“酸浸”时发生的主要反应的离子方程式为_____ 。
(3)证明“还原”后所得溶液中不含有Fe3+的实验方法是:取少许晶体置于试管中,加少量水溶解,滴加_____ 溶液,若无明显现象,则不含有Fe3+。

(1)“焙烧”时发生的主要反应是4FeS2+11O2
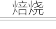 2Fe2O3+8SO2,则“酸浸”时,滤渣的主要成分是
2Fe2O3+8SO2,则“酸浸”时,滤渣的主要成分是(2)“酸浸”时发生的主要反应的离子方程式为
(3)证明“还原”后所得溶液中不含有Fe3+的实验方法是:取少许晶体置于试管中,加少量水溶解,滴加
您最近一年使用:0次
名校
7 . 某兴趣小组研究亚硝酸钠,查阅资料得表中信息,试回答下列问题。
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥法表示电子转移的方向和数目。_______ ;该反应中氧化剂是_______ ;若有0.75 mol电子转移,则被还原的氧化剂的物质的量为_______ 。
(2)某工厂废液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是_______ (填序号)。
A.NH4Cl B.HNO3 C.浓硫酸
(3)下列方法中,可用来区分NaNO2和NaCl的是_______ (填序号)。
A.观察外观
B.滴加酸化的含有KSCN溶液的FeSO4溶液
C.在酸性条件下加入淀粉KI溶液
(4)某同学把新制氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______
| 药品 | NaNO2(亚硝酸钠) |
| 性质 | 在酸性溶液中有较强的氧化性,能将Fe2+氧化成Fe3+ |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥法表示电子转移的方向和数目。
(2)某工厂废液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是
A.NH4Cl B.HNO3 C.浓硫酸
(3)下列方法中,可用来区分NaNO2和NaCl的是
A.观察外观
B.滴加酸化的含有KSCN溶液的FeSO4溶液
C.在酸性条件下加入淀粉KI溶液
(4)某同学把新制氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:
您最近一年使用:0次
8 . 根据所学知识,回答下列问题:
(1)人们通过焰色试验制造了绚丽多彩的烟花,下列焰色为紫色的是___ 。(填序号)
a.K2CO3 b.NaCl c.CuSO4
(2)同温同压下,同体积的NH3和H2S气体的质量比为___ ;同质量的NH3和H2S中氢原子的个数比为___ 。
(3)将19gMgCl2溶于水配制成1L溶液。溶液中MgCl2的物质的量浓度为___ ;从中取出50mL溶液,其中含有Cl-的物质的量为___ 。
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①检验溶液中Fe3+存在的试剂是___ 溶液(填名称)。
②写出FeCl3溶液与金属铜发生反应的离子方程式:___ 。
③写出FeCl2溶液通入Cl2反应的化学方程式:___ 。
(1)人们通过焰色试验制造了绚丽多彩的烟花,下列焰色为紫色的是
a.K2CO3 b.NaCl c.CuSO4
(2)同温同压下,同体积的NH3和H2S气体的质量比为
(3)将19gMgCl2溶于水配制成1L溶液。溶液中MgCl2的物质的量浓度为
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①检验溶液中Fe3+存在的试剂是
②写出FeCl3溶液与金属铜发生反应的离子方程式:
③写出FeCl2溶液通入Cl2反应的化学方程式:
您最近一年使用:0次
名校
9 . 氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)NaClO中Cl的化合价为__ ,有较强的___ (填氧化、还原)性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式__ 。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为__ 。
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的个数之比为__ 。
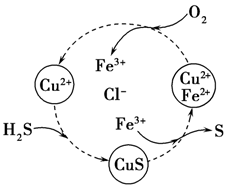
(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。在图示的转化过程中,化合价保持不变的元素有___ 。该图示的总反应的化学方程式为___ 。
(1)NaClO中Cl的化合价为
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的个数之比为
(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。在图示的转化过程中,化合价保持不变的元素有

您最近一年使用:0次
名校
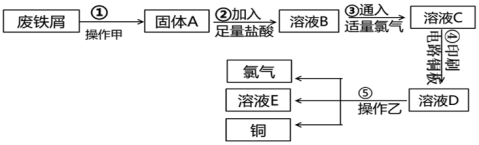
10 . 某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如图:
请回答下列问题:
(1)步骤①中操作甲是加饱和碳酸钠溶液并加热其作用是___________ 。
(2)写出步骤②中生成Fe2+的离子方程式___________ 。(写一个即可)
(3)若将③改加入H2O2,写出反应的离子方程式:___________ 。
(4)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是___________ (填序号)。
①先加氯水,后加KSCN溶液后显红色
②先加KSCN溶液,不显红色,再加氯水后显红色
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色
④只滴加KSCN溶液不显红色
A.①② B.②③ C.③④ D.①④
(5)溶液D中可能含有的金属阳离子___________ 。
(6)若除去氯化铜中的氯化铁可以加入试剂___________ 。(填序号,可选的试剂有A.NaOH B.CuO C.Fe粉 D.Cu(OH)2 E.CaO)

请回答下列问题:
(1)步骤①中操作甲是加饱和碳酸钠溶液并加热其作用是
(2)写出步骤②中生成Fe2+的离子方程式
(3)若将③改加入H2O2,写出反应的离子方程式:
(4)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是
①先加氯水,后加KSCN溶液后显红色
②先加KSCN溶液,不显红色,再加氯水后显红色
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色
④只滴加KSCN溶液不显红色
A.①② B.②③ C.③④ D.①④
(5)溶液D中可能含有的金属阳离子
(6)若除去氯化铜中的氯化铁可以加入试剂
您最近一年使用:0次
2021-07-26更新
|
773次组卷
|
3卷引用:江苏省海门中学2021-2022学年度高二上学期10月月考化学试题
江苏省海门中学2021-2022学年度高二上学期10月月考化学试题福建省福州市八县一中2020-2021学年高一年下学期期末考化学试题(已下线)专题3.1.3 铁盐与亚铁盐(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)



