名校
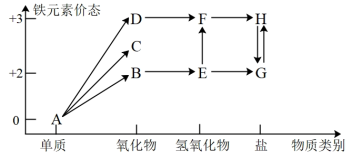
1 . 铁是人类较早使用的金属之一,下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系。运用铁及其化合物的知识,回答下列问题。_______ ;E→F反应的化学方程式是_______ ,该反应过程的现象为_______ 。
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,高铁酸钾作为自来水处理剂的优点_______ ;湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式
、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式_______ 。
(3)将FeCl3饱和溶液滴入沸水中,继续煮沸至液体呈_______ ,制得分散系为_______ ,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_______ 。
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路请写出FeCl3溶液与铜反应的离子方程式:_______ 。
(5)城市饮用水处理新技术用NaClO2、高铁酸钠代替Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么NaClO2、Na2FeO4、Cl2的消毒效率由大到小的顺序是_______ 。
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,高铁酸钾作为自来水处理剂的优点
 、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式
、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式(3)将FeCl3饱和溶液滴入沸水中,继续煮沸至液体呈
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路请写出FeCl3溶液与铜反应的离子方程式:
(5)城市饮用水处理新技术用NaClO2、高铁酸钠代替Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么NaClO2、Na2FeO4、Cl2的消毒效率由大到小的顺序是
您最近一年使用:0次
2 . 金属材料对于促进生产发展、改善人类生活发挥了巨大作用。请回答下列关于金属及其化合物的问题:
(1)若加入铝粉能放出氢气的溶液中分别加入下列各组离子,可能共存的是_______。
(2)实验室里保存 溶液时,常在溶液中加入
溶液时,常在溶液中加入_______ ,其目的为_______ 。
(3)实验室配制 溶液时,为了防止
溶液时,为了防止 水解,需要将
水解,需要将 溶于稀硫酸中,再加水稀释。现需配制
溶于稀硫酸中,再加水稀释。现需配制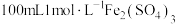 溶液,需要用托盘天平称量
溶液,需要用托盘天平称量_______ g 晶体,配制该溶液所需玻璃仪器除了烧杯、玻璃棒、量筒外,还需要
晶体,配制该溶液所需玻璃仪器除了烧杯、玻璃棒、量筒外,还需要_______ ;如果配制时俯视定容,那么所配溶液的浓度_______ (填“偏大”、“小”或“无影响”)。
(4)除杂:(括号内为杂质)
①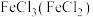 除杂试剂为
除杂试剂为_______ (填化学式),离子方程式为_______ ;
②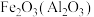 除杂试剂为
除杂试剂为_______ (填化学式),离子方程式为_______ 。
(1)若加入铝粉能放出氢气的溶液中分别加入下列各组离子,可能共存的是_______。
A.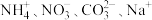 | B.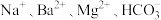 |
C.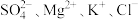 | D.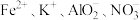 |
 溶液时,常在溶液中加入
溶液时,常在溶液中加入(3)实验室配制
 溶液时,为了防止
溶液时,为了防止 水解,需要将
水解,需要将 溶于稀硫酸中,再加水稀释。现需配制
溶于稀硫酸中,再加水稀释。现需配制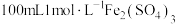 溶液,需要用托盘天平称量
溶液,需要用托盘天平称量 晶体,配制该溶液所需玻璃仪器除了烧杯、玻璃棒、量筒外,还需要
晶体,配制该溶液所需玻璃仪器除了烧杯、玻璃棒、量筒外,还需要(4)除杂:(括号内为杂质)
①
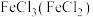 除杂试剂为
除杂试剂为②
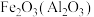 除杂试剂为
除杂试剂为
您最近一年使用:0次
3 . 金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请回答下列问题
(1)31号元素镓(Ga)与铝同族。镓(Ga)在周期表的位置是___________ ;写出镓的氯化物和氨水反应的化学方程式___________ 。铍、铝二者的单质、化合物均具有相似的化学性质,写出BeCl2溶液与Na2BeO2的水溶液混合的化学方程式___________ 。
(2)人类最早使用的金属材料的主要成分是铜。下列有关铜元素的说法中,不正确的是___________(填字母)
(3)在稀 溶液中加入适量
溶液中加入适量 溶液至
溶液至 恰好完全沉淀,此时铝元素的存在形式主要为
恰好完全沉淀,此时铝元素的存在形式主要为___________ (用化学式表示)。
(4)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
①该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理___________ (填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所涉及的反应的离子方程式为___________ 。
③另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.该同学的实验方案是否合理?___________ (填“合理”或“不合理”)。理由:___________ 。
(1)31号元素镓(Ga)与铝同族。镓(Ga)在周期表的位置是
(2)人类最早使用的金属材料的主要成分是铜。下列有关铜元素的说法中,不正确的是___________(填字母)
| A.青铜、不锈钢、硬铝都是合金 |
| B.铜表面易形成致密的氧化膜 |
| C.铜与O2反应生成黑色的CuO |
| D.CuSO4·5H2O是一种混合物,加热后变为白色固体 |
 溶液中加入适量
溶液中加入适量 溶液至
溶液至 恰好完全沉淀,此时铝元素的存在形式主要为
恰好完全沉淀,此时铝元素的存在形式主要为(4)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
①该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所涉及的反应的离子方程式为
③另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.该同学的实验方案是否合理?
您最近一年使用:0次
4 . 中学化学教材中涉及许多金属和非金属元素,掌握它们的单质及其化合物的性质是学好化学的基础。回答下列问题:
(1) 的结构式为
的结构式为___________ ,过氧化钠的电子式为___________ 。
(2)黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠( ),该反应的化学方程式为
),该反应的化学方程式为___________ ,其中还原剂和氧化剂的质量比为___________ ;根据题意可判断 是
是___________ 元酸(填“一”“二”或“三”)。
(3)向含有1mol 和1mol
和1mol 的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。
的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。

①写出生成a的离子方程式:___________ 。
②n1=___________ 。
③向P点溶液中加入铜粉,反应的离子方程式为___________ ,最多可溶解铜粉___________ g。
(1)
 的结构式为
的结构式为(2)黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(
 ),该反应的化学方程式为
),该反应的化学方程式为 是
是(3)向含有1mol
 和1mol
和1mol 的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。
的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。
①写出生成a的离子方程式:
②n1=
③向P点溶液中加入铜粉,反应的离子方程式为
您最近一年使用:0次
2021-12-07更新
|
240次组卷
|
3卷引用:湖北省部分学校2021-2022学年高三上学期11月质量检测化学试题
湖北省部分学校2021-2022学年高三上学期11月质量检测化学试题(已下线)第14练 化学键-2022年【寒假分层作业】高一化学(人教版2019)安徽省皖优联盟2023届高三上学期第一次阶段测试化学试题
5 . 铁是生产生活中重要的金属,其单质和化合物在生活中有很广泛的用途。请回答:
(1)红热的铁能跟水蒸气反应,有一种产物是可燃性气体,则其化学反应方程式为___________ 。
(2)缺铁性贫血患者应补充 Fe2+。用绿矾制成的补铁剂药片外表包有一层特殊的糖衣,试推测糖衣的作用是___________ 。
(3)向某溶液中加入KSCN溶液,溶液立即变成红色,则原溶液中含有(填离子符号)___________ ,要除去FeCl3溶液中少量的氯化亚铁,可行的办法是___________ (填字母)。
A.加入铜粉 B.加入铁粉 C.通入氯气 D.加入KSCN溶液
(4)四氧化三铁是生产生活常见的一种铁的氧化物。它溶于盐酸的离子方程式为___________ 。
(5)高铁酸钾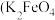 ,其中铁为+6价)可消毒饮用水和除悬浮物。投入水中可发生如下反应:
,其中铁为+6价)可消毒饮用水和除悬浮物。投入水中可发生如下反应: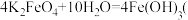 胶体
胶体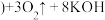
①该反应中被氧化的元素是___________ (填元素符号)。
②高铁酸钾能够消毒饮用水是因为其具有强氧化性,能除悬浮物的原因是___________ 。
(1)红热的铁能跟水蒸气反应,有一种产物是可燃性气体,则其化学反应方程式为
(2)缺铁性贫血患者应补充 Fe2+。用绿矾制成的补铁剂药片外表包有一层特殊的糖衣,试推测糖衣的作用是
(3)向某溶液中加入KSCN溶液,溶液立即变成红色,则原溶液中含有(填离子符号)
A.加入铜粉 B.加入铁粉 C.通入氯气 D.加入KSCN溶液
(4)四氧化三铁是生产生活常见的一种铁的氧化物。它溶于盐酸的离子方程式为
(5)高铁酸钾
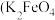 ,其中铁为+6价)可消毒饮用水和除悬浮物。投入水中可发生如下反应:
,其中铁为+6价)可消毒饮用水和除悬浮物。投入水中可发生如下反应: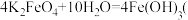 胶体
胶体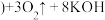
①该反应中被氧化的元素是
②高铁酸钾能够消毒饮用水是因为其具有强氧化性,能除悬浮物的原因是
您最近一年使用:0次
2021-02-23更新
|
472次组卷
|
4卷引用:湖北省鄂州市2020-2021学年高一上学期期末质量监测化学试题
湖北省鄂州市2020-2021学年高一上学期期末质量监测化学试题(已下线)第14讲 铁的单质、氧化物和氢氧化物(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )黑龙江省牡丹江穆棱市第二中学2021-2022学年高一上学期期末考试化学试题(已下线)第12讲 铁、亚铁盐和铁盐-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)
名校
解题方法
6 . 化学与人类生活密切相关。请按要求,回答下列问题:
(1)现有以下生产、生活中常见的物质
A.铜丝B.蔗糖C.NaCl晶体D.醋酸溶液E.医用酒精F.Na2CO3粉末G.氨气
①属于电解质是___________ (填写序号,下同);②在上述所给状态下能导电的是___________ 。
(2)高铁酸钾(K2FeO4)是水处理过程中使用的一种新型消毒剂。可在碱性条件下,用NaClO氧化Fe(OH)3来制备,请配平反应方程式:____ClO-+_____Fe(OH)3+___OH-=_______ +____+___Cl-。
+____+___Cl-。_______ ,向制得的Na2FeO4溶液中加入适量的饱和KOH溶液会析出K2FeO4晶体,写出该反应的离子方程式:___________ 。
(3)病人输液用的葡萄糖注射液是葡萄糖(化学式:C6H12O6)的水溶液,其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:

①葡萄糖的摩尔质量为___________ 。
②该注射液中葡萄糖的物质的量浓度为___________ 。(保留两位小数)
(4)人体中含有铁元素,+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分,缺铁会引起贫血问题。已知含亚铁离子的溶液易被氧化为Fe3+,现有某品牌补铁口服液,检验其中是否含有Fe3+的方法及操作是:___________ 。
(1)现有以下生产、生活中常见的物质
A.铜丝B.蔗糖C.NaCl晶体D.醋酸溶液E.医用酒精F.Na2CO3粉末G.氨气
①属于电解质是
(2)高铁酸钾(K2FeO4)是水处理过程中使用的一种新型消毒剂。可在碱性条件下,用NaClO氧化Fe(OH)3来制备,请配平反应方程式:____ClO-+_____Fe(OH)3+___OH-=_______
 +____+___Cl-。
+____+___Cl-。(3)病人输液用的葡萄糖注射液是葡萄糖(化学式:C6H12O6)的水溶液,其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:

①葡萄糖的摩尔质量为
②该注射液中葡萄糖的物质的量浓度为
(4)人体中含有铁元素,+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分,缺铁会引起贫血问题。已知含亚铁离子的溶液易被氧化为Fe3+,现有某品牌补铁口服液,检验其中是否含有Fe3+的方法及操作是:
您最近一年使用:0次
解题方法
7 . (1)1mol 乙烷在氧气中完全燃烧生成二氧化碳和液态水,放出热量 1558.3kJ。写出 乙烷燃烧的热化学方程式:__________________ 。
(2)已知:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-113.0 kJ·mol-1
则反应 NO2(g)+SO2(g)=SO3(g)+NO(g)的 ΔH=_______________ kJ·mol-1。
(3)向盛有10mL0.01 mol/L 的硫氰化钾溶液的小烧杯中,加入10mol0.01mol/L的FeCl3溶液,混合液立即___ 。写出上述反应的离子方程式____________________ 。
(2)已知:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-113.0 kJ·mol-1
则反应 NO2(g)+SO2(g)=SO3(g)+NO(g)的 ΔH=
(3)向盛有10mL0.01 mol/L 的硫氰化钾溶液的小烧杯中,加入10mol0.01mol/L的FeCl3溶液,混合液立即
您最近一年使用:0次
2020-11-25更新
|
63次组卷
|
2卷引用:湖北省宜城市第三高级中学2020-2021学年高二上学期10月月考化学试题
名校
解题方法
8 . 某“铁基脱氧剂”的主要成分是还原 粉,使用一段时间后部分
粉,使用一段时间后部分 粉会变质为
粉会变质为 。将一包使用过一段时间后的脱氧剂用稀盐酸浸泡,浸泡过程中粉末表面有大量细小无色气泡产生。
。将一包使用过一段时间后的脱氧剂用稀盐酸浸泡,浸泡过程中粉末表面有大量细小无色气泡产生。
(1)溶液中的反应有: 、
、 、
、________________ 。
(2)甲同学用如下方法验证了溶液中 的存在:取少量上层清液,加入某试剂X,出现白色沉淀,并很快变为灰绿色,将沉淀倾倒在滤纸上,沉淀逐渐变为红褐色。试剂X为
的存在:取少量上层清液,加入某试剂X,出现白色沉淀,并很快变为灰绿色,将沉淀倾倒在滤纸上,沉淀逐渐变为红褐色。试剂X为____________ 。滤纸上沉淀变化反应的化学方程式为____________________________ 。
(3)乙同学另取少量上层溶液,滴加氯水后溶液呈棕黄色,再滴加 溶液,溶液变红。滴加氯水后溶液变棕黄的离子方程式为
溶液,溶液变红。滴加氯水后溶液变棕黄的离子方程式为____________________________ 。丙同学认为 不一定是由氯水反应得到的,理由是
不一定是由氯水反应得到的,理由是____________________________ ,改进方案是____________________________ 。
 粉,使用一段时间后部分
粉,使用一段时间后部分 粉会变质为
粉会变质为 。将一包使用过一段时间后的脱氧剂用稀盐酸浸泡,浸泡过程中粉末表面有大量细小无色气泡产生。
。将一包使用过一段时间后的脱氧剂用稀盐酸浸泡,浸泡过程中粉末表面有大量细小无色气泡产生。(1)溶液中的反应有:
 、
、 、
、(2)甲同学用如下方法验证了溶液中
 的存在:取少量上层清液,加入某试剂X,出现白色沉淀,并很快变为灰绿色,将沉淀倾倒在滤纸上,沉淀逐渐变为红褐色。试剂X为
的存在:取少量上层清液,加入某试剂X,出现白色沉淀,并很快变为灰绿色,将沉淀倾倒在滤纸上,沉淀逐渐变为红褐色。试剂X为(3)乙同学另取少量上层溶液,滴加氯水后溶液呈棕黄色,再滴加
 溶液,溶液变红。滴加氯水后溶液变棕黄的离子方程式为
溶液,溶液变红。滴加氯水后溶液变棕黄的离子方程式为 不一定是由氯水反应得到的,理由是
不一定是由氯水反应得到的,理由是
您最近一年使用:0次
2020-09-10更新
|
453次组卷
|
7卷引用:湖北省利川市第五中学2019-2020学年高一12月月考化学试题
解题方法
9 . 人体中含有铁元素,+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。
(l)误服亚硝酸盐会使人中毒,是因为二价铁被___ (填“氧化”或“还原”)成三价铁,此 时服用维生素C可缓解亚硝酸盐中毒,维生素C在此过程中是作____ (填“氧化剂”或“还原剂”)。
(2)现有一瓶久置的FeSO4溶液,请设计实验检验其中是否含有Fe3+:___ 。Fe2+在空气中易发生氧化还原反应而变质,可加入____ (填化学式)来防止其变质,而又不会使溶液中有新的杂质。
(3)高铁酸钾(K2FeO4)是水处理过程中使用的一种新型消毒剂。可在碱性条件下,用NaCIO氧化Fe(OH)3来制备,请配平反应方程式:____ ClO—+____ Fe(OH)3+____ OH— =____ FeO42—+_________ +____ Cl—。
(4)向制得的Na2FeO4溶液中加入适量的饱和KOH溶液会析出K2FeO4,写出该反应的化学方程式:____ 。
(l)误服亚硝酸盐会使人中毒,是因为二价铁被
(2)现有一瓶久置的FeSO4溶液,请设计实验检验其中是否含有Fe3+:
(3)高铁酸钾(K2FeO4)是水处理过程中使用的一种新型消毒剂。可在碱性条件下,用NaCIO氧化Fe(OH)3来制备,请配平反应方程式:
(4)向制得的Na2FeO4溶液中加入适量的饱和KOH溶液会析出K2FeO4,写出该反应的化学方程式:
您最近一年使用:0次
2020-01-30更新
|
176次组卷
|
2卷引用:湖北省十堰市2019-2020学年高一上学期期末调研考试化学试题
解题方法
10 . 化学学习活动小组学习了铁、铜化合物知识后,查阅资料,积极思考,提出了一系列问题,请予以解答:
(1)氯化亚铜(CuCl)是重要的化工原料,工业上常通过下列反应制备CuCl:
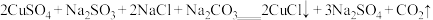
查阅资料可得,CuCl可以溶解在 溶液中,请写出该反应的离子方程式:
溶液中,请写出该反应的离子方程式:_________________ 。
(2)已知:Cu2O在酸性溶液中发生歧化反应: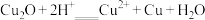
现将一定量混合物(Fe2O3、Cu2O、CuCl、Fe)溶解于过量稀盐酸中,反应完全后,得到W(包括溶液和少量剩余固体),此时溶液中一定含有的阳离子是________________ (用离子符号表示)。
(3)继续往W中通入足量的氯气,不断搅拌,充分反应,溶液中哪些离子的物质的量一定有明显变化?______________________ (用离子符号表示)。
(4)不通入气体,改往W中加入过量铁粉,过滤,调节pH约为7,加入淀粉 溶液和
溶液和 ,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是
,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是______ 。
(1)氯化亚铜(CuCl)是重要的化工原料,工业上常通过下列反应制备CuCl:
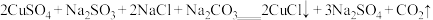
查阅资料可得,CuCl可以溶解在
 溶液中,请写出该反应的离子方程式:
溶液中,请写出该反应的离子方程式:(2)已知:Cu2O在酸性溶液中发生歧化反应:
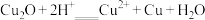
现将一定量混合物(Fe2O3、Cu2O、CuCl、Fe)溶解于过量稀盐酸中,反应完全后,得到W(包括溶液和少量剩余固体),此时溶液中一定含有的阳离子是
(3)继续往W中通入足量的氯气,不断搅拌,充分反应,溶液中哪些离子的物质的量一定有明显变化?
(4)不通入气体,改往W中加入过量铁粉,过滤,调节pH约为7,加入淀粉
 溶液和
溶液和 ,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是
,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是
您最近一年使用:0次
2019-08-19更新
|
337次组卷
|
6卷引用:湖北省武汉为明学校2020届高三7月月考化学试题
湖北省武汉为明学校2020届高三7月月考化学试题2016届浙江省嘉兴、杭州、宁波五校高三上第一次联考化学试卷2015-2016学年浙江宁波效实中学高二下期中化学试卷百所名校联考-化学物质及其变化(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)



