1 . 活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Cu等元素及少量不溶于水的杂质)制备ZnO,工艺流程图所示:
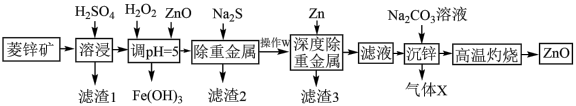
(1)写出Ni、Fe元素在周期表中的位置_______ ,常温下Fe2+比Fe3+更容易被氧化变质,请从结构角度加以解释_______ 。
(2)加入H2O2的目的是_______ ;“调pH”时除ZnO外还可以选用的物质是_______ 。
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了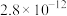 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为_______ 。证明Fe3+已除尽的化学方法是_______ 。
(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:_______ 。
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是_______。
(6)活性氧化锌纯度测定,已知:1.0mL1.0mol/LEDTA标准溶液相当于氧化锌质量为0.080克。取w克所得活性氧化锌样品配成含Zn2+的待测液,用c mol/LEDTA标准液进行滴定,消耗标准液VmL。计算产品中氧化锌纯度为_______ 。
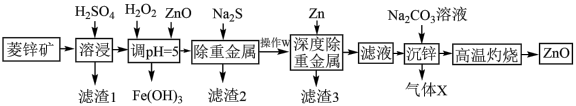
(1)写出Ni、Fe元素在周期表中的位置
(2)加入H2O2的目的是
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了
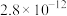 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是_______。
| A.粗锌作阳极,纯锌作阴极,电解质溶液是硫酸锌溶液 |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Al3+、Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu |
(6)活性氧化锌纯度测定,已知:1.0mL1.0mol/LEDTA标准溶液相当于氧化锌质量为0.080克。取w克所得活性氧化锌样品配成含Zn2+的待测液,用c mol/LEDTA标准液进行滴定,消耗标准液VmL。计算产品中氧化锌纯度为
您最近一年使用:0次
名校
解题方法
2 . 长期放置的FeSO4溶液易被氧化而变质,某兴趣小组进行了如下实验:
(1)设计实验检验FeSO4溶液的变质程度
①将方案补充完整
②若要使部分变质的FeSO4复原,方法是___________ 。(用离子反应方程式表示)
(2)利用部分变质 的FeSO4溶液制备Fe2O3。
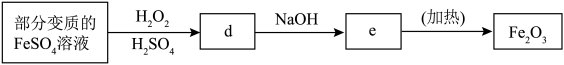
①填写下列各空:
d.___________ ;e.___________ 。
②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的浓度为___________ 。
(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?请说明理由___________ 。
(1)设计实验检验FeSO4溶液的变质程度
①将方案补充完整
| 实验方案 | 实验现象 | 实验结论 | |
| 步骤1 | 取待检测液于试管中,向其中滴加KSCN溶液 | ii | FeSO4溶液部分变质 |
| 步骤2 | i | iii | |
(2)利用

①填写下列各空:
d.
②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的浓度为
(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
| 实验方案 | 实验现象 |
| 取适量 Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 | 紫色褪去 |
您最近一年使用:0次
名校
3 . 高铁酸钾 是一种新型、高效、无毒的绿色环保水处理材料。
是一种新型、高效、无毒的绿色环保水处理材料。 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1) 的制备。
的制备。 的制备装置如图,回答下列问题。
的制备装置如图,回答下列问题。
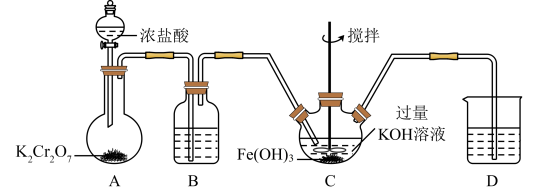
①A装置中盛放 的仪器为
的仪器为_____ (填仪器名称), 装置中反应的化学方程式为
装置中反应的化学方程式为_____ (提示:在酸性条件下, 常被还原为
常被还原为 )。
)。
②B装置中所盛试剂为_____ ;D装置的作用为_____ 。
③ 为制备
为制备 的主体装置,反应分两步进行,第一步为氯气与
的主体装置,反应分两步进行,第一步为氯气与 溶液的反应,第二步为第一步的产物之一氧化
溶液的反应,第二步为第一步的产物之一氧化 的过程。则第二步反应的离子方程式为
的过程。则第二步反应的离子方程式为_____ 。
(2)探究 的性质。取
的性质。取 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。为验证
。为验证 能否将
能否将 氧化从而产生
氧化从而产生 ,设计以下方案:
,设计以下方案:
①方案Ⅰ中溶液变红的原因为_____ (用离子方程式表示)。产生该现象_____ (填“能”或“不能”)判断一定是由 与
与 反应形成
反应形成 所致。如果不能,还可能因为
所致。如果不能,还可能因为_____ (填写离子方程式,如果上一空选“能”则本空不填)。
②方案Ⅱ得出氧化性:
_____  (填“>”或“<”)。
(填“>”或“<”)。
 是一种新型、高效、无毒的绿色环保水处理材料。
是一种新型、高效、无毒的绿色环保水处理材料。 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)
 的制备。
的制备。 的制备装置如图,回答下列问题。
的制备装置如图,回答下列问题。
①A装置中盛放
 的仪器为
的仪器为 装置中反应的化学方程式为
装置中反应的化学方程式为 常被还原为
常被还原为 )。
)。②B装置中所盛试剂为
③
 为制备
为制备 的主体装置,反应分两步进行,第一步为氯气与
的主体装置,反应分两步进行,第一步为氯气与 溶液的反应,第二步为第一步的产物之一氧化
溶液的反应,第二步为第一步的产物之一氧化 的过程。则第二步反应的离子方程式为
的过程。则第二步反应的离子方程式为(2)探究
 的性质。取
的性质。取 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。为验证
。为验证 能否将
能否将 氧化从而产生
氧化从而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量溶液 ,滴加 ,滴加 溶液至过量,溶液呈红色 溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用 溶液充分洗涤 溶液充分洗涤 中所得固体,再用 中所得固体,再用 溶液将 溶液将 溶出 溶出得到紫色溶液  。取少量 。取少量 ,滴加盐酸,有 ,滴加盐酸,有 产生 产生 |
 与
与 反应形成
反应形成 所致。如果不能,还可能因为
所致。如果不能,还可能因为②方案Ⅱ得出氧化性:

 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
4 . I.下表是某儿童在医院临床检验结果报告单的部分数据:
根据上表的数据,回答下列问题。
(1)该儿童___________ (填元素符号)元素含量偏低,如果以医学中惯用单位“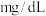 ”来表示,该元素的含量是
”来表示,该元素的含量是___________ 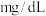 (结果保留两位小数。已知:
(结果保留两位小数。已知: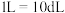 )。
)。
(2)硫酸亚铁颗粒是一种补铁剂,临床建议与维生素C同服,有利于Fe2+的吸收,原因是_____ 。
II.某实验小组欲测定某硫酸亚铁颗粒中铁元素的质量分数,实验过程如下:
①称取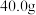 硫酸亚铁颗粒,溶于水配成
硫酸亚铁颗粒,溶于水配成 待测液;
待测液;
②配制 的酸性
的酸性 溶液;
溶液;
③取待测液 ,用酸性
,用酸性 溶液氧化(
溶液氧化( 被还原为
被还原为 )。该测定实验共进行了3次,消耗的酸性
)。该测定实验共进行了3次,消耗的酸性 溶液的体积平均为
溶液的体积平均为 。
。
(3)上述实验中常用于酸化 溶液的酸是
溶液的酸是___________ 。
(4)由 固体配制
固体配制 酸性
酸性 溶液,用到的实验仪器或用品有天平、药匙、烧杯、量筒、玻璃棒、滤纸、
溶液,用到的实验仪器或用品有天平、药匙、烧杯、量筒、玻璃棒、滤纸、___________ (填两种仪器的名称)。
(5)以下操作会导致所配溶液浓度偏低的有___________ 。
a.容量瓶洗净后未干燥,内有少量蒸馏水
b.未洗涤烧杯和玻璃棒
c.定容时俯视刻度线
d.定容摇匀后发现溶液体积低于刻度线,直接转移至试剂瓶中
(6)假设实验中杂质不参与反应且损耗不计,该硫酸亚铁颗粒中铁元素的质量分数为___________ (保留三位有效数字)。
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | 锌 | 115.92 |  |  |
| 2 | 铁 | 6.95 | 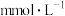 |  |
| 3 | 钙 | 1.78 | 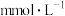 |  |
(1)该儿童
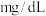 ”来表示,该元素的含量是
”来表示,该元素的含量是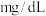 (结果保留两位小数。已知:
(结果保留两位小数。已知: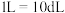 )。
)。(2)硫酸亚铁颗粒是一种补铁剂,临床建议与维生素C同服,有利于Fe2+的吸收,原因是
II.某实验小组欲测定某硫酸亚铁颗粒中铁元素的质量分数,实验过程如下:
①称取
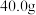 硫酸亚铁颗粒,溶于水配成
硫酸亚铁颗粒,溶于水配成 待测液;
待测液;②配制
 的酸性
的酸性 溶液;
溶液;③取待测液
 ,用酸性
,用酸性 溶液氧化(
溶液氧化( 被还原为
被还原为 )。该测定实验共进行了3次,消耗的酸性
)。该测定实验共进行了3次,消耗的酸性 溶液的体积平均为
溶液的体积平均为 。
。(3)上述实验中常用于酸化
 溶液的酸是
溶液的酸是(4)由
 固体配制
固体配制 酸性
酸性 溶液,用到的实验仪器或用品有天平、药匙、烧杯、量筒、玻璃棒、滤纸、
溶液,用到的实验仪器或用品有天平、药匙、烧杯、量筒、玻璃棒、滤纸、(5)以下操作会导致所配溶液浓度偏低的有
a.容量瓶洗净后未干燥,内有少量蒸馏水
b.未洗涤烧杯和玻璃棒
c.定容时俯视刻度线
d.定容摇匀后发现溶液体积低于刻度线,直接转移至试剂瓶中
(6)假设实验中杂质不参与反应且损耗不计,该硫酸亚铁颗粒中铁元素的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 某兴趣小组同学为探究黑木耳中含铁量,进行如下实验.
已知:i.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等.每100g黑木耳含铁量高达185mg.
ii. 与亚铁离子反应生成特征蓝色沉淀.
与亚铁离子反应生成特征蓝色沉淀.
Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下.

(1)步骤①中的黑木耳放在_________ 中加热
(2)步骤④检验 所用试剂是
所用试剂是_________ (填名称)溶液
(3)下列有关上述实验得出的结论是_________ (填字母)
a.黑木耳中一定含
b.白色沉淀中一定含
c.滤液A中一定含 和
和
Ⅱ.为测定黑木耳中铁元素的含量,乙同学设计实验方案如下
(4)可选做试剂B的物质是_________ (填字母)
a. b. Zn c. Fe d.Cu
b. Zn c. Fe d.Cu
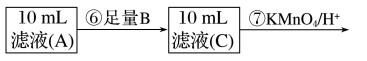
(5)步骤⑦中观察到的实验现象是_________ ,反应的离子方程式是__________________
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是__________________
已知:i.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等.每100g黑木耳含铁量高达185mg.
ii.
 与亚铁离子反应生成特征蓝色沉淀.
与亚铁离子反应生成特征蓝色沉淀.Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下.

(1)步骤①中的黑木耳放在
(2)步骤④检验
 所用试剂是
所用试剂是(3)下列有关上述实验得出的结论是
a.黑木耳中一定含

b.白色沉淀中一定含

c.滤液A中一定含
 和
和
Ⅱ.为测定黑木耳中铁元素的含量,乙同学设计实验方案如下
(4)可选做试剂B的物质是
a.
 b. Zn c. Fe d.Cu
b. Zn c. Fe d.Cu
(5)步骤⑦中观察到的实验现象是
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是
您最近一年使用:0次
名校
解题方法
6 .  是一种重要的化工产品,以黄铁矿烧渣(主要含
是一种重要的化工产品,以黄铁矿烧渣(主要含 、
、 、
、 等物质)为原料制备
等物质)为原料制备 的过程如下。
的过程如下。
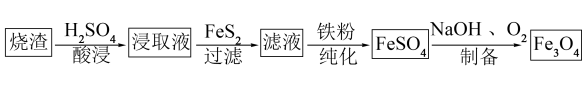
(1)酸浸、过滤
①酸浸过程 发生反应的离子方程式是
发生反应的离子方程式是___________ 。
②充分酸浸后浸取液中仍有 残留,加入
残留,加入 可进一步提高钙的脱除率,结合方程式解释原因
可进一步提高钙的脱除率,结合方程式解释原因___________ 。
(2)纯化
①Fe粉的作用是___________ 。
②检验纯化是否完全还原,应向滤液中加入___________ 。
a. 溶液 b.
溶液 b. 溶液 c.KSCN溶液
溶液 c.KSCN溶液
(3)制备
将NaOH溶液与 溶液(稍过量)按一定比例混合,产生白色沉淀,继而转变为墨绿色,最后变为黑色。溶液混合的同时通入空气并记录pH的变化,如图所示。
溶液(稍过量)按一定比例混合,产生白色沉淀,继而转变为墨绿色,最后变为黑色。溶液混合的同时通入空气并记录pH的变化,如图所示。
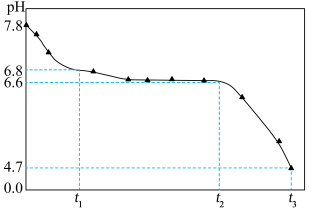
已知:
ⅰ.pH≈7.8时,浊液中主要存在 、
、 和少量
和少量
ⅱ.墨绿色物质主要成分为 制备过程可能发生了如下历程:
制备过程可能发生了如下历程:

①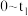 时段,pH明显降低。结合离子方程式解释原因:
时段,pH明显降低。结合离子方程式解释原因:___________ 。
② 时段,墨绿色物质的生成与转化(生成
时段,墨绿色物质的生成与转化(生成 )同时进行。
)同时进行。
a.生成墨绿色物质的方程式是:___________ 。
b.墨绿色物质转化为 的方程式是:
的方程式是:___________ 。
③ 时段,pH继续降低的原因是:
时段,pH继续降低的原因是:___________ 。
 是一种重要的化工产品,以黄铁矿烧渣(主要含
是一种重要的化工产品,以黄铁矿烧渣(主要含 、
、 、
、 等物质)为原料制备
等物质)为原料制备 的过程如下。
的过程如下。
(1)酸浸、过滤
①酸浸过程
 发生反应的离子方程式是
发生反应的离子方程式是②充分酸浸后浸取液中仍有
 残留,加入
残留,加入 可进一步提高钙的脱除率,结合方程式解释原因
可进一步提高钙的脱除率,结合方程式解释原因(2)纯化
①Fe粉的作用是
②检验纯化是否完全还原,应向滤液中加入
a.
 溶液 b.
溶液 b. 溶液 c.KSCN溶液
溶液 c.KSCN溶液(3)制备
将NaOH溶液与
 溶液(稍过量)按一定比例混合,产生白色沉淀,继而转变为墨绿色,最后变为黑色。溶液混合的同时通入空气并记录pH的变化,如图所示。
溶液(稍过量)按一定比例混合,产生白色沉淀,继而转变为墨绿色,最后变为黑色。溶液混合的同时通入空气并记录pH的变化,如图所示。
已知:
ⅰ.pH≈7.8时,浊液中主要存在
 、
、 和少量
和少量
ⅱ.墨绿色物质主要成分为
 制备过程可能发生了如下历程:
制备过程可能发生了如下历程:
①
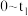 时段,pH明显降低。结合离子方程式解释原因:
时段,pH明显降低。结合离子方程式解释原因:②
 时段,墨绿色物质的生成与转化(生成
时段,墨绿色物质的生成与转化(生成 )同时进行。
)同时进行。a.生成墨绿色物质的方程式是:
b.墨绿色物质转化为
 的方程式是:
的方程式是:③
 时段,pH继续降低的原因是:
时段,pH继续降低的原因是:
您最近一年使用:0次
名校
解题方法
7 . 某实验小组拟探究铁的化合物(FeS2O6)的分解产物,设计如下实验。已知几种物质的物理性质如表所示。
实验装置如图所示(加热和夹持装置省略)。
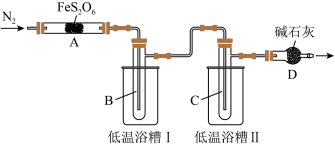
回答下列问题:
(1)点燃酒精灯之前,通入一段时间N2,其目的是________ 。
(2)低温浴槽II控制的温度范围为________ 。
(3)甲、乙、丙三组分别进行实验,测得相关实验数据如表(不考虑损失且不考虑生成O2,FeS2O6在该温度下完全反应):
①根据实验数据分析,甲组实验中A装置得到的纯净固体产物是_______ (填化学式)。
②经检测,乙组实验的固体产物为纯净物,写出A中发生的化学反应方程式:_______ 。
(4)为了进一步分析丙组实验得到的固体纯净物成分,他们取少量固体溶于稀硫酸中,将溶液分成两份,进行如表实验(不考虑O2的存在):
根据实验推知,丙组实验中FeS2O6分解生成的固体产物、SO3、SO2的物质的量之比为_______ 。
(5)为了进一步探究气体产物成分,将D仪器导出的气体通入酸化的KI-淀粉溶液中,一段时间后,若_______  填实验现象
填实验现象 ,则说明有O2生成。
,则说明有O2生成。
(6)将I中产物1100g溶于900g98%的浓硫酸所得产物为_______ ,其质量分数为_______ 。
| 物质 | SO3 | SO2 | O2 |
| 熔点/℃ | 16.8 | -75.5 | -218.4 |
| 沸点/℃ | 44.8 | -10 | -182.9 |

回答下列问题:
(1)点燃酒精灯之前,通入一段时间N2,其目的是
(2)低温浴槽II控制的温度范围为
(3)甲、乙、丙三组分别进行实验,测得相关实验数据如表(不考虑损失且不考虑生成O2,FeS2O6在该温度下完全反应):
| A处温度/℃ | FeS2O6质量/g | 低温浴槽I净增质量/g | 低温浴槽II净增质量/g | |
| 甲 | T1 | 2.16 | 0 | 0.64 |
| 乙 | T2 | 4.32 | 0.80 | 1.92 |
| 丙 | T3 | 6.48 | 1.60 | 2.56 |
②经检测,乙组实验的固体产物为纯净物,写出A中发生的化学反应方程式:
(4)为了进一步分析丙组实验得到的固体纯净物成分,他们取少量固体溶于稀硫酸中,将溶液分成两份,进行如表实验(不考虑O2的存在):
| 实验 | 操作 | 现象 |
| a | 在一份溶液中滴加K3[Fe(CN)6]溶液 | 产生蓝色沉淀 |
| b | 在另一份溶液中滴加NH4SCN溶液 | 溶液变红色 |
(5)为了进一步探究气体产物成分,将D仪器导出的气体通入酸化的KI-淀粉溶液中,一段时间后,若
 填实验现象
填实验现象 ,则说明有O2生成。
,则说明有O2生成。(6)将I中产物1100g溶于900g98%的浓硫酸所得产物为
您最近一年使用:0次
8 . 某无色透明溶液中可能大量存在 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种,为确定溶液中的离子组成,进行了如下实验:
中的几种,为确定溶液中的离子组成,进行了如下实验:
①用玻璃棒蘸取溶液滴在pH试纸上,待试纸变色后与标准比色卡比对,溶液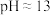 ;
;
②取少量溶液于试管中,向其中加入足量的 溶液,生成白色沉淀,过滤,向白色固体中滴加足量盐酸,沉淀部分溶解并有气泡冒出;
溶液,生成白色沉淀,过滤,向白色固体中滴加足量盐酸,沉淀部分溶解并有气泡冒出;
③将实验②所得悬浊液过滤,向滤液中滴加 溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
已知常温下 饱和溶液的
饱和溶液的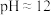 ;
; 微溶于水,易溶于
微溶于水,易溶于 溶液。
溶液。
回答下列问题:
(1)不进行实验,通过观察就可以确定原溶液中不存在的离子是___________ (填离子符号,下同)。
(2)由实验①进一步可推知原溶液中一定不存在的离子是___________ 。
(3)实验②中白色沉淀的成分是___________ (填化学式);白色沉淀部分溶解,发生反应的离子方程式为___________ ;由实验②可确定原溶液中一定不存在的离子符号是___________ 。
(4)根据上述实验现象可知,原溶液中,一定存在的离子是___________ ,不能确定是否存在的离子是___________ ;确定该离子是否存在的实验为:取少量样本溶液于试管中,先加入稀硝酸酸化后,再加入 溶液至沉淀完全,过滤,
溶液至沉淀完全,过滤,___________ ,有白色沉淀生成,再次加入稀硝酸,观察沉淀是否溶解。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种,为确定溶液中的离子组成,进行了如下实验:
中的几种,为确定溶液中的离子组成,进行了如下实验:①用玻璃棒蘸取溶液滴在pH试纸上,待试纸变色后与标准比色卡比对,溶液
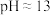 ;
;②取少量溶液于试管中,向其中加入足量的
 溶液,生成白色沉淀,过滤,向白色固体中滴加足量盐酸,沉淀部分溶解并有气泡冒出;
溶液,生成白色沉淀,过滤,向白色固体中滴加足量盐酸,沉淀部分溶解并有气泡冒出;③将实验②所得悬浊液过滤,向滤液中滴加
 溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。已知常温下
 饱和溶液的
饱和溶液的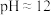 ;
; 微溶于水,易溶于
微溶于水,易溶于 溶液。
溶液。回答下列问题:
(1)不进行实验,通过观察就可以确定原溶液中不存在的离子是
(2)由实验①进一步可推知原溶液中一定不存在的离子是
(3)实验②中白色沉淀的成分是
(4)根据上述实验现象可知,原溶液中,一定存在的离子是
 溶液至沉淀完全,过滤,
溶液至沉淀完全,过滤,
您最近一年使用:0次
2023-11-16更新
|
200次组卷
|
3卷引用:湖北省宜昌市协作体2023-2024学年高一上学期期中考试化学试题
9 . 某项目式学习小组设计如表所示实验,探究饱和AgNO3溶液对新制氯水的漂白性的影响,褪色时间的差异引起该小组的讨论。
查阅资料:Ksp(AgCl)<Ksp(AgClO)。回答下列问题:
(1)Cl2和H2O反应的离子方程式为________ 。
(2)甲同学认为X为AgCl,乙同学认为甲是错误的,乙的证据是_______ 。
(3)丙同学认为X为AgClO,丁同学认为丙是错误的,丁的证据是_______ 。
(4)为了验证X除AgCl外还含有AgClO,该小组取过滤、洗涤后的X分别装入3支洁净的试管中,进行如表所示的实验:
(5)取新制氯水与足量饱和AgNO3溶液反应后得到的固体,用蒸馏水洗涤3次,干燥后称取8.93g装入一洁净试管,测得总质量为16.43g,用酒精灯加热,待氧气释放完全并恢复至室温,测得试管总质量为16.11g,则白色固体中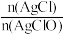 =
=_______ 。
| 实验步骤 | 试剂A | 现象 |
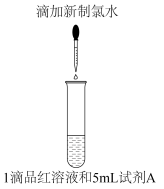 | 蒸馏水 | 8s后品红溶液褪色 |
| 饱和AgNO3溶液 | 生成白色沉淀(X),10min后品红溶液褪色 |
(1)Cl2和H2O反应的离子方程式为
(2)甲同学认为X为AgCl,乙同学认为甲是错误的,乙的证据是
(3)丙同学认为X为AgClO,丁同学认为丙是错误的,丁的证据是
(4)为了验证X除AgCl外还含有AgClO,该小组取过滤、洗涤后的X分别装入3支洁净的试管中,进行如表所示的实验:
| 实验序号 | 加入试剂及操作 | 实验现象 | 解释 |
| ① | 加入2mL浓盐酸,用湿润的淀粉KI试纸靠近试管口 | 产生黄绿色气体,淀粉KI试纸变蓝 | 产生气体的化学方程式为 |
| ② | 加入2mL(NH4)2Fe(SO4)2溶液,再滴加3滴 | 溶液出现红色 | |
| ③ | 加入饱和NaCl溶液,静置1小时,取上层清液,滴加1滴品红溶液 | 品红溶液褪色 |
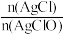 =
=
您最近一年使用:0次
2023-09-14更新
|
232次组卷
|
2卷引用:湖北省高中名校联盟2024届高三第一次联合测评化学试题
10 . 三氧化二锑( )被称为锑白,不溶于水,溶于强酸和强碱,是应用最早的阻燃剂。一种以辉锑矿(主要成分为
)被称为锑白,不溶于水,溶于强酸和强碱,是应用最早的阻燃剂。一种以辉锑矿(主要成分为 ,还含有
,还含有 、
、 、
、 、
、 等)为原料制取锑白的工艺流程图如下:
等)为原料制取锑白的工艺流程图如下:

已知:锑的原子序数为51,与氮同主族。
回答下列问题:
(1)锑在周期表中的位置为第________ 周期______ 族。
(2)“溶浸”中, 转化为
转化为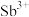 进入溶液,“浸取渣”的主要成分有硫单质和
进入溶液,“浸取渣”的主要成分有硫单质和___________ 。 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(3)若缺少“还原”,锑白会因含有杂质而显浅黄色。“还原”中被还原的元素是___________ 。
(4)“水解”时, 与热水反应的化学方程式为
与热水反应的化学方程式为___________ 。
(5)“中和”时,选用氨水而不选用 溶液的原因是
溶液的原因是___________ 。
 )被称为锑白,不溶于水,溶于强酸和强碱,是应用最早的阻燃剂。一种以辉锑矿(主要成分为
)被称为锑白,不溶于水,溶于强酸和强碱,是应用最早的阻燃剂。一种以辉锑矿(主要成分为 ,还含有
,还含有 、
、 、
、 、
、 等)为原料制取锑白的工艺流程图如下:
等)为原料制取锑白的工艺流程图如下:
已知:锑的原子序数为51,与氮同主族。
回答下列问题:
(1)锑在周期表中的位置为第
(2)“溶浸”中,
 转化为
转化为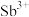 进入溶液,“浸取渣”的主要成分有硫单质和
进入溶液,“浸取渣”的主要成分有硫单质和 发生反应的离子方程式为
发生反应的离子方程式为(3)若缺少“还原”,锑白会因含有杂质而显浅黄色。“还原”中被还原的元素是
(4)“水解”时,
 与热水反应的化学方程式为
与热水反应的化学方程式为(5)“中和”时,选用氨水而不选用
 溶液的原因是
溶液的原因是
您最近一年使用:0次
2023-07-06更新
|
145次组卷
|
2卷引用:湖北省黄石市第二中学2023-2024学年高二上学期9月月考化学试题



