解题方法
1 . 工业上氯化铁的用途很多,生产氯化铁也有多种方法、如氯化法、熔融法、复分解法等。其中氯化法以废铁屑和氯气为原料,在一立式反应炉里反应,得到的氯化铁蒸气和尾气[用氯化亚铁溶液吸收可制得副产品(氯氧化铁溶液)]由炉顶排出,氯化铁蒸汽进入捕集器中冷凝为固体结晶,即是成品。某同学设计的氧化法制备氯化铁的装置如图。
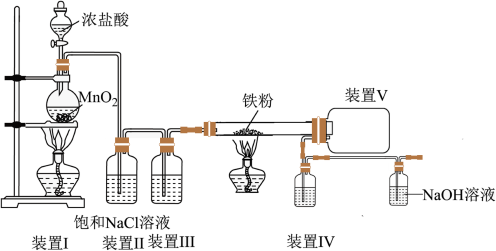
查阅资料:
① 易溶于水并且有强吸水性,吸收空气里的水分,易潮解;
易溶于水并且有强吸水性,吸收空气里的水分,易潮解;
②直接将 溶液加热蒸干,得到的固体是
溶液加热蒸干,得到的固体是 而不是
而不是 晶体;
晶体;
③ 中的硫元素为-2价。请回答下列问题:
中的硫元素为-2价。请回答下列问题:
(1)实验前,需进行的操作是_______ 。
(2)装置III中盛放的试剂是_______ (填名称),装置IV的作用是_______ 。
(3)盛放 溶液的装置的作用是
溶液的装置的作用是_______ 。
(4)实验结束后取装置V中的少量固体加水溶解,向其中滴加 溶液,观察到
溶液,观察到_______ ,即可证明产物为 。用
。用 溶液和氯水可以检验
溶液和氯水可以检验 ,滴加过量氯水出现溶液先变红色后又迅速褪色的现象,甲同学猜测其原因,可能是溶液中的
,滴加过量氯水出现溶液先变红色后又迅速褪色的现象,甲同学猜测其原因,可能是溶液中的 与过量氯水发生了化学反应。
与过量氯水发生了化学反应。
a.甲同学猜测的依据是_______ 。
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是_______ 。
(5)氯化法制氯化铁时,得到副产品。若向某 溶液中通入足量
溶液中通入足量 ,充分反应后将所得溶液直接蒸干,并将所得固体灼烧至质量不再变化,则灼烧后残留固体的质量为
,充分反应后将所得溶液直接蒸干,并将所得固体灼烧至质量不再变化,则灼烧后残留固体的质量为_______ g。

查阅资料:
①
 易溶于水并且有强吸水性,吸收空气里的水分,易潮解;
易溶于水并且有强吸水性,吸收空气里的水分,易潮解;②直接将
 溶液加热蒸干,得到的固体是
溶液加热蒸干,得到的固体是 而不是
而不是 晶体;
晶体;③
 中的硫元素为-2价。请回答下列问题:
中的硫元素为-2价。请回答下列问题:(1)实验前,需进行的操作是
(2)装置III中盛放的试剂是
(3)盛放
 溶液的装置的作用是
溶液的装置的作用是(4)实验结束后取装置V中的少量固体加水溶解,向其中滴加
 溶液,观察到
溶液,观察到 。用
。用 溶液和氯水可以检验
溶液和氯水可以检验 ,滴加过量氯水出现溶液先变红色后又迅速褪色的现象,甲同学猜测其原因,可能是溶液中的
,滴加过量氯水出现溶液先变红色后又迅速褪色的现象,甲同学猜测其原因,可能是溶液中的 与过量氯水发生了化学反应。
与过量氯水发生了化学反应。a.甲同学猜测的依据是
b.乙同学通过实验证实了甲同学的猜测,其实验方案及现象是
(5)氯化法制氯化铁时,得到副产品。若向某
 溶液中通入足量
溶液中通入足量 ,充分反应后将所得溶液直接蒸干,并将所得固体灼烧至质量不再变化,则灼烧后残留固体的质量为
,充分反应后将所得溶液直接蒸干,并将所得固体灼烧至质量不再变化,则灼烧后残留固体的质量为
您最近一年使用:0次
名校
解题方法
2 . 四氯化锡(SnCl4)是合成有机锡化合物的原料,制备SnCl4的装置如图所示。
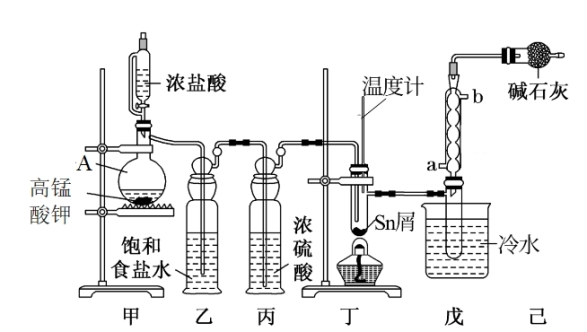
有关信息如表:
(1)仪器A的名称为___________ ,甲中发生反应的离子方程式为___________ 。
(2)如缺少装置丙,丁处主要副反应的化学方程式为___________ 。
(3)加热丁装置,锡熔化,与Cl2反应,产物有SnCl4和SnCl2,为了确认丁中生成的SnCl2,可选用以下试剂___________ (填序号)检验。
A.稀盐酸 B.酸性高锰酸钾 C.加入有KSCN的FeCl3溶液
(4)丁中反应需要通入过量的Cl2,并控制温度在232~652℃范围,控制温度目的是___________ 。
(5)可以通过___________ 现象判断丁中的反应已经完成。若制得的SnCl4显黄色,可能的原因是___________ 。
(6)利用沉淀滴定法测定产品中Sn2+的含量,方案如下:准确称取mg产品于锥形瓶中,用蒸馏水溶解,X溶液作指示剂,用bmol/L的硝酸银标准溶液滴定,滴定终点时消耗硝酸银溶液V1mL,由此可计算产品中Sn2+的质量分数。
①参考表中的数据,X溶液最好选用的是___________ (填序号)。
A.NaCl溶液 B.NaBr溶液 C.NaCN溶液 D.Na2CrO4溶液
②乙同学认为甲同学测得的Sn2+含量可能会偏高,理由___________ 。

有关信息如表:
| 化学式 | Sn | SnCl2 | SnCl4 |
| 熔点/℃ | 232 | 246 | -33 |
| 沸点/℃ | 2260 | 652 | 114 |
| 其他性质 | 银白色固体金属 | 无色晶体,Sn2+易被Fe3+、I2等氧化为Sn4+ | 无色液体,易水解生成SnO2·xH2O |
(2)如缺少装置丙,丁处主要副反应的化学方程式为
(3)加热丁装置,锡熔化,与Cl2反应,产物有SnCl4和SnCl2,为了确认丁中生成的SnCl2,可选用以下试剂
A.稀盐酸 B.酸性高锰酸钾 C.加入有KSCN的FeCl3溶液
(4)丁中反应需要通入过量的Cl2,并控制温度在232~652℃范围,控制温度目的是
(5)可以通过
(6)利用沉淀滴定法测定产品中Sn2+的含量,方案如下:准确称取mg产品于锥形瓶中,用蒸馏水溶解,X溶液作指示剂,用bmol/L的硝酸银标准溶液滴定,滴定终点时消耗硝酸银溶液V1mL,由此可计算产品中Sn2+的质量分数。
①参考表中的数据,X溶液最好选用的是
A.NaCl溶液 B.NaBr溶液 C.NaCN溶液 D.Na2CrO4溶液
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 |
| 颜色 | 白 | 浅黄 | 白 | 砖红 |
| Ksp | 1.77×10-10 | 5.4×10-14 | 2.7×10-16 | 1.12×10-12 |
您最近一年使用:0次
名校
3 . 据古籍记载,焙烧绿矾( )矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。
)矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。

回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加 溶液,无明显现象。再向试管中加入适量
溶液,无明显现象。再向试管中加入适量___________ (填写试剂名称),振荡,溶液变为红色。由此可知该样品___________ (填“已”或“未”)变质。
(2)写出绿矾充分焙烧的过程中只生成一种酸性气体的化学方程式___________ 。
(3)装置 中冷水的作用是
中冷水的作用是___________ 。
(4)为防止倒吸,停止实验时应进行的操作是___________ 。
(5)用 滴定法测定绿矾的纯度。称取
滴定法测定绿矾的纯度。称取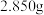 绿矾样品,配制成
绿矾样品,配制成 溶液,量取
溶液,量取 待测液于锥形瓶中,用
待测液于锥形瓶中,用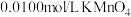 酸性溶液滴定,反应消耗
酸性溶液滴定,反应消耗 酸性溶液体积的平均值为
酸性溶液体积的平均值为 。
。
①配制绿矾样品溶液时需要用到的玻璃仪器是:烧杯、玻璃棒、量筒、___________ 。
②该实验滴定终点时溶液的颜色变为___________ 。
③该绿矾样品中 的质量分数为
的质量分数为___________ (计算结果保留3位有效数字)。
 )矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。
)矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。
回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加
 溶液,无明显现象。再向试管中加入适量
溶液,无明显现象。再向试管中加入适量(2)写出绿矾充分焙烧的过程中只生成一种酸性气体的化学方程式
(3)装置
 中冷水的作用是
中冷水的作用是(4)为防止倒吸,停止实验时应进行的操作是
(5)用
 滴定法测定绿矾的纯度。称取
滴定法测定绿矾的纯度。称取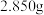 绿矾样品,配制成
绿矾样品,配制成 溶液,量取
溶液,量取 待测液于锥形瓶中,用
待测液于锥形瓶中,用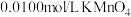 酸性溶液滴定,反应消耗
酸性溶液滴定,反应消耗 酸性溶液体积的平均值为
酸性溶液体积的平均值为 。
。①配制绿矾样品溶液时需要用到的玻璃仪器是:烧杯、玻璃棒、量筒、
②该实验滴定终点时溶液的颜色变为
③该绿矾样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2021-04-24更新
|
548次组卷
|
5卷引用:湖北省武汉市2020-2021学年高三下学期4月质量检测化学试题
4 . 硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。
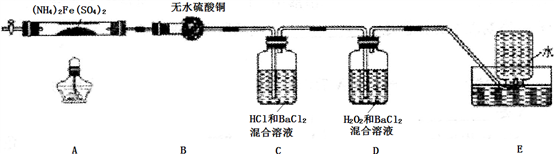
(1)B装置的作用是___________________ 。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有_______ 气体产生,写出D中发生反应的离子方程式_______ 。若去掉C,是否能得出同样结论并解释其原因______________ 。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
(4)若E中收集到的气体只有N2,其物质的量为x mol,固体残留物Fe2O3,的物质的量为y mol,D中沉淀物质的量为z mol,根据氧化还原反应的基本规律,x、y和z应满足的关系为______________ 。
(5)结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式__________________ 。
(6)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用硫酸铁铵[NH4Fe(SO4)2]标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化学方程式为_______________ 。
②滴定终点的现象是_______________ 。
③滴定分析时,称取TiO2试样0.2 g,消耗0.1 mol·L-1NH4Fe(SO4)2标准溶液20mL,则TiO2的质量分数为_______________ 。
④若在滴定终点读取滴定管刻度时,俯视标准溶液的液面,使其测定结果_______ (填“偏大”“偏小”或“无影响”)。

(1)B装置的作用是
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解; | 固体残留物仅为Fe2O3 |
(5)结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式
(6)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用硫酸铁铵[NH4Fe(SO4)2]标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化学方程式为
②滴定终点的现象是
③滴定分析时,称取TiO2试样0.2 g,消耗0.1 mol·L-1NH4Fe(SO4)2标准溶液20mL,则TiO2的质量分数为
④若在滴定终点读取滴定管刻度时,俯视标准溶液的液面,使其测定结果
您最近一年使用:0次
11-12高三上·北京海淀·期中
5 . 为证明Fe3+具有较强的氧化性,
甲同学做了如下实验:将Cu片放入Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。
已知:
请回答:
(1)稀硝酸和Cu反应的化学方程式为 。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、稀硝酸
方案:
。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
①根据实验现象写出发生反应的离子方程式: 。
②导致实验过程中溶液pH略有上升的可能原因是
。
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:
。
甲同学做了如下实验:将Cu片放入Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。
已知:
| 水解反应 | 平衡常数(K) |
Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ | 7.9 × 10-4 |
Fe2+ + 2H2O  Fe(OH)2 + 2H+ Fe(OH)2 + 2H+ | 3.2 × 10-10 |
Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+ | 3.2 × 10-7 |
(1)稀硝酸和Cu反应的化学方程式为 。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、稀硝酸
方案:
。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化。 |
②导致实验过程中溶液pH略有上升的可能原因是
。
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:
。
您最近一年使用:0次
名校
解题方法
6 . 长期放置的FeSO4溶液易被氧化而变质,某兴趣小组进行了如下实验:
(1)设计实验检验FeSO4溶液的变质程度
①将方案补充完整
②若要使部分变质的FeSO4复原,方法是___________ 。(用离子反应方程式表示)
(2)利用部分变质 的FeSO4溶液制备Fe2O3。
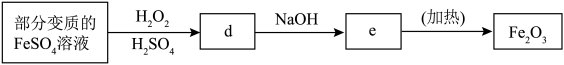
①填写下列各空:
d.___________ ;e.___________ 。
②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的浓度为___________ 。
(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?请说明理由___________ 。
(1)设计实验检验FeSO4溶液的变质程度
①将方案补充完整
| 实验方案 | 实验现象 | 实验结论 | |
| 步骤1 | 取待检测液于试管中,向其中滴加KSCN溶液 | ii | FeSO4溶液部分变质 |
| 步骤2 | i | iii | |
(2)利用

①填写下列各空:
d.
②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的浓度为
(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
| 实验方案 | 实验现象 |
| 取适量 Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 | 紫色褪去 |
您最近一年使用:0次
名校
解题方法
7 . 某实验小组拟探究铁的化合物(FeS2O6)的分解产物,设计如下实验。已知几种物质的物理性质如表所示。
实验装置如图所示(加热和夹持装置省略)。
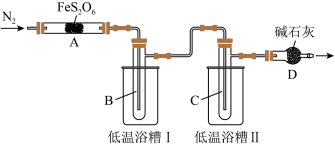
回答下列问题:
(1)点燃酒精灯之前,通入一段时间N2,其目的是________ 。
(2)低温浴槽II控制的温度范围为________ 。
(3)甲、乙、丙三组分别进行实验,测得相关实验数据如表(不考虑损失且不考虑生成O2,FeS2O6在该温度下完全反应):
①根据实验数据分析,甲组实验中A装置得到的纯净固体产物是_______ (填化学式)。
②经检测,乙组实验的固体产物为纯净物,写出A中发生的化学反应方程式:_______ 。
(4)为了进一步分析丙组实验得到的固体纯净物成分,他们取少量固体溶于稀硫酸中,将溶液分成两份,进行如表实验(不考虑O2的存在):
根据实验推知,丙组实验中FeS2O6分解生成的固体产物、SO3、SO2的物质的量之比为_______ 。
(5)为了进一步探究气体产物成分,将D仪器导出的气体通入酸化的KI-淀粉溶液中,一段时间后,若_______  填实验现象
填实验现象 ,则说明有O2生成。
,则说明有O2生成。
(6)将I中产物1100g溶于900g98%的浓硫酸所得产物为_______ ,其质量分数为_______ 。
| 物质 | SO3 | SO2 | O2 |
| 熔点/℃ | 16.8 | -75.5 | -218.4 |
| 沸点/℃ | 44.8 | -10 | -182.9 |

回答下列问题:
(1)点燃酒精灯之前,通入一段时间N2,其目的是
(2)低温浴槽II控制的温度范围为
(3)甲、乙、丙三组分别进行实验,测得相关实验数据如表(不考虑损失且不考虑生成O2,FeS2O6在该温度下完全反应):
| A处温度/℃ | FeS2O6质量/g | 低温浴槽I净增质量/g | 低温浴槽II净增质量/g | |
| 甲 | T1 | 2.16 | 0 | 0.64 |
| 乙 | T2 | 4.32 | 0.80 | 1.92 |
| 丙 | T3 | 6.48 | 1.60 | 2.56 |
②经检测,乙组实验的固体产物为纯净物,写出A中发生的化学反应方程式:
(4)为了进一步分析丙组实验得到的固体纯净物成分,他们取少量固体溶于稀硫酸中,将溶液分成两份,进行如表实验(不考虑O2的存在):
| 实验 | 操作 | 现象 |
| a | 在一份溶液中滴加K3[Fe(CN)6]溶液 | 产生蓝色沉淀 |
| b | 在另一份溶液中滴加NH4SCN溶液 | 溶液变红色 |
(5)为了进一步探究气体产物成分,将D仪器导出的气体通入酸化的KI-淀粉溶液中,一段时间后,若
 填实验现象
填实验现象 ,则说明有O2生成。
,则说明有O2生成。(6)将I中产物1100g溶于900g98%的浓硫酸所得产物为
您最近一年使用:0次
8 . 碳酸亚铁(FeCO3),白色固体,是菱铁矿的主要成分。难溶干水。在潮湿的空气中易被氧化,是一种重要的工业原料,常用于制备铁盐和补血剂等。如图是一种实验室制备FeCO3的流程:
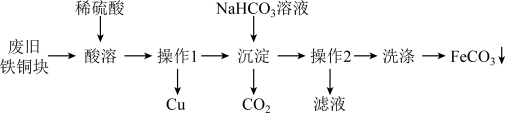
回答下列问题:
(1)废旧的铁钢表面有油行,可以用_____ (填试剂名称)溶液洗净,“酸溶时,为了加快酸溶”速率常采取的措施有____________ (写出两种)。
(2)“操作I"是____________ 。
(3)写出流程中“沉淀”时反应的离子方程式:________________ 。
(4)写出流程中“洗涤”的具体操作:_____________ 。
(5)碳酸亚铁固体在潮湿的空气中放置一段时间后呈茶色,其原因为(用化学方程式表示)__________ 。有同学认为固体呈茶色可能是含有Fe3+所致,实验室可以选用种试剂检验该离子,这种试剂是______ (填化学式)溶液。滴加这种试剂会出现__________ 现象(填实验现象)。

回答下列问题:
(1)废旧的铁钢表面有油行,可以用
(2)“操作I"是
(3)写出流程中“沉淀”时反应的离子方程式:
(4)写出流程中“洗涤”的具体操作:
(5)碳酸亚铁固体在潮湿的空气中放置一段时间后呈茶色,其原因为(用化学方程式表示)
您最近一年使用:0次
解题方法
9 . 废旧锌锰电池中的黑锰粉含有 、
、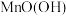 、
、 和少量
和少量 、
、 及炭黑等,为了保护环境、充分利用锰资源,通过下图流程制备
及炭黑等,为了保护环境、充分利用锰资源,通过下图流程制备 。
。
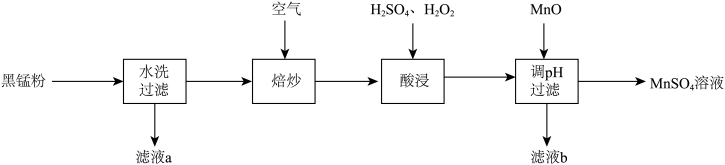
回答下列问题:
(1)基态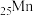 原子的简化电子排布式为
原子的简化电子排布式为_______ 。
(2)“滤液a”的主要成分为 ,另外还含有少量
,另外还含有少量 等。
等。
①用离子方程式表示“滤液a”呈酸性的原因:_______ 。
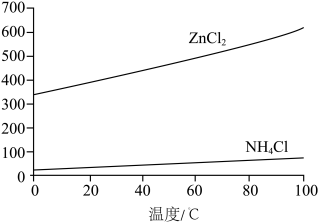
②根据下图所示的溶解度曲线,将“滤液a”蒸发结晶、_______ 、洗涤、干燥,得 固体。
固体。
(3)“焙炒”的目的是除炭、氧化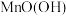 等。空气中
等。空气中 氧化
氧化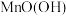 的化学方程式为
的化学方程式为____ 。
(4)探究“酸浸”中 溶解的适宜操作。
溶解的适宜操作。
实验I.向 中加入
中加入 溶液,产生大量气泡;再加入稀
溶液,产生大量气泡;再加入稀 ,固体未明显溶解。
,固体未明显溶解。
实验II.向 中加入稀
中加入稀 ,固体未溶解;再加入
,固体未溶解;再加入 溶液,产生大量气泡,固体完全溶解。
溶液,产生大量气泡,固体完全溶解。
①实验I中 的作用是
的作用是_______ ,实验II中 的作用是
的作用是_______ 。
②由实验可知,“酸浸”溶解 时加入试剂的顺序是
时加入试剂的顺序是_______ 。
(5)证明 溶液中
溶液中 沉淀完全:取少量溶液,滴加
沉淀完全:取少量溶液,滴加_______ (填试剂),观察到_______ (填现象)。
 、
、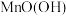 、
、 和少量
和少量 、
、 及炭黑等,为了保护环境、充分利用锰资源,通过下图流程制备
及炭黑等,为了保护环境、充分利用锰资源,通过下图流程制备 。
。
回答下列问题:
(1)基态
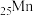 原子的简化电子排布式为
原子的简化电子排布式为(2)“滤液a”的主要成分为
 ,另外还含有少量
,另外还含有少量 等。
等。①用离子方程式表示“滤液a”呈酸性的原因:
②根据下图所示的溶解度曲线,将“滤液a”蒸发结晶、
 固体。
固体。
(3)“焙炒”的目的是除炭、氧化
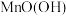 等。空气中
等。空气中 氧化
氧化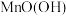 的化学方程式为
的化学方程式为(4)探究“酸浸”中
 溶解的适宜操作。
溶解的适宜操作。实验I.向
 中加入
中加入 溶液,产生大量气泡;再加入稀
溶液,产生大量气泡;再加入稀 ,固体未明显溶解。
,固体未明显溶解。实验II.向
 中加入稀
中加入稀 ,固体未溶解;再加入
,固体未溶解;再加入 溶液,产生大量气泡,固体完全溶解。
溶液,产生大量气泡,固体完全溶解。①实验I中
 的作用是
的作用是 的作用是
的作用是②由实验可知,“酸浸”溶解
 时加入试剂的顺序是
时加入试剂的顺序是(5)证明
 溶液中
溶液中 沉淀完全:取少量溶液,滴加
沉淀完全:取少量溶液,滴加
您最近一年使用:0次
解题方法
10 .  化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究
化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究 与
与 的反应机理,实验步骤如下:
的反应机理,实验步骤如下:
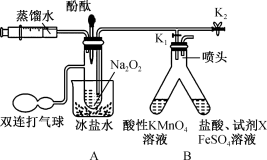
i.打开 、
、 ,通过注射器注入适量蒸馏水,使固体全部溶解;
,通过注射器注入适量蒸馏水,使固体全部溶解;
ii.将部分液体转移至B中;
iii.向A中剩余的溶液中滴加几滴酚酞试液。
回答下列问题:
(1)“步骤ii”B中左侧溶液褪色且有气泡产生,右侧溶液变为红色。
①将部分液体转移至B中的具体操作为_______ 。
②试剂X是_______ (填化学式)溶液,右侧与“溶液变红”有关反应的离子方程式为_______ 、 。
。
③左侧 参与反应的离子方程式为
参与反应的离子方程式为_______ ;②、③涉及的氧化还原反应中,若消耗等物质的量的还原剂,则理论上消耗氧化剂的物质的量之比为_______ 。
(2)若向“步骤iii”A中剩余的溶液中加入 时,有大量气泡产生。
时,有大量气泡产生。
① 在该反应中的作用为
在该反应中的作用为_______ 。
②“步骤iii”的现象为_______ , 与
与 反应的机理是
反应的机理是_______ (用化学方程式表示,第一步)。
(3)向包裹着适量 的脱脂棉(放在石棉网上)上滴加3~4滴水,结果脱脂棉剧烈燃烧。由此可得出与该反应相关的结论是
的脱脂棉(放在石棉网上)上滴加3~4滴水,结果脱脂棉剧烈燃烧。由此可得出与该反应相关的结论是_______ 。
 化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究
化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究 与
与 的反应机理,实验步骤如下:
的反应机理,实验步骤如下:
i.打开
 、
、 ,通过注射器注入适量蒸馏水,使固体全部溶解;
,通过注射器注入适量蒸馏水,使固体全部溶解;ii.将部分液体转移至B中;
iii.向A中剩余的溶液中滴加几滴酚酞试液。
回答下列问题:
(1)“步骤ii”B中左侧溶液褪色且有气泡产生,右侧溶液变为红色。
①将部分液体转移至B中的具体操作为
②试剂X是
 。
。③左侧
 参与反应的离子方程式为
参与反应的离子方程式为(2)若向“步骤iii”A中剩余的溶液中加入
 时,有大量气泡产生。
时,有大量气泡产生。①
 在该反应中的作用为
在该反应中的作用为②“步骤iii”的现象为
 与
与 反应的机理是
反应的机理是(3)向包裹着适量
 的脱脂棉(放在石棉网上)上滴加3~4滴水,结果脱脂棉剧烈燃烧。由此可得出与该反应相关的结论是
的脱脂棉(放在石棉网上)上滴加3~4滴水,结果脱脂棉剧烈燃烧。由此可得出与该反应相关的结论是
您最近一年使用:0次
2022-10-14更新
|
198次组卷
|
3卷引用:湖北省宜昌市协作体2022-2023学年高三上学期期中考试化学试题



