名校
解题方法
1 . 绿矾(FeSO4⋅7H2O)是治疗缺铁性贫血药品的重要成分,某化学兴趣小组利用工厂的废铁屑(主要成分为Fe,此外还含有少量Cu、Al,Al2O3和Fe2O3)制备磁性Fe3O4胶体粒子、绿矾和净水剂Na2FeO4的实验流程如图:
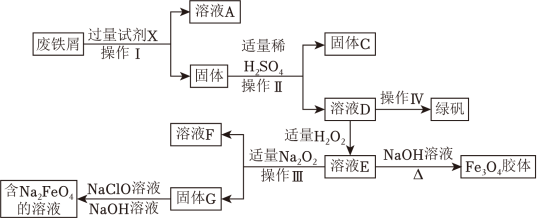
请回答下列问题:
(1)试剂X化学式为_____ 。写出加入过量试剂X时所有发生反应的离子方程式_____ 。
(2)铁元素位于元素周期表_____ 。
(3)固体C化学名称为_____ 。溶液D中加入KSCN溶液,无血红色产生,原因是_____ (用化学方程式表示)。
(4)为得到绿矾晶体需要将溶液D进行_____ (“蒸发结晶”或“降温结晶”)。
(5)D中加入适量H2O2生成E的离子方程式_____ 。若D中含amolFe2+,则理论上加入_____ molH2O2可使溶液E中铁元素恰好转化为Fe3O4胶体。
(6)由固体G生成Na2FeO4的离子方程式为_____ 。

请回答下列问题:
(1)试剂X化学式为
(2)铁元素位于元素周期表
(3)固体C化学名称为
(4)为得到绿矾晶体需要将溶液D进行
(5)D中加入适量H2O2生成E的离子方程式
(6)由固体G生成Na2FeO4的离子方程式为
您最近一年使用:0次
2 . 研究物质性质及物质转化具有重要的价值,根据所学知识回答下列问题:
(1)按如图所示操作,充分反应后:

①Ⅱ中发生反应的离子方程式为______ 。
②结合I、Ⅱ实验现象可知 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_______ 。
(2)高铁酸钠( )是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为:
)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为: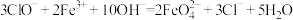
①该反应中发生还原反应的物质是_______ (填化学式,下同),氧化产物是_________ 。
②用双线桥法标出电子转移的数目和方向:________ 。
(1)按如图所示操作,充分反应后:

①Ⅱ中发生反应的离子方程式为
②结合I、Ⅱ实验现象可知
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(2)高铁酸钠(
 )是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为:
)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为: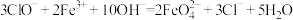
①该反应中发生还原反应的物质是
②用双线桥法标出电子转移的数目和方向:
您最近一年使用:0次
名校
3 . 电子工业中,人们常用FeCl3溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
(1)请用化学方程式表示制造印刷电路板的反应原理_________________ 。
为了从腐蚀废液中回收铜并重新获得FeCl3溶液,可采用以下步骤:
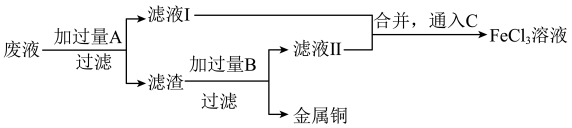
(2)写出回收铜并重新获得FeCl3溶液的过程中加入的有关物质的化学式:
A________ ,B________ ,C________ 。
(3)滤液Ⅰ中的阳离子既有氧化性又有还原性,判断的依据是_________________ 。为检验该金属阳离子,可设计的实验操作及实验现象为_________________ (可选择的试剂为“锌片”、KSCN溶液、“酸性H2O2”、“酸性KMnO4溶液”或“NaOH溶液”),且该过程发生的氧化还原反应离子方程式为_______________ 。
(4)上述步骤中,通入C发生反应的离子方程式为___________________ 。
(1)请用化学方程式表示制造印刷电路板的反应原理
为了从腐蚀废液中回收铜并重新获得FeCl3溶液,可采用以下步骤:

(2)写出回收铜并重新获得FeCl3溶液的过程中加入的有关物质的化学式:
A
(3)滤液Ⅰ中的阳离子既有氧化性又有还原性,判断的依据是
(4)上述步骤中,通入C发生反应的离子方程式为
您最近一年使用:0次
2024-01-09更新
|
63次组卷
|
2卷引用:新疆乌鲁木齐市实验学校2023-2024学年高一上学期1月期末化学试题
名校
解题方法
4 . 已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题。
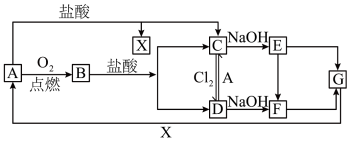
(1)写出A、C、F、G的化学式:
A__________ ,C___________ ,F___________ ,G__________
(2)检验D中阳离子的方法为____________________________
(3)保存C溶液时要加固体A的原因是____________________
(4)写出下列转化的离子方程式:
①D→C:______________________________________________________
②C→D:______________________________________________________
(5)写出E→F的化学方程式:_____________________________________________

(1)写出A、C、F、G的化学式:
A
(2)检验D中阳离子的方法为
(3)保存C溶液时要加固体A的原因是
(4)写出下列转化的离子方程式:
①D→C:
②C→D:
(5)写出E→F的化学方程式:
您最近一年使用:0次
2024-01-04更新
|
168次组卷
|
6卷引用:新疆乌鲁木齐市第十一中学2023-2024学年高一上学期1月期末化学试题
5 . 某工厂的工业废水中含有大量的FeSO4和较多的Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属铜。请根据以下流程图,回答下列问题:

(1)⑥操作方法的名称是_______ ;操作⑨包括:蒸发浓缩、_______ 、过滤、洗涤、低温干燥。
(2)某兴趣小组同学欲鉴别④中的金属阳离子,设计如下实验:
甲同学取2.0mL④溶液,滴加氢氧化钠溶液,产生白色沉淀且很快变为灰绿色,最后变为红褐色沉淀,其中涉及氧化还原反应的化学方程式为_______ 。
乙同学取2.0mL④溶液,先加入几滴KSCN溶液,无明显现象,再加入几滴氯水,溶液变红,其中涉及氧化还原反应的离子方程式为_______ 。
(3)若按上述工艺处理1000L该工业废水,制得320g铜,则该工业废水中c(Cu2+)=_______ 。
(4)在Fe2(SO4)3溶液中,加入ag铜,完全溶解后,再加bg铁,充分反应后得到cg残余固体,且a>c。试分析残留固体的成分为________ (填元素符号,下同),所得溶液中阳离子为_______ 。

(1)⑥操作方法的名称是
(2)某兴趣小组同学欲鉴别④中的金属阳离子,设计如下实验:
甲同学取2.0mL④溶液,滴加氢氧化钠溶液,产生白色沉淀且很快变为灰绿色,最后变为红褐色沉淀,其中涉及氧化还原反应的化学方程式为
乙同学取2.0mL④溶液,先加入几滴KSCN溶液,无明显现象,再加入几滴氯水,溶液变红,其中涉及氧化还原反应的离子方程式为
(3)若按上述工艺处理1000L该工业废水,制得320g铜,则该工业废水中c(Cu2+)=
(4)在Fe2(SO4)3溶液中,加入ag铜,完全溶解后,再加bg铁,充分反应后得到cg残余固体,且a>c。试分析残留固体的成分为
您最近一年使用:0次
6 . 化学兴趣小组制备 并探究
并探究 的部分性质,实验装置如图所示。
的部分性质,实验装置如图所示。
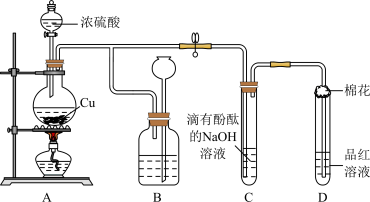
(1)装置A烧瓶中发生反应的化学方程式为_______ 。
(2)装置A制取 的反应中,体现了浓硫酸的
的反应中,体现了浓硫酸的_______ 性和_______ 性,_______ (填“能”或“不能”)用浓盐酸代替浓硫酸来制取 。
。
(3)装置B的作用是贮存多余的气体,B广口瓶内应盛放的液体是_______ (填序号)。
①水 ②饱和 溶液 ③NaOH溶液 ④酸性
溶液 ③NaOH溶液 ④酸性
(4)装置C和D中产生的现象相同,但原因却不同。C中是由于 与溶液中的NaOH反应使碱性减弱,而D中则是由于
与溶液中的NaOH反应使碱性减弱,而D中则是由于 具有
具有_______ 性。
(5)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是_______ 。
(6) 为无色、有强烈刺激性气味的气体,是大气主要污染物之一,具有一定的还原性。探究
为无色、有强烈刺激性气味的气体,是大气主要污染物之一,具有一定的还原性。探究 气体还原
气体还原 、
、 的装置如图所示:
的装置如图所示:
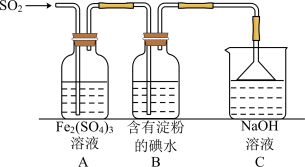
①在上述装置中通入过量的 ,为了验证A中
,为了验证A中 与
与 发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案a:往第一份溶液中加入少量酸性 溶液,紫红色褪去。
溶液,紫红色褪去。
方案b:往第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是_______ (填“a”或“b”),理由是_______ 。
②在上述装置中能表明 的还原性强于
的还原性强于 的现象是
的现象是_______ 。
 并探究
并探究 的部分性质,实验装置如图所示。
的部分性质,实验装置如图所示。
(1)装置A烧瓶中发生反应的化学方程式为
(2)装置A制取
 的反应中,体现了浓硫酸的
的反应中,体现了浓硫酸的 。
。(3)装置B的作用是贮存多余的气体,B广口瓶内应盛放的液体是
①水 ②饱和
 溶液 ③NaOH溶液 ④酸性
溶液 ③NaOH溶液 ④酸性
(4)装置C和D中产生的现象相同,但原因却不同。C中是由于
 与溶液中的NaOH反应使碱性减弱,而D中则是由于
与溶液中的NaOH反应使碱性减弱,而D中则是由于 具有
具有(5)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是
(6)
 为无色、有强烈刺激性气味的气体,是大气主要污染物之一,具有一定的还原性。探究
为无色、有强烈刺激性气味的气体,是大气主要污染物之一,具有一定的还原性。探究 气体还原
气体还原 、
、 的装置如图所示:
的装置如图所示:
①在上述装置中通入过量的
 ,为了验证A中
,为了验证A中 与
与 发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:方案a:往第一份溶液中加入少量酸性
 溶液,紫红色褪去。
溶液,紫红色褪去。方案b:往第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是
②在上述装置中能表明
 的还原性强于
的还原性强于 的现象是
的现象是
您最近一年使用:0次
2023-04-27更新
|
113次组卷
|
2卷引用:新疆阿克苏市实验中学2022-2023学年高一下学期第三次月考化学试题
7 . 现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
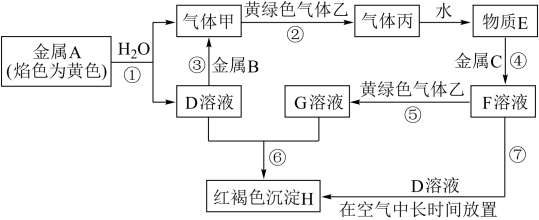
请根据以上信息完成下列各题:
(1)写出下列物质的化学式:B______ ,丙______ ,H______ 。
(2)写出实验室制备黄绿色气体乙的化学方程式:______ 。
(3)写出B+D→甲反应的化学方程式:______ 。
(4)D溶液和F溶液在空气中混合的现象:______ 。写出⑦涉及的离子方程式:______ 。
(5)检验物质D中金属阳离子的实验方法名称______ (不要求写具体操作过程),检验物质G中金属阳离子的常用试剂______ (填名称),实验现象为______ 。

请根据以上信息完成下列各题:
(1)写出下列物质的化学式:B
(2)写出实验室制备黄绿色气体乙的化学方程式:
(3)写出B+D→甲反应的化学方程式:
(4)D溶液和F溶液在空气中混合的现象:
(5)检验物质D中金属阳离子的实验方法名称
您最近一年使用:0次
名校
解题方法
8 . 为探索含铝、铁、铜合金(其余成分与酸碱都不反应)废料的再利用,某同学实设计的回收利用方案如下:
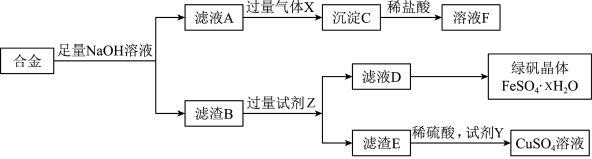
(1)写出合金与NaOH溶液反应的离子方程式_______ 。
(2)试剂Y是H2O2溶液,写出生成硫酸铜溶液的化学方程式_______ 。
(3)检验滤液D中含有的金属阳离子的操作:_______ 。
(4)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:_______ 、过滤、洗涤、干燥。
(5)取少量D溶液于试管中,向其滴加NaOH溶液,观察到现象_______ 。

(1)写出合金与NaOH溶液反应的离子方程式
(2)试剂Y是H2O2溶液,写出生成硫酸铜溶液的化学方程式
(3)检验滤液D中含有的金属阳离子的操作:
(4)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:
(5)取少量D溶液于试管中,向其滴加NaOH溶液,观察到现象
您最近一年使用:0次
9 . 已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
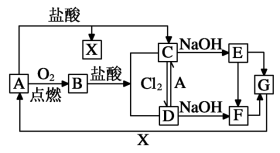
(1)写出X、B、D、F的化学式:X_____ 、B_____ 、D____ 、E_____ 、 G_____ 。
(2)写出A与水反应的化学方程式_____ 。
(3)检验D中阳离子的操作方法__________________________ 。
(4)①写出下列转化的离子方程式D→C:_____ 。
②E转化为F时的现象_____________ ,当有1molF生成时转移电子数为____ 。

(1)写出X、B、D、F的化学式:X
(2)写出A与水反应的化学方程式
(3)检验D中阳离子的操作方法
(4)①写出下列转化的离子方程式D→C:
②E转化为F时的现象
您最近一年使用:0次
名校
解题方法
10 . 由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4•7H2O),然后制取透明氧化铁颜料的流程如图:
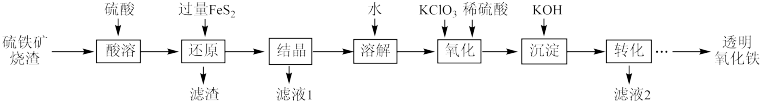
已知:
I.透明氧化铁又称纳米氧化铁,粒子直径很微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
II.Fe3+能将FeS2中的硫元素氧化为+6价。
(1)FeS2的电子式是_____ 。
(2)“滤渣”中的主要成分是_____ (填名称)。
(3)流程中“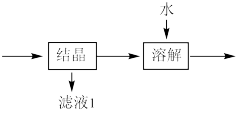 ”环节的目的是
”环节的目的是_____ 。
(4)“还原”过程中涉及的离子方程式为_____ 。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以_____ 。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示。
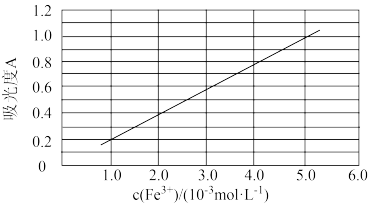
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL,测得溶液吸光度A=0.8,则透明氧化铁中氧化铁黄的质量分数为_____ 。

已知:
I.透明氧化铁又称纳米氧化铁,粒子直径很微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
II.Fe3+能将FeS2中的硫元素氧化为+6价。
(1)FeS2的电子式是
(2)“滤渣”中的主要成分是
(3)流程中“
 ”环节的目的是
”环节的目的是(4)“还原”过程中涉及的离子方程式为
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示。

称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL,测得溶液吸光度A=0.8,则透明氧化铁中氧化铁黄的质量分数为
您最近一年使用:0次



