名校
解题方法
1 . 硫酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物。一片药片所含铁元素60mg,一盒硫酸亚铁片含药100片。
(1)每盒硫酸亚铁中含铁元素的物质的量为_______ mol(结果保留小数点后一位);
(2)甲同学为检验药片中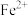 ,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如图所示),预测观察到的现象是:
,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如图所示),预测观察到的现象是:_______ ;
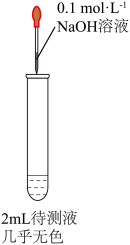
(3)乙同学认为药品有部分被氧化,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如下图所示)
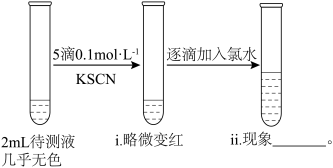
ⅱ中的现象是:_______ ;是由于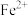 被氯水氧化,反应的离子方程式为
被氯水氧化,反应的离子方程式为_______ ;
(4)丙同学认为上述实验不能充分证明药品被部分氧化,应补充的实验是:_______ 。
(1)每盒硫酸亚铁中含铁元素的物质的量为
(2)甲同学为检验药片中
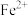 ,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如图所示),预测观察到的现象是:
,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如图所示),预测观察到的现象是:
(3)乙同学认为药品有部分被氧化,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如下图所示)

ⅱ中的现象是:
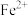 被氯水氧化,反应的离子方程式为
被氯水氧化,反应的离子方程式为(4)丙同学认为上述实验不能充分证明药品被部分氧化,应补充的实验是:
您最近一年使用:0次
2022-12-29更新
|
104次组卷
|
2卷引用:新疆巴音郭楞蒙古自治州第二中学2022-2023学年高一上学期期末考试化学试题
2 . 金属材料广泛应用于生产生活中。
(1)下列实验中,对应的现象以及结论都正确且两者具有因果关系的是_______。
(2)在 溶液蚀刻铜箔制造电路板的工艺中,是将30%的
溶液蚀刻铜箔制造电路板的工艺中,是将30%的 溶液敷在绝缘板的铜片上进行腐蚀,写出
溶液敷在绝缘板的铜片上进行腐蚀,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:_______ ;某学生对 腐蚀铜后所得溶液的成分进行测定,取少量待测溶液,滴入KSCN溶液后显红色,则该反应的离子方程式
腐蚀铜后所得溶液的成分进行测定,取少量待测溶液,滴入KSCN溶液后显红色,则该反应的离子方程式_______ 。
(3)为了从含有 、
、 的工业废水中回收Cu和硫酸亚铁晶体,某小组设计并完成了以下实验。请根据以下流程图,回答下列问题。
的工业废水中回收Cu和硫酸亚铁晶体,某小组设计并完成了以下实验。请根据以下流程图,回答下列问题。
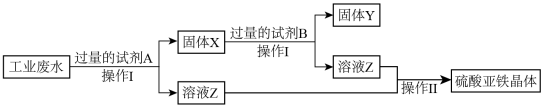
①固体X的成分_______ ,试剂B是________
②检验Z溶液中阳离子可用酸性 溶液,该反应的离子方程式
溶液,该反应的离子方程式_______ 。
(1)下列实验中,对应的现象以及结论都正确且两者具有因果关系的是_______。
| 选项 | 实验 | 现象 | 结论 |
| A | 取少量 于试管中,加入过量盐酸充分反应 于试管中,加入过量盐酸充分反应 | 黑色固体溶解,生成绿色溶液 |  为碱性氧化物 为碱性氧化物 |
| B | 将铜粉加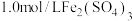 溶液中 溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
| C | 取少量 溶液于试管中,滴加几滴新制氯水,再滴2滴KSCN溶液 溶液于试管中,滴加几滴新制氯水,再滴2滴KSCN溶液 | 溶液变红 |  溶液没有变质 溶液没有变质 |
| D | 往红热的铁中通入水蒸气,将生成的气体通入肥皂液中,将燃着的火柴靠近气泡 | 气泡被点燃 | 铁在高温下能与水蒸气反应 |
 溶液蚀刻铜箔制造电路板的工艺中,是将30%的
溶液蚀刻铜箔制造电路板的工艺中,是将30%的 溶液敷在绝缘板的铜片上进行腐蚀,写出
溶液敷在绝缘板的铜片上进行腐蚀,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式: 腐蚀铜后所得溶液的成分进行测定,取少量待测溶液,滴入KSCN溶液后显红色,则该反应的离子方程式
腐蚀铜后所得溶液的成分进行测定,取少量待测溶液,滴入KSCN溶液后显红色,则该反应的离子方程式(3)为了从含有
 、
、 的工业废水中回收Cu和硫酸亚铁晶体,某小组设计并完成了以下实验。请根据以下流程图,回答下列问题。
的工业废水中回收Cu和硫酸亚铁晶体,某小组设计并完成了以下实验。请根据以下流程图,回答下列问题。
①固体X的成分
②检验Z溶液中阳离子可用酸性
 溶液,该反应的离子方程式
溶液,该反应的离子方程式
您最近一年使用:0次
3 . 铜及其化合物在生产、生活中有广泛的应用。印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路铜板制备CuCl2•2H2O,实验室模拟回收过程如图:

(1)证明步骤1所加FeCl3溶液过量的方法是____ 。
(2)步骤2中所加的氧化剂较适宜的有____ 。
(3)步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的试剂1是___ 。
A.NH3•H2O B.NaOH C.Cu(OH)2
(4)蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是____ (写出离子反应方程式并结合简要的文字说明),再经____ (某实验操作方法)、过滤得到CuCl2•2H2O。
方法一:用FeCl3溶液浸泡印刷电路铜板制备CuCl2•2H2O,实验室模拟回收过程如图:

(1)证明步骤1所加FeCl3溶液过量的方法是
(2)步骤2中所加的氧化剂较适宜的有
| A.HNO3 | B.H2O2 | C.KMnO4 | D.氯水 |
A.NH3•H2O B.NaOH C.Cu(OH)2
(4)蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是
您最近一年使用:0次
4 . 金属A能够被磁铁所吸引,A及其A的化合物之间有如图的转化关系:
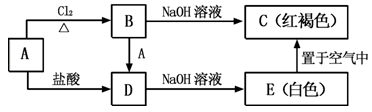
(1)写出A、C的化学式:A_______ ;C_______ 。
(2)在A→B过程中,Cl2做_______ 剂(填氧化剂或还原剂)。
(3)实验室检验B溶液中的阳离子时,通常可滴加_______ ,若溶液变为红色,则含该离子。
(4)写出B→D的离子方程式_______ 。
(5)实验室检验D溶液中的阳离子时,可加入氢氧化钠溶液,若先产生_______ 色沉淀,该沉淀在空气中迅速变为灰绿色,最终变为_______ 色,则含该离子。
(6)写出下列反应的化学方程式或离子方程式:A→D的离子方程式_______ 。E→C的化学方程式_______ 。

(1)写出A、C的化学式:A
(2)在A→B过程中,Cl2做
(3)实验室检验B溶液中的阳离子时,通常可滴加
(4)写出B→D的离子方程式
(5)实验室检验D溶液中的阳离子时,可加入氢氧化钠溶液,若先产生
(6)写出下列反应的化学方程式或离子方程式:A→D的离子方程式
您最近一年使用:0次
5 . K3[Fe(C2O4)3]•3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。请回答下列问题:
某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

(1)通入氮气的目的是_____ 。
(2)实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有____ 和____ 。
(3)为防止倒吸,停止实验时应进行的操作是___ 。
(4)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:____ 。
(5)测定三草酸合铁酸钾中铁的含量。
①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol•L-1KMnO4,溶液滴定至终点。在滴定管中装入KMnO4溶液(装液)的前一步,应进行的操作为____ 。滴定终点的现象是____ 。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该晶体中铁的质量分数的表达式为_____ 。若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,则测定结果____ (填“偏高”或“偏低”)。
某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

(1)通入氮气的目的是
(2)实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
(3)为防止倒吸,停止实验时应进行的操作是
(4)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:
(5)测定三草酸合铁酸钾中铁的含量。
①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol•L-1KMnO4,溶液滴定至终点。在滴定管中装入KMnO4溶液(装液)的前一步,应进行的操作为
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该晶体中铁的质量分数的表达式为
您最近一年使用:0次
6 . 铁是人类较早使用的金属之一,如图为铁及其化合物的“价—类”二维图。
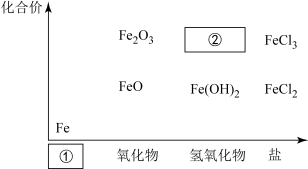
(1)填写二维图缺失的类别①_______ 和化学式②_______ 。
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:①Cl2 ②Fe ③NaOH ④AgNO3。从物质类别上看,FeCl3属于_______ ,可能与_______ 发生反应(填序号);从化合价角度看,Fe3+具有_______ 性,可能与_______ 发生反应(填序号)。
(3)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:_______ 。
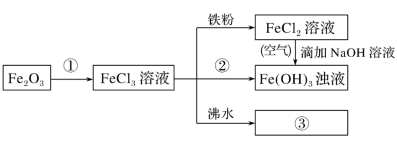
(5)Fe2O3与物质①反应的化学方程式为_______ 。
(6)FeCl2溶液→Fe(OH)3浊液的过程中,观察到的实验现象是_______ 。

(1)填写二维图缺失的类别①
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:①Cl2 ②Fe ③NaOH ④AgNO3。从物质类别上看,FeCl3属于
(3)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:

(5)Fe2O3与物质①反应的化学方程式为
(6)FeCl2溶液→Fe(OH)3浊液的过程中,观察到的实验现象是
您最近一年使用:0次
2022-09-03更新
|
259次组卷
|
3卷引用:新疆兵团第三师图木舒克市2021-2022学年高一上学期期末考试化学试题
7 . 工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如图:

(1)气体A中的大气污染物可选用下列试剂中的_______ (填字母)吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在_______ (填离子符号),检验溶液中还存在Fe2+的方法是_______ (写出实验操作、现象和结论)。
(3)由泡铜冶炼粗铜的化学反应方程式为_______ 。
(4)在100mL稀的混合液中,HNO3和H2SO4物质的量浓度分别是4mol/L和2mol/L,向该混合液中加入32g精铜粉,发生反应的离子方程式为_______ ;所得溶液中Cu2+的物质的量浓度为_______ mol/L。

(1)气体A中的大气污染物可选用下列试剂中的
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在
(3)由泡铜冶炼粗铜的化学反应方程式为
(4)在100mL稀的混合液中,HNO3和H2SO4物质的量浓度分别是4mol/L和2mol/L,向该混合液中加入32g精铜粉,发生反应的离子方程式为
您最近一年使用:0次
2022-08-10更新
|
97次组卷
|
2卷引用:新疆乌鲁木齐市第十二中学 2022-2023学年高三下学期2月月考化学试题
名校
8 . 下列各物质均含有同一种元素,其中只有A和H为单质,A是目前用量最大、用途最广的合金的主要成分,H为黄绿色气体;C和F所含元素种类相同;将D的悬浊液露置在空气中,可观察到白色絮状沉淀迅速变为灰绿色,最后变为红褐色沉淀E,各物质间的转化关系如下图(部分反应物、生成物及反应条件已略去)
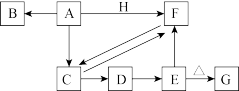
回答下列问题:
(1)A是_______ ,C是_______ (填化学式)。
(2)G的俗名为_______ 。
(3)若要除去F溶液中混有的C,应采取的实验操作为_______ ;若要除去C溶液中混有的F,涉及的化学反应的离子方程式为_______ 。
(4)写出D转化为E的化学反应方程式_______ 。
(5)人体正常的血红蛋白中含有D的阳离子,若误食亚硝酸盐,会导致血红蛋白中此阳离子被氧化而使人中毒。服用维生素C可以解毒,在此过程中体现了维生素C的_______ 性。

回答下列问题:
(1)A是
(2)G的俗名为
(3)若要除去F溶液中混有的C,应采取的实验操作为
(4)写出D转化为E的化学反应方程式
(5)人体正常的血红蛋白中含有D的阳离子,若误食亚硝酸盐,会导致血红蛋白中此阳离子被氧化而使人中毒。服用维生素C可以解毒,在此过程中体现了维生素C的
您最近一年使用:0次
2022-07-10更新
|
165次组卷
|
3卷引用:新疆石河子第一中学2023-2024学年高一上学期11月月考化学试题
名校
解题方法
9 . 已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀。

(1)检验W溶液中金属阳离子所用试剂为_______ (填化学式);
(2)H在潮湿空气中变成M的现象是_______ ,发生反应的化学方程式为_______ ;
(3)A和水反应生成B和C的离子方程式为_______ ;在标准状况下生成11.2 LC气体时,转移电子的个数为_______ NA(用阿伏加德罗常数NA表示);
(4)D中加入盐酸发生反应的离子方程式为_______ 。

(1)检验W溶液中金属阳离子所用试剂为
(2)H在潮湿空气中变成M的现象是
(3)A和水反应生成B和C的离子方程式为
(4)D中加入盐酸发生反应的离子方程式为
您最近一年使用:0次
2022-07-07更新
|
194次组卷
|
2卷引用:新疆第二师八一中学2022-2023学年高三上学期第一次月考化学试题
名校
10 . 石墨在材料领域有重要应用,某初级石墨中含 (7.8%)、
(7.8%)、 (5.1%)和
(5.1%)和 (3.1%)等杂质,提纯与综合利用工艺流程如下:
(3.1%)等杂质,提纯与综合利用工艺流程如下:
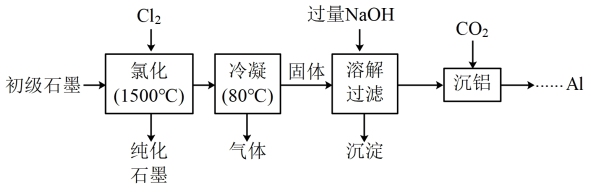
已知:①氯化后,石墨中氧化物杂质均转变为相应的氯化物;
② 的沸点为57.6℃,金属氯化物的沸点均高于150℃。
的沸点为57.6℃,金属氯化物的沸点均高于150℃。
(1)“氯化”时,先向反应器中通入 一段时间,再加热,主要目的是
一段时间,再加热,主要目的是_______ 。
(2)“冷凝”后,所得“气体"的成分有 和
和_______ (填化学式)。
(3)“溶解过滤”时,加过量NaOH溶液的目的是_______ ;取少量滤液于试管中,_______ (实验操作及现象),证明沉淀已完全。
(4)“沉铝”得到的产物为 ,工业上由
,工业上由 得到Al,需发生两步反应,写出方程式:
得到Al,需发生两步反应,写出方程式: 、
、_______ 。
(5)写出Al的一种用途_______ 。
(6)100kg初级石墨最多可获得Al的质量为_______ kg。
 (7.8%)、
(7.8%)、 (5.1%)和
(5.1%)和 (3.1%)等杂质,提纯与综合利用工艺流程如下:
(3.1%)等杂质,提纯与综合利用工艺流程如下:
已知:①氯化后,石墨中氧化物杂质均转变为相应的氯化物;
②
 的沸点为57.6℃,金属氯化物的沸点均高于150℃。
的沸点为57.6℃,金属氯化物的沸点均高于150℃。(1)“氯化”时,先向反应器中通入
 一段时间,再加热,主要目的是
一段时间,再加热,主要目的是(2)“冷凝”后,所得“气体"的成分有
 和
和(3)“溶解过滤”时,加过量NaOH溶液的目的是
(4)“沉铝”得到的产物为
 ,工业上由
,工业上由 得到Al,需发生两步反应,写出方程式:
得到Al,需发生两步反应,写出方程式: 、
、(5)写出Al的一种用途
(6)100kg初级石墨最多可获得Al的质量为
您最近一年使用:0次
2022-07-05更新
|
457次组卷
|
3卷引用:新疆石河子第一中学2023-2024学年高二上学期9月月考化学试题



