名校
解题方法
1 . 铁是人类较早使用的金属之一,运用所学知识,回答下列问题。
I.某学习小组研究 腐蚀铜后所得的废液成分并回收铜,进行了如下实验:
腐蚀铜后所得的废液成分并回收铜,进行了如下实验:
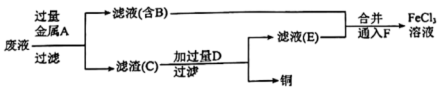
(1)滤渣C中所含物质的化学式为___________ ;通入F发生反应的离子方程式为___________ 。
(2)滤渣C与试剂D反应的离子方程式为_______ ,为测定滤渣中铜的质量分数,取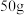 的滤渣与足量的试剂D反应,得到
的滤渣与足量的试剂D反应,得到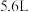 气体(标准状况下),试计算滤渣中铜的质量分数
气体(标准状况下),试计算滤渣中铜的质量分数______ 。
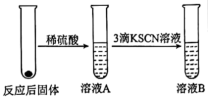
Ⅱ.学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验
请回答:
(3)实验I中反应的化学方程式是___________ 。
(4)甲同学观察到实验Ⅰ中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色,则溶液B未呈现红色的原因是___________ 。(写出反应的离子方程式)
(5)实验室在制备 时必须隔绝空气,否则发生的现象是
时必须隔绝空气,否则发生的现象是___________ ;反应化学方程式为___________ 。
I.某学习小组研究
 腐蚀铜后所得的废液成分并回收铜,进行了如下实验:
腐蚀铜后所得的废液成分并回收铜,进行了如下实验:
(1)滤渣C中所含物质的化学式为
(2)滤渣C与试剂D反应的离子方程式为
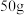 的滤渣与足量的试剂D反应,得到
的滤渣与足量的试剂D反应,得到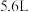 气体(标准状况下),试计算滤渣中铜的质量分数
气体(标准状况下),试计算滤渣中铜的质量分数Ⅱ.学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验
| 实验I | 实验Ⅱ |
 |  |
(3)实验I中反应的化学方程式是
(4)甲同学观察到实验Ⅰ中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色,则溶液B未呈现红色的原因是
(5)实验室在制备
 时必须隔绝空气,否则发生的现象是
时必须隔绝空气,否则发生的现象是
您最近一年使用:0次
名校
解题方法
2 . 铁是人类比较早使用的金属之一,完成下列问题:
Ⅰ.电子工业中用30%的FeCl3 溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程如图所示。

(1)FeCl3 溶液蚀刻铜箔反应的离子方程式为:_______ ;
(2)滤液中存在较多的阳离子是_______ ;
(3)以下试剂也可以替代氯气完成转化,最好选用的是_______ (填序号)。
a.酸性KMnO4溶液 b.H2O2 溶液 c.溴水
Ⅱ.某氯化铁样品中含有少量FeCl2杂质,现要测定其中铁元素的质量分数,实验步骤如下:
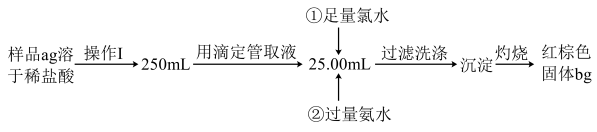
(4)过滤时所用到的玻璃仪器有_______ (填仪器名称)。
(5)写出②加入过量氨水的离子方程式:_______ 。
(6)样品中铁元素的质量分数为_______ 。
(7)若沉淀灼烧不充分,对最终测量结果的影响:_______ (填“偏大”“偏小”或“无影响”)。
Ⅰ.电子工业中用30%的FeCl3 溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程如图所示。

(1)FeCl3 溶液蚀刻铜箔反应的离子方程式为:
(2)滤液中存在较多的阳离子是
(3)以下试剂也可以替代氯气完成转化,最好选用的是
a.酸性KMnO4溶液 b.H2O2 溶液 c.溴水
Ⅱ.某氯化铁样品中含有少量FeCl2杂质,现要测定其中铁元素的质量分数,实验步骤如下:

(4)过滤时所用到的玻璃仪器有
(5)写出②加入过量氨水的离子方程式:
(6)样品中铁元素的质量分数为
(7)若沉淀灼烧不充分,对最终测量结果的影响:
您最近一年使用:0次
解题方法
3 . 硫酸是一种具有高腐蚀性的强矿物酸,浓硫酸是指质量分数大于等于70%的硫酸溶液,又称“坏水”,下列关于浓硫酸的性质叙述中,正确的是
| A.炽热的碳与浓硫酸反应,浓硫酸表现强氧化性和酸性 |
| B.浓硫酸使蔗糖炭化,浓硫酸表现吸水性 |
| C.胆矾晶体上滴加浓硫酸,变成白色固体,浓硫酸表现脱水性 |
| D.热的浓硫酸溶液与过量的铁粉反应,至少涉及三个氧化还原反应 |
您最近一年使用:0次
名校
4 . 实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式为[Fe2(OH)n(SO4)3-0.5n]m,制备过程如图所示,下列说法正确的是
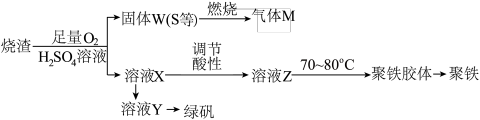

| A.炉渣中FeS与硫酸和氧气反应的离子方程式为4FeS+3O2+12H+=4Fe3++4S↓+6H2O |
| B.气体M的成分是SO3,与水反应得到硫酸,可循环使用 |
| C.向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y |
| D.溶液Z的酸碱性影响聚铁中铁的质量分数,若其酸性过强,将导致聚铁中铁的质量分数偏大 |
您最近一年使用:0次
5 . 回答下列问题
(1)图为实验室某浓盐酸试剂瓶标签上的有关数据,根据数据计算该浓盐酸中HCl的物质的量浓度为___________ 。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___________。
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol/L的稀盐酸,需量取___________ mL上述浓盐酸,最终确定所配溶液体积的容器是___________ (填名称)。
Ⅱ、已知有以下物质相互转化
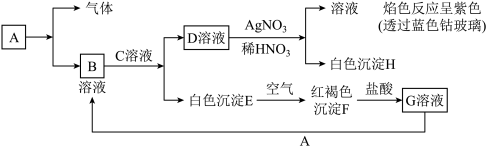
试回答:
(4)写出B的化学式______________ ,怎样检验B溶液中的阳离子__________ (合理答案均给分),D的化学式________ 。
(5)写出由E转变成F的化学方程式____________________ 。
(6)写出用KSCN鉴别G溶液的离子方程式________________ ;向G溶液加入A的有关化学反应方程式_________________ 。
(7)写出F受热分解的化学方程式________________ 。
(1)图为实验室某浓盐酸试剂瓶标签上的有关数据,根据数据计算该浓盐酸中HCl的物质的量浓度为
盐酸 分子式: HCl 相对分子质量: 36.5 密度: 1.19g/mL HCl的质量分数: 36.5%| |
| A.溶液中HCl的物质的量 | B.溶液的浓度 | C.溶液中Cl-的数目 | D.溶液的密度 |
Ⅱ、已知有以下物质相互转化

试回答:
(4)写出B的化学式
(5)写出由E转变成F的化学方程式
(6)写出用KSCN鉴别G溶液的离子方程式
(7)写出F受热分解的化学方程式
您最近一年使用:0次
6 . 以铁屑(表面含少量 )为原料先制备
)为原料先制备 ,再通过灼烧、还原制备高纯度还原铁粉的工艺流程如下:
,再通过灼烧、还原制备高纯度还原铁粉的工艺流程如下:

(1)酸溶。将铁屑溶于足量的稀 中过滤所得溶液经检验不含
中过滤所得溶液经检验不含 。
。
①检验酸溶后的溶液是否含 的实验操作是
的实验操作是_______ 。
②滤液中不存在 的原因是
的原因是_______ 。
(2)沉淀、过滤。向酸溶后的溶液中滴加稍过量的 ,过滤得
,过滤得 。
。
①沉淀反应的离子方程式为_______ 。
②沉淀中 含量的测定:准确称取6.300g沉淀,加入适量蒸馏水和稀硫酸溶解、酸化,并转移入250mL容量瓶中定容,取25.00mL溶液,向其中滴加
含量的测定:准确称取6.300g沉淀,加入适量蒸馏水和稀硫酸溶解、酸化,并转移入250mL容量瓶中定容,取25.00mL溶液,向其中滴加
 溶液,完全反应时,消耗
溶液,完全反应时,消耗 溶液20.00mL。
溶液20.00mL。
过程中发生的反应为: (未配平,假设杂质不参与反应)。计算沉淀中
(未配平,假设杂质不参与反应)。计算沉淀中 (相对分子质量为180)的质量分数
(相对分子质量为180)的质量分数_______ (写出计算过程)。
(3)灼烧。在氧气流中灼烧 得
得 、
、 。
。
①灼烧时发生反应的化学方程式为_______ 。
②研究发现, 也可以灼烧得到
也可以灼烧得到 ,但灼烧
,但灼烧 得到的
得到的 比灼烧
比灼烧 得到的
得到的 更容易被还原,可能的原因是
更容易被还原,可能的原因是_______ 。
(4)还原。为制得高纯度的还原铁粉,以下还原剂最合适的是_______ 。
A.碳粉 B.铝粉 C.氢气
 )为原料先制备
)为原料先制备 ,再通过灼烧、还原制备高纯度还原铁粉的工艺流程如下:
,再通过灼烧、还原制备高纯度还原铁粉的工艺流程如下:
(1)酸溶。将铁屑溶于足量的稀
 中过滤所得溶液经检验不含
中过滤所得溶液经检验不含 。
。①检验酸溶后的溶液是否含
 的实验操作是
的实验操作是②滤液中不存在
 的原因是
的原因是(2)沉淀、过滤。向酸溶后的溶液中滴加稍过量的
 ,过滤得
,过滤得 。
。①沉淀反应的离子方程式为
②沉淀中
 含量的测定:准确称取6.300g沉淀,加入适量蒸馏水和稀硫酸溶解、酸化,并转移入250mL容量瓶中定容,取25.00mL溶液,向其中滴加
含量的测定:准确称取6.300g沉淀,加入适量蒸馏水和稀硫酸溶解、酸化,并转移入250mL容量瓶中定容,取25.00mL溶液,向其中滴加
 溶液,完全反应时,消耗
溶液,完全反应时,消耗 溶液20.00mL。
溶液20.00mL。过程中发生的反应为:
 (未配平,假设杂质不参与反应)。计算沉淀中
(未配平,假设杂质不参与反应)。计算沉淀中 (相对分子质量为180)的质量分数
(相对分子质量为180)的质量分数(3)灼烧。在氧气流中灼烧
 得
得 、
、 。
。①灼烧时发生反应的化学方程式为
②研究发现,
 也可以灼烧得到
也可以灼烧得到 ,但灼烧
,但灼烧 得到的
得到的 比灼烧
比灼烧 得到的
得到的 更容易被还原,可能的原因是
更容易被还原,可能的原因是(4)还原。为制得高纯度的还原铁粉,以下还原剂最合适的是
A.碳粉 B.铝粉 C.氢气
您最近一年使用:0次
2022-08-29更新
|
643次组卷
|
3卷引用:江苏省苏州市2021-2022学年高一下学期期末学业质量阳光指标调研(延期到8月)化学试题
解题方法
7 . 钪的价格昂贵,在地壳里的含量只有0.0005%,化学性质非常活泼。从铝土矿生产Al2O3的副产品“赤泥”(主要成分为Al2O3、Fe2O3、TiO2、Sc2O3)中回收钪,同时生产聚合硫酸铁铝[ AlFe( OH)6-2n(SO4)n]具有极其重要的工业价值,一种工艺流程如下:
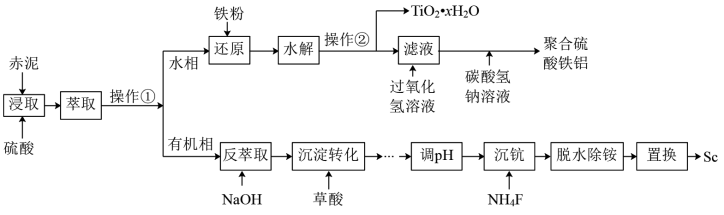
已知:钪离子可以在不同pH下生成[ Sc( OH)n]3-n(n=1~6)。
请回答以下问题:
(1)操作②的名称___________ ,操作①和操作②中都使用的玻璃仪器是___________ 。
(2)加入铁粉的作用___________ 。
(3)生成聚合硫酸铁铝[AlFe( OH)6-2n(SO4)n]的离子方程式为___________ 。
(4)钪的发现较晚,主要是因为___________ 。
(5)“反萃取”时若加的入氢氧化钠过量, Sc(OH)3沉淀会溶解。写出Sc(OH)3与过量NaOH溶液反应的化学方程式___________ 。
(6)常温下,三价Sc的部分存在形式与氟离子浓度的对数[1gc(F-)]、pH的关系如图所示。若溶液中c(F- )=5 ×10-6mol·L-1,“调pH”过程中控制pH=7,则调节pH后三价Sc的存在形式为___________ (填化学式)(lg5=0.7)。

如果Sc的沉淀方式主要是ScF3,则溶液中c(F -)应该大于___________ mol ·L-1(100.6=4)
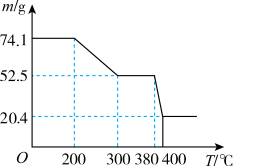
(7)“脱水除铵”过程中,复盐3NH4Cl·ScF3·aH2O分解得到ScF3,固体样品质量与温度的关系如图所示。加热至380-400℃产生白烟, 400℃以上质量不再改变。则a=___________ (填数字)。

已知:钪离子可以在不同pH下生成[ Sc( OH)n]3-n(n=1~6)。
请回答以下问题:
(1)操作②的名称
(2)加入铁粉的作用
(3)生成聚合硫酸铁铝[AlFe( OH)6-2n(SO4)n]的离子方程式为
(4)钪的发现较晚,主要是因为
(5)“反萃取”时若加的入氢氧化钠过量, Sc(OH)3沉淀会溶解。写出Sc(OH)3与过量NaOH溶液反应的化学方程式
(6)常温下,三价Sc的部分存在形式与氟离子浓度的对数[1gc(F-)]、pH的关系如图所示。若溶液中c(F- )=5 ×10-6mol·L-1,“调pH”过程中控制pH=7,则调节pH后三价Sc的存在形式为

如果Sc的沉淀方式主要是ScF3,则溶液中c(F -)应该大于
(7)“脱水除铵”过程中,复盐3NH4Cl·ScF3·aH2O分解得到ScF3,固体样品质量与温度的关系如图所示。加热至380-400℃产生白烟, 400℃以上质量不再改变。则a=

您最近一年使用:0次
8 . 某炉渣的主要成分为铁的氧化物及SiO2等,用它制备聚铁[Fe2(OH)n(SO4)3-0.5n]m和绿矾(FeSO4·7H2O)的流程如图所示:

下列说法正确的是

下列说法正确的是
| A.A酸可以是盐酸,固体W是SiO2 |
| B.调节溶液X的pH,加入的药品是FeO |
| C.溶液X生成溶液Y需要加入铁粉,溶液Y过滤得绿矾 |
| D.若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏低 |
您最近一年使用:0次
名校
解题方法
9 . 现有CuO和Fe2O3组成的混合物若干克,向其中加入一定浓度的硫酸溶液50.0mL,恰好完全反应。向反应后的溶液中不断加入铁粉,加入铁粉的质量与充分反应后剩余固体的质量关系如图所示。

试计算:
(1)固体混合物中CuO的质量分数为_______ %;
(2)硫酸溶液的物质的量浓度为_______ mol/L

试计算:
(1)固体混合物中CuO的质量分数为
(2)硫酸溶液的物质的量浓度为
您最近一年使用:0次
2021-01-30更新
|
364次组卷
|
5卷引用:浙江省嘉兴市2020-2021学年高一上学期期末测试化学试题
浙江省嘉兴市2020-2021学年高一上学期期末测试化学试题(已下线)【浙江新东方】在线化学60高一下(已下线)【浙江新东方】在线化学63高一下(已下线)【浙江新东方】在线化学52高一上浙江省湖州市安吉县高级中学等2021-2022学年高一下学期返校联考化学试题
20-21高一下·江苏苏州·期中
名校
解题方法
10 . 铁及其化合物在日常生活中应用广泛,请回答下列问题:
(1) Fe(NO3)3·9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂,工业上用细铁屑与稀硝随反应制备,主要流程如下:

①写出铁屑与稀硝酸反应的化学方程式___________ 。反应时温度控制在40 -50℃,不宜过高的原因是___________ 。
②制备过程中需控制加入铁屑的量,原因是___________ (用离子方程式回答)。
③制得的Fe(NO3)3·9H2O用20%HNO3洗涤,其原因是___________ 。
(2)上述工业生产的尾气中含有氮氧化物NOx,(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁,工业上常用Na2CO3溶液吸收处理NOx。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO3+CO2 (I)
2NO2+Na2CO3=NaNO2+NaNO3+CO2 (II)
①将1 mol NOx通入Na2CO3溶液中被完全吸收时,溶液中生成的 、
、 两种离子的物质的量随x变化关系如下图所示,则图中线段a表示
两种离子的物质的量随x变化关系如下图所示,则图中线段a表示___________ (填离子符号)随x值变化的关系。

②为了检测吸收液中NaNO2含量,某兴趣小组取100 mL该吸收液,用0.0050 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液的体积为16.00 mL。
已知: 被氧化成
被氧化成 ,写出离子方程式
,写出离子方程式___________ ,则吸收液中NaNO2的物质的量浓度为___________ 。
(1) Fe(NO3)3·9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂,工业上用细铁屑与稀硝随反应制备,主要流程如下:

①写出铁屑与稀硝酸反应的化学方程式
②制备过程中需控制加入铁屑的量,原因是
③制得的Fe(NO3)3·9H2O用20%HNO3洗涤,其原因是
(2)上述工业生产的尾气中含有氮氧化物NOx,(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁,工业上常用Na2CO3溶液吸收处理NOx。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO3+CO2 (I)
2NO2+Na2CO3=NaNO2+NaNO3+CO2 (II)
①将1 mol NOx通入Na2CO3溶液中被完全吸收时,溶液中生成的
 、
、 两种离子的物质的量随x变化关系如下图所示,则图中线段a表示
两种离子的物质的量随x变化关系如下图所示,则图中线段a表示
②为了检测吸收液中NaNO2含量,某兴趣小组取100 mL该吸收液,用0.0050 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液的体积为16.00 mL。
已知:
 被氧化成
被氧化成 ,写出离子方程式
,写出离子方程式
您最近一年使用:0次



