1 . 研究性学习小组对 及其化合物的相关性质进行探究。
及其化合物的相关性质进行探究。
探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略)。
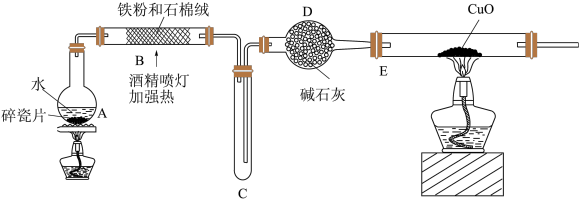
(1)A中放碎瓷片的目的是_______ 。
(2)硬质玻璃管b中发生反应的化学方程式为:_______ 。
(3)装置D的作用是_______ 。
探究二:确定探究一反应后硬质玻璃管B中黑色固体的成分。
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,进行如下实验,请将下表补充完整:
探究三:利用如下图所示装置制备 。
。
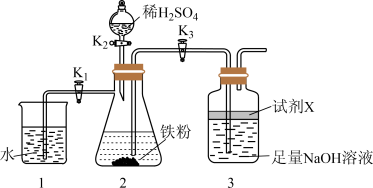
(5)试剂X可选用植物油,其主要作用是_______ 。
(6)实验开始时,打开分液漏斗塞子,关闭 ,依次打开
,依次打开 、
、 的目的是
的目的是_______ 。一段时间后关闭 ,打开
,打开 ,可观察到的现象是
,可观察到的现象是_______ 。
 及其化合物的相关性质进行探究。
及其化合物的相关性质进行探究。探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略)。

(1)A中放碎瓷片的目的是
(2)硬质玻璃管b中发生反应的化学方程式为:
(3)装置D的作用是
探究二:确定探究一反应后硬质玻璃管B中黑色固体的成分。
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,进行如下实验,请将下表补充完整:
| 步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
I.取少量滤液,滴加 溶液 溶液 | 溶液不变红,为浅绿色 | 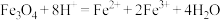 ① | 滤液中的阳离子为③ |
Ⅱ.取少量滤液,滴加 溶液 溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ② (白色); (白色);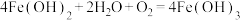 |
探究三:利用如下图所示装置制备
 。
。
(5)试剂X可选用植物油,其主要作用是
(6)实验开始时,打开分液漏斗塞子,关闭
 ,依次打开
,依次打开 、
、 的目的是
的目的是 ,打开
,打开 ,可观察到的现象是
,可观察到的现象是
您最近一年使用:0次
2 . 下列实验的方案设计、现象和结论都正确的是
| 选项 | 实验目的 | 实验方案设计 | 实验现象和结论 |
| A | 检验某固体试样中是否存在三价铁 | 取少量固体试样完全溶于盐酸,再滴加KSCN溶液 | 没有出现血红色,说明该固体试样中不存在三价铁 |
| B | 检验溴乙烷中溴元素 | 溴乙烷和NaOH溶液混合,振荡后加热,静置分层后,取少量上层清液,移入另一支试管中,加入2滴 溶液 溶液 | 若有淡黄色沉淀产生,则说明溴乙烷中含溴元素 |
| C | 比较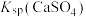 与 与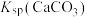 的大小 的大小 | 向饱和 溶液中滴加相同浓度的 溶液中滴加相同浓度的 溶液 溶液 | 产生白色沉淀,说明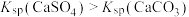 |
| D | 探究电石与水的反应 | 将电石与饱和食盐水反应产生的气体通入酸性高锰酸钾溶液 | 若酸性高锰酸钾溶液褪色,说明电石与水反应生成了乙炔 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-01更新
|
1214次组卷
|
9卷引用:湖南省名校大联考2024届高三上学期第一次质量检测化学试题
湖南省名校大联考2024届高三上学期第一次质量检测化学试题湖南四大名校2024届高三上学期第一次联考化学试题湖南省长沙市长郡中学、衡阳市第八中学2024届高三8月大联考化学试题湖南省炎德英才联考2024届高三上学期第一次质量检测化学试题(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)江西省宜春市宜丰中学创新部2023-2024学年高三上学期第一次月考化学试题湖南省长沙市湖南师范大学附属中学2023-2024学年高三上学期第一次质量检测化学试题江苏省句容三中、海安实验中学联考2023-2024学年高三上学期10月月考化学试题重庆市江北区2023-2024学年高三下学期模拟测试化学试题(七)
名校
解题方法
3 . 某同学利用下列电池装置进行实验,探究 的氧化性和还原性。
的氧化性和还原性。
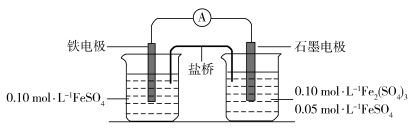
根据实验现象,下列分析不正确 的是
 的氧化性和还原性。
的氧化性和还原性。
根据实验现象,下列分析
| A.电流表显示电子由铁电极流向石墨电极,可知盐桥中的阳离子进入石墨电极溶液中 |
B.一段时间后石墨电极上未见 析出且铁电极溶液中 析出且铁电极溶液中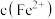 增大,可知石墨电极溶液中 增大,可知石墨电极溶液中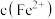 也增大 也增大 |
C.由A、B中的现象可知, 还原性小于 还原性小于 、氧化性小于 、氧化性小于 |
D.一段时间后两极溶液中的 浓度若相等,说明反应已达到平衡状态 浓度若相等,说明反应已达到平衡状态 |
您最近一年使用:0次
2022-06-03更新
|
796次组卷
|
6卷引用:北京市和平街第一中学2021-2022学年高三下学期保温化学试题
北京市和平街第一中学2021-2022学年高三下学期保温化学试题(已下线)第09讲 铁及其重要化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)易错点06 铁及其化合物-备战2023年高考化学考试易错题(已下线)专题12 电化学的综合应用(已下线)2022年北京高考真题化学试题变式题(选择题11-14)广东省梅州市大埔县虎山中学2022-2023学年高三上学期12月月考化学试题
解题方法
4 . 元素周期表中大多数元素是金属元素。小刀日常民用,大到国防军工,都能看到金属材料的身影。其中铁元素是最常见金属材料的组成元素。
(1)铁元素的相关信息如图所示,其相对原子质量是_______ 。

(2)有关铁的性质,说法正确的是_______。(选填编号)
(3)还原Fe粉可作脱氧剂,使用后为红棕色。将一包部分变质的脱氧剂用稀盐酸浸泡,浸泡过程中粉末表面会产生大量细小的无色气泡。补全溶液中可能发生的离子反应: Fe+2H+=Fe2++H2↑;_______ ;2Fe3++Fe=3Fe2+。
(4)若上述溶液充分反应后只含有Fe2+,欲检验Fe2+,不合理的操作是_______。(选填编号)
(1)铁元素的相关信息如图所示,其相对原子质量是

(2)有关铁的性质,说法正确的是_______。(选填编号)
| A.在空气中,加热Fe(OH)2可得FeO |
| B.一定条件下,Fe能与水蒸气反应生成H2 |
| C.常温下,Fe与浓H2SO4反应能产生SO2 |
| D.实验室用FeCl3溶液与NaOH溶液反应制备Fe(OH)3胶体 |
(4)若上述溶液充分反应后只含有Fe2+,欲检验Fe2+,不合理的操作是_______。(选填编号)
| A.加入氢氧化钠溶液观察现象 |
| B.先加入足量氯水,再加入KSCN溶液 |
| C.加入少量酸性KMnO4溶液观察现象 |
| D.先加入KSCN溶液,再滴加少量氯水观察现象 |
您最近一年使用:0次
名校
5 . 化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为 及少量
及少量 、
、 等)来制取绿矾
等)来制取绿矾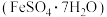 。具体制备流程如下:
。具体制备流程如下:

回答下列关于上述流程图中转化关系及操作的有关问题:
(1)在“灼烧”过程中发生的主要反应为: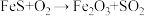 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为___________ ,氧化产物是___________ (填化学式)。
(2)足量“气体产物”通入下列溶液中,溶液会褪色的是___________(填字母序号)。
(3)“气体产物”易形成酸雨,酸雨是指
___________ 的雨水。技术员用氨水对“气体产物”进行吸收后再处理,可以回收 ,请你写出用过量氨水吸收
,请你写出用过量氨水吸收 时发生反应的化学方程式
时发生反应的化学方程式___________ 。
(4)加入足量稀硫酸时发生反应的离子方程式为:___________ 。
(5)“滤渣”的主要成分是___________ (填化学式)。
(6)加入足量X时发生反应的离子方程式为:___________ 。
(7)系列操作包括:___________ 、过滤、洗涤、干燥。
(8)绿矾保存不当,容易被氧化变质,为了检验所得产品是否变质,技术人员进行了以下操作:取少量产品(绿矾)置于试管中,加水溶解,向溶液中加入___________ 溶液,发现___________ (填现象),则绿矾已经变质。
 及少量
及少量 、
、 等)来制取绿矾
等)来制取绿矾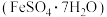 。具体制备流程如下:
。具体制备流程如下:
回答下列关于上述流程图中转化关系及操作的有关问题:
(1)在“灼烧”过程中发生的主要反应为:
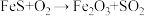 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为(2)足量“气体产物”通入下列溶液中,溶液会褪色的是___________(填字母序号)。
| A.品红溶液 | B.紫色石蕊溶液 | C.酸性 溶液 溶液 | D.溴水 |

 ,请你写出用过量氨水吸收
,请你写出用过量氨水吸收 时发生反应的化学方程式
时发生反应的化学方程式(4)加入足量稀硫酸时发生反应的离子方程式为:
(5)“滤渣”的主要成分是
(6)加入足量X时发生反应的离子方程式为:
(7)系列操作包括:
(8)绿矾保存不当,容易被氧化变质,为了检验所得产品是否变质,技术人员进行了以下操作:取少量产品(绿矾)置于试管中,加水溶解,向溶液中加入
您最近一年使用:0次
名校
6 . 工业锅炉内壁的水垢,不仅浪费燃料,而且容易引发安全隐患。某碳素钢锅炉水垢(主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等)碱煮法清除的流程如下:
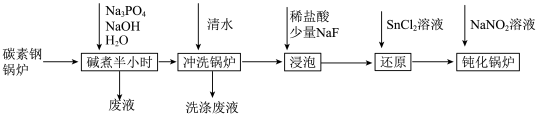
已知:20℃时几种难溶物的溶度积常数如下表(单位省略):
回答下列问题:
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式______________________ 。
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是______________________ ;
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为______________________ 。
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为_________________________________ ;
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到______________________ (填现象),则保护膜致密性欠佳。
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为______________________ 。

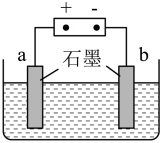
(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为______________________ 。

已知:20℃时几种难溶物的溶度积常数如下表(单位省略):
| 难溶物 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 | Ca3(PO4)2 |
| Ksp | 2.8×10-9 | 7.1×10-5 | 5.6×10-12 | 6.8×10-6 | 2.1×10-33 |
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为

(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为

您最近一年使用:0次
2019-03-06更新
|
1212次组卷
|
3卷引用:【市级联考】福建省龙岩市2019届高三下学期教学质量检查理科综合化学试题
7 . 新型材料纳米α-Fe粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等。
(1)甲同学用下左图所示装置进行α-Fe粉与水蒸气的反应。

Fe粉与水蒸气反应的化学反应方程式为__________________ ;
证明实验中有氢气产生的现象是_________________ 。
(2)已知不同温度下,α—Fe粉与水蒸气反应的固体产物不同:温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4。乙同学用上右图所示装置进行α-Fe粉与水蒸气的反应并验证产物。
①试管a中的物质是__________________ 。
②乙同学为探究实验结束后试管内的 固体物质成分,进行了下列实验:
以上实验现象能否判断固体物质中Fe3O4的存在___________ ( 填“存在”或“不存在”或“不能确定”),主要原因 是_______________ (用离子方程式表示)。
(1)甲同学用下左图所示装置进行α-Fe粉与水蒸气的反应。

Fe粉与水蒸气反应的化学反应方程式为
证明实验中有氢气产生的现象是
(2)已知不同温度下,α—Fe粉与水蒸气反应的固体产物不同:温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4。乙同学用上右图所示装置进行α-Fe粉与水蒸气的反应并验证产物。
①试管a中的物质是
②乙同学为探究实验结束后
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入适量盐酸,微热加速反应的进行 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
Ⅱ | 向实验I中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
您最近一年使用:0次
8 . LiFePO4可作为新型锂离子电池的正极材料。以精钛铁矿(主要成分为FeTiO3、Fe2O3及少量CuO、SiO2杂质)为主要原料生产TiOSO4,同时得到的绿矾(FeSO4·7H2O)与磷酸和LiOH反应可制备LiFePO4,制备流程如图所示:

请回答下列问题:
(1)反应之前先将矿石粉碎的目的是_____ 。
(2)酸溶时钛酸亚铁(FeTiO3)与硫酸反应的化学方程式为_______ 。
(3)①还原步骤中,加过量铁屑,其目的是_______ 。
②滤渣成分的化学式是______
(4)滤渣中的铜提纯后可用于制取Cu2O,工业制取Cu2O的电解池示意图如图,总反应为:2Cu+H2O Cu2O+H2↑。则:
Cu2O+H2↑。则:

①该装置中铜电极应连接直流电源的______ 极。
②石墨电极的电极反应式为_____ 。
③当有0.1molCu2O生成时电路中转移_____ mol电子。

请回答下列问题:
(1)反应之前先将矿石粉碎的目的是
(2)酸溶时钛酸亚铁(FeTiO3)与硫酸反应的化学方程式为
(3)①还原步骤中,加过量铁屑,其目的是
②滤渣成分的化学式是
(4)滤渣中的铜提纯后可用于制取Cu2O,工业制取Cu2O的电解池示意图如图,总反应为:2Cu+H2O
 Cu2O+H2↑。则:
Cu2O+H2↑。则:
①该装置中铜电极应连接直流电源的
②石墨电极的电极反应式为
③当有0.1molCu2O生成时电路中转移
您最近一年使用:0次
9 . 聚合硫酸铁又称聚铁,化学式[Fe2(OH)n(SO4)3-0.5n]n,广泛用于污水处理,实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、 SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
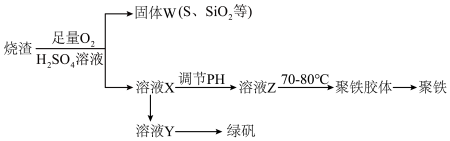
(1)验证固体W焙烧后产生的气体含有SO2的方法是_____________ 。
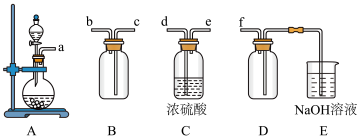
(2)实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口,顺序为a→_____ →_____ →_____ →_____ →f。装置D的作用是_________ ,装置E中NaOH溶液的作用是________________ 。
(3)制备绿矾时,向溶液X中加入过量_________ ,充分反应后,经_________ 操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为________ 。
若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_____________________ 。

(1)验证固体W焙烧后产生的气体含有SO2的方法是
(2)实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口,顺序为a→

(3)制备绿矾时,向溶液X中加入过量
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为
若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏
您最近一年使用:0次
2019-01-30更新
|
1020次组卷
|
5卷引用:2010年普通高等学校招生全国统一考试理综化学部分(山东卷)
2010年普通高等学校招生全国统一考试理综化学部分(山东卷)2010年高考化学试题分项专题十二 非金属元素及其化合物2010年高考化学试题分项专题十五 化学实验(已下线)2010-2011学年浙江省瑞安中学高二下学期期中考试化学试卷(已下线)2013届福建省清流一中高三第三阶段考试化学试卷



