2019高三·全国·专题练习
1 . 向Cu、Fe和Fe2O3的混合物中加入稀硫酸发生反应。下列说法正确的是( )
| A.反应后溶液可能显中性 |
| B.反应停止后一定有固体剩余 |
| C.反应过程中一定有氧化还原反应发生 |
| D.若只有Cu剩余,向溶液中滴入铁氰化钾溶液不会产生蓝色沉淀 |
您最近一年使用:0次
名校
2 . 某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究。完成下列空格。
①提出假设:
假设1:只存在Fe2O3;假设2:_________ ;假设3:既存在Fe2O3也存在Cu2O。
②查找资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
③实验方案设计与分析:
方案一:步骤一:取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体。由此可得出假设____ 不成立,写出产生上述气体的化学方程式___________________ 。
步骤二:取少量步骤一溶液置于试管中滴加_______ ,振荡,若________ ,则说明假设3成立。
方案二:
取少量样品于烧杯中,加入过量稀硫酸,若固体全部溶解,说明假设_______ 不成立。
方案三:
同学们设计了如下实验方案测定该样品中Fe2O3的质量分数(装置气密性良好,假设样品完全反应):
步骤一:取样品并称量该样品的质量为m1;
步骤二:测出反应前广口瓶和瓶内物质总质量m2;
步骤三:测出反应后广口瓶和瓶内物质总质量m3;
步骤四:计算得出矿物样品中Fe2O3的质量分数。
讨论分析:该实验方案________ (填“能”或“不能”)测出矿物中Fe2O3的质量分数。不改变装置和药品,通过计算得出矿物中Fe2O3的质量分数,你还可以通过测定_______ 。若测得m1为3.04g,m3=m2+1.76g,则原样品中Fe2O3的质量分数为_____ (结果保留四位有效数字)。
①提出假设:
假设1:只存在Fe2O3;假设2:
②查找资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
③实验方案设计与分析:
方案一:步骤一:取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体。由此可得出假设
步骤二:取少量步骤一溶液置于试管中滴加
方案二:
取少量样品于烧杯中,加入过量稀硫酸,若固体全部溶解,说明假设
方案三:

同学们设计了如下实验方案测定该样品中Fe2O3的质量分数(装置气密性良好,假设样品完全反应):
步骤一:取样品并称量该样品的质量为m1;
步骤二:测出反应前广口瓶和瓶内物质总质量m2;
步骤三:测出反应后广口瓶和瓶内物质总质量m3;
步骤四:计算得出矿物样品中Fe2O3的质量分数。
讨论分析:该实验方案
您最近一年使用:0次
2017-03-11更新
|
696次组卷
|
2卷引用:四川省泸县第四中学2020届高三上学期期末考试理综化学试题
名校
解题方法
3 . 三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设 l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是______________________ 。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?__________ 。简述你的理由_____________ .
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,则其质量比为_________ ,写出其中发生的氧化还原反应的离子方程式____________________________ 。探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg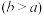 ,则混合物中Cu2O的质量分数为
,则混合物中Cu2O的质量分数为___________ 。
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设 l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,则其质量比为
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg
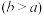 ,则混合物中Cu2O的质量分数为
,则混合物中Cu2O的质量分数为
您最近一年使用:0次
2016-12-09更新
|
321次组卷
|
3卷引用:2016届四川省宜宾三中高三上学期第一次月考化学试卷1
4 . Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下用足量CO还原,得到金属混合物4.82g,将生成的CO2气体用足量的澄清石灰水吸收后,产生l0.00g白色沉淀,则a 的数值为
| A.4.92 | B.6.42 | C.7.18 | D.14.82 |
您最近一年使用:0次
2016-12-09更新
|
190次组卷
|
3卷引用:2015届四川省成都郫县高三第二次阶诊断性考试理综化学试卷
2010·四川成都·一模
解题方法
5 . 饱和盐溶液W的电解产物发生下列系列反应。图中的每一方格表示有关的一种主要反应物或生成物(反应中加入或生成的水以及生成的其它产物已略去),其中A、B、C、D、E在常温下均为高中化学中常见气态物质,X和K是中学常见的金属单质,氧化物Y是一种比较好的耐火材料。



回答下列问题:


(1)W的名称是_______________ ,G的俗名是________________ 。
(2)A分子的空间构型是____________________ ,键角是_______ 。
(3)反应(3)的化学方程式是______________ 。反应(4)的化学方程式是__________ 。
(4)饱和盐溶液W电解的离子方程式是________________________ 。
(5)已知C的燃烧热为285.8kJ/mol。试写出C完全燃烧生成液态物质的热化学方程式__________________________ 。




回答下列问题:



(1)W的名称是
(2)A分子的空间构型是
(3)反应(3)的化学方程式是
(4)饱和盐溶液W电解的离子方程式是
(5)已知C的燃烧热为285.8kJ/mol。试写出C完全燃烧生成液态物质的热化学方程式
您最近一年使用:0次
2010·四川成都·一模
解题方法
6 . 已知D、M、H是常见的非金属单质,其中M是无色气体,H是有色气体,J是一种金属单质(其同族的某种元素是形成化合物种类最多的元素),A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,B与C反应时,每生成1molH同时消耗4molB和1molC,K只知含有CO或CO2中的一种或两种。它们关系如图:

(1)写出下列物质的化学式: A______________ D_______________
(2)写出下列反应的化学方程式:
②_________________________________________
⑤___________________________________
(3)由金属氧化物A和C得到其相应的金属,在冶金工业上一般可用______ 方法(填序号)
①热分解法 ②热还原法 ③电解法
其中从A得到其相应金属也可用铝热法,若反应中1molA参加反应,转移电子的物质的量为______________________
(4)用C、J作电极,与硫酸构成如图所示电池,正极的电极反应为______________ ,当反应转移1mol电子时,负极质量增加_________ g。


(1)写出下列物质的化学式: A
(2)写出下列反应的化学方程式:
②
⑤
(3)由金属氧化物A和C得到其相应的金属,在冶金工业上一般可用
①热分解法 ②热还原法 ③电解法
其中从A得到其相应金属也可用铝热法,若反应中1molA参加反应,转移电子的物质的量为
(4)用C、J作电极,与硫酸构成如图所示电池,正极的电极反应为

您最近一年使用:0次



