解题方法
1 . 现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
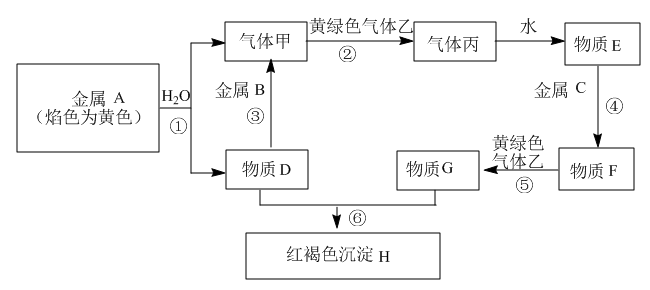
请回答下列问题:
(1)写出下列物质的化学式:丙_________ 、乙_________ 。
(2)图中反应①②③④⑤⑥中属于氧化还原反应的有:_____________________ ,属于置换反应反应的有:_______________ 。
(3)写出反应⑤的离子方程式:_____________________ ;
(4)写出反应①的化学方程式_______________________________ ,当得到标准状况 下的甲气体2.24L,则参加反应的金属A____________ g。

请回答下列问题:
(1)写出下列物质的化学式:丙
(2)图中反应①②③④⑤⑥中属于氧化还原反应的有:
(3)写出反应⑤的离子方程式:
(4)写出反应①的化学方程式
您最近一年使用:0次
2 . 铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医疗上常用作补血剂。某课外活动小组为测定该补血剂中铁元素的含量,设计如下实验。

(1)实验时用18.4 mol·L-1的浓硫酸配制100mL1.0 mol·L-1的硫酸溶液,所需浓硫酸的体积为______ mL(保留一位小数)。
(2)步骤①过滤后的滤液中加入氯水后发生反应的离子方程式为__________________________ 。
(3)向滤液中直接加入过量氨水时,生成的白色沉淀迅速变为灰绿色,最后变为红褐色,沉淀颜色变化的原因用化学方程式表示为_______________________ 。
(4)该补血剂中铁元素的质量分数为____________ ,若步骤③加入氨水的量不足,则实验结果_____ (填“偏大”、“偏小”、“无影响”)
(5)科学研究表明服用含硫酸亚铁的补血剂时,同时服用维生素C有利于铁元素的吸收。则维生素C在其过程中的作用是_________________ 。

(1)实验时用18.4 mol·L-1的浓硫酸配制100mL1.0 mol·L-1的硫酸溶液,所需浓硫酸的体积为
(2)步骤①过滤后的滤液中加入氯水后发生反应的离子方程式为
(3)向滤液中直接加入过量氨水时,生成的白色沉淀迅速变为灰绿色,最后变为红褐色,沉淀颜色变化的原因用化学方程式表示为
(4)该补血剂中铁元素的质量分数为
(5)科学研究表明服用含硫酸亚铁的补血剂时,同时服用维生素C有利于铁元素的吸收。则维生素C在其过程中的作用是
您最近一年使用:0次
解题方法
3 . 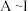 分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示
分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示 部分反应物、生成物没有列出
部分反应物、生成物没有列出 ,且A、B、C、D、E、F六种物质中均含同一种元素.
,且A、B、C、D、E、F六种物质中均含同一种元素.
请填写下列空白:
 、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置为
、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置为 ______ .
 反应
反应 阳极的电极反应式为
阳极的电极反应式为 ______ ,反应 的离子方程式为
的离子方程式为 ______ ,反应 的化学方程式为
的化学方程式为 ______ .
 实验室配制C溶液时通常要加入少量的
实验室配制C溶液时通常要加入少量的 ______ ;将少量D的浓溶液滴入沸水中得到的液体呈 ______ 色,再逐滴滴加盐酸时,产生的现象是 ______ ;
 反应
反应 中每生成3mol A,转移电子的物质的量为
中每生成3mol A,转移电子的物质的量为 ______ .
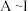 分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示
分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示 部分反应物、生成物没有列出
部分反应物、生成物没有列出 ,且A、B、C、D、E、F六种物质中均含同一种元素.
,且A、B、C、D、E、F六种物质中均含同一种元素. 
请填写下列空白:
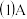 、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置为
、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置为  反应
反应 阳极的电极反应式为
阳极的电极反应式为  的离子方程式为
的离子方程式为  的化学方程式为
的化学方程式为  实验室配制C溶液时通常要加入少量的
实验室配制C溶液时通常要加入少量的  反应
反应 中每生成3mol A,转移电子的物质的量为
中每生成3mol A,转移电子的物质的量为
您最近一年使用:0次
19-20高三上·江西南昌·阶段练习
名校
解题方法
4 . X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素,有关信息如表:
(1)W在周期表的位置为________ 。 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程为
在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程为________ 。
(2)X的简单阴离子的结构示意为________ ,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为________ 。
(3)工业上制备Z的单质的化学反应方程式为________ ,锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH溶液反应但在有 存在时可与NaOH溶液反应生成锗酸盐,其方程式为
存在时可与NaOH溶液反应生成锗酸盐,其方程式为________ 。
| 原子或分子相关信息 | 单质及其化合物相关信息 | |
| X |  分子是由粗Z提纯Z的中间产物 分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| w | w原子的最外层电子数小于4 | w的常见化合价有+3、+2, 稀溶液呈黄色 稀溶液呈黄色 |
(1)W在周期表的位置为
 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程为
在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程为(2)X的简单阴离子的结构示意为
(3)工业上制备Z的单质的化学反应方程式为
 存在时可与NaOH溶液反应生成锗酸盐,其方程式为
存在时可与NaOH溶液反应生成锗酸盐,其方程式为
您最近一年使用:0次
5 . 某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物或生成物未列出),其中E为白色沉淀,I为红褐色沉淀。
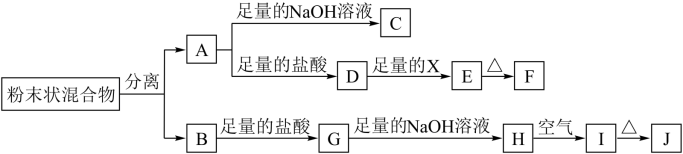
(1)写出下列物质的化学式:F___ ,G___ 。
(2)分离粉末状混合物最简单的方法是___ 。
(3)D→E转化中,加入足量的X,试剂X可能是___ ,写出其离子方程式___ 。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)A→C的离子方程式___ 。
(5)检验G溶液中的阳离子的方法___ 。

(1)写出下列物质的化学式:F
(2)分离粉末状混合物最简单的方法是
(3)D→E转化中,加入足量的X,试剂X可能是
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)A→C的离子方程式
(5)检验G溶液中的阳离子的方法
您最近一年使用:0次
名校
解题方法
6 . 已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。

(1)物质A的化学式为___ ,F化学式为___ ;
(2)B和R在溶液中反应生成F的离子方程式为___ ;
(3)H在潮湿空气中变成M的实验现象是___ ,化学方程式为___ 。
(4)A和水反应生成B和C的离子方程式为___ ,由此反应可知A有作为___ 的用途。
(5)M投入盐酸中的离子方程式___ 。

(1)物质A的化学式为
(2)B和R在溶液中反应生成F的离子方程式为
(3)H在潮湿空气中变成M的实验现象是
(4)A和水反应生成B和C的离子方程式为
(5)M投入盐酸中的离子方程式
您最近一年使用:0次
2019-11-15更新
|
635次组卷
|
5卷引用:安徽省蚌埠市田家炳中学、五中2020届高三上学期期中考试化学试题
7 . 用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入__ 。
(2)除去蒸馏水中溶解的O2常采用___ 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是__ 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。

(1)在试管I里加入的试剂是___ 。
(2)在试管Ⅱ里加入的试剂是___ 。
(3)为了制得白色Fe(OH)2沉淀,在试管I和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是:先___ ,后__ 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是__ 。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入
(2)除去蒸馏水中溶解的O2常采用
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。

(1)在试管I里加入的试剂是
(2)在试管Ⅱ里加入的试剂是
(3)为了制得白色Fe(OH)2沉淀,在试管I和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是:先
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
您最近一年使用:0次
解题方法
8 . 已知有以下物质相互转化

试回答:
(1)写出下列物质的化学式:B的化学式_____________ ,C的化学式________________ ,D的化学式_____________ ,H的化学式________________ 。
(2)写出由E转变成F的化学方程式:_______________________________________ 。
(3)写出用KSCN鉴别G溶液的离子方程式__________________________________ ;向G溶液加入A的有关离子方程式____________________________________________ 。

试回答:
(1)写出下列物质的化学式:B的化学式
(2)写出由E转变成F的化学方程式:
(3)写出用KSCN鉴别G溶液的离子方程式
您最近一年使用:0次
9 . 某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
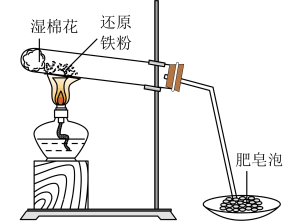
请回答下列问题:
(1)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管中固体物质的成分是(只有一个选项符合题意)_________ ;若溶液未变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意)________ 。
A.一定有Fe3O4,可能有Fe B.只有Fe(OH)3
C.一定有Fe3O4和Fe D.一定有Fe(OH)3,可能有Fe
E.只有Fe3O4
(2)该同学按上述实验方案进行了实验,结果溶液未变红色,该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按如图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象。
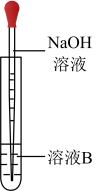
请写出与上述现象相关的反应的化学方程式_________________ 、________________ 。
(3)一段时间后,该同学发现(2)中未变红的溶液变成红色,说明Fe2+ 具有______ 性。由此可知,实验室中含Fe2+的盐溶液需现用现配制的原因是_________ ,并且配制[含Fe2+的盐溶液时应加入少量______ 。

(4)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用如图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是____________ 。反应开始时,打开止水夹的目的是__________________ ;一段时间后,关闭止水夹,在试管_______ (填“A”或“B”)中观察到白色的沉淀。
(5)同学们在学习了铁的性质后知道Fe3+和CO32-不能大量共存的原理,那么Fe2+和CO32-是否发生相似的反应呢?某学习小组查阅“部分酸碱盐溶解性表”,在“部分酸碱盐溶解性表”中存在“碳酸亚铁”。
他们设计实验探究碳酸亚铁的性质。实验如下将一定量新制备的硫酸亚铁溶液和过量的碳酸氢铵溶液混合产生大量沉淀和气体。放置一段时间未见沉淀有明显变化。
①试写出反应离子方程式:_________________________ 。
探究碳酸亚铁的热稳定性(加热仪器省略)
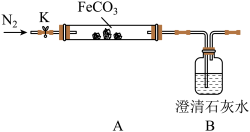
连接仪器、装药品。打开K,先通入一段时间氮气,然后,用酒精喷灯在A处加热玻璃管,观察B瓶溶液变浑浊。待固体分解完后,继续通入氮气至玻璃管冷却。
②先通入氮气的目的是____________ 。B瓶现象能说明_____________ 。
③停止加热之前,是否拆开A、B之间橡胶管?答:__________ ;理由是______________ 。
④若不通入氮气直接加热分解则分解的固体产物可能是_______ ;_______ ;
_________ 理由是_______

请回答下列问题:
(1)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管中固体物质的成分是(只有一个选项符合题意)
A.一定有Fe3O4,可能有Fe B.只有Fe(OH)3
C.一定有Fe3O4和Fe D.一定有Fe(OH)3,可能有Fe
E.只有Fe3O4
(2)该同学按上述实验方案进行了实验,结果溶液未变红色,该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按如图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象。

请写出与上述现象相关的反应的化学方程式
(3)一段时间后,该同学发现(2)中未变红的溶液变成红色,说明Fe2+ 具有

(4)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用如图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是
(5)同学们在学习了铁的性质后知道Fe3+和CO32-不能大量共存的原理,那么Fe2+和CO32-是否发生相似的反应呢?某学习小组查阅“部分酸碱盐溶解性表”,在“部分酸碱盐溶解性表”中存在“碳酸亚铁”。
他们设计实验探究碳酸亚铁的性质。实验如下将一定量新制备的硫酸亚铁溶液和过量的碳酸氢铵溶液混合产生大量沉淀和气体。放置一段时间未见沉淀有明显变化。
①试写出反应离子方程式:
探究碳酸亚铁的热稳定性(加热仪器省略)

连接仪器、装药品。打开K,先通入一段时间氮气,然后,用酒精喷灯在A处加热玻璃管,观察B瓶溶液变浑浊。待固体分解完后,继续通入氮气至玻璃管冷却。
②先通入氮气的目的是
③停止加热之前,是否拆开A、B之间橡胶管?答:
④若不通入氮气直接加热分解则分解的固体产物可能是
您最近一年使用:0次
18-19高一上·内蒙古赤峰·期末
名校
10 . 下列各组反应,最终一定能得到白色沉淀的是
| A.向NaAlO2溶液中通入HCl气体 |
| B.向Ba(OH)2溶液中通入过量CO2气体 |
| C.向FeCl2溶液中加入过量NaOH溶液 |
| D.向Al2(SO4)3溶液中加入过量NH3·H2O |
您最近一年使用:0次
2019-01-24更新
|
135次组卷
|
3卷引用:内蒙古赤峰市宁城县2018-2019学年高一上学期期末考试化学试题
(已下线)内蒙古赤峰市宁城县2018-2019学年高一上学期期末考试化学试题黑龙江省绥化市第一中学2020-2021学年高一上学期期末考试化学试题重庆市缙云教育联盟2023-2024学年高一上学期1月期末化学试题



