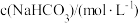名校
解题方法
1 .  具有较强的还原性,新制的白色
具有较强的还原性,新制的白色 会逐渐转变为灰绿色,使学生误认为氢氧化亚铁的颜色是灰绿色。为能较长时间观察到白色
会逐渐转变为灰绿色,使学生误认为氢氧化亚铁的颜色是灰绿色。为能较长时间观察到白色 ,某实验小组做了如下探究实验。
,某实验小组做了如下探究实验。
(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用蒸馏水的水分子空间结构为__________ ;使用的 晶体类型为
晶体类型为__________ 。
(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的 也仅能存在几分钟,其原因可能是
也仅能存在几分钟,其原因可能是__________ 。
(3)甲同学按如图a所示操作制备 (溶液均用煮沸过的蒸馏水配制)。挤入少量
(溶液均用煮沸过的蒸馏水配制)。挤入少量 溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因:
溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因:__________ 。
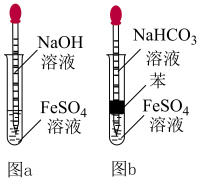
(4)乙同学经查阅资料后设计了如图 所示的装置(溶液均用煮沸过的蒸馏水配制),能较长时间观察到白色
所示的装置(溶液均用煮沸过的蒸馏水配制),能较长时间观察到白色 。
。
①该反应的原理为__________ (用离子方程式表示)。
②结合原理和装置特点分析能较长时间观察到白色 的原因:
的原因:__________ 。
(5)实验试剂最佳浓度探究:
采用不同浓度的试剂进行实验,记录如下。
(1)由以上实验可得到的规律是
①由以上实验可得到的规律是__________ 。
② 溶液的浓度为
溶液的浓度为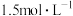 时,
时, 溶液的最佳浓度为
溶液的最佳浓度为__________ (填“1.0”“1.5”或“2.0”) 。
。
(6)实验创新:
延长 沉淀的稳定时间还可以采取的措施为
沉淀的稳定时间还可以采取的措施为__________ (任写一条)。
 具有较强的还原性,新制的白色
具有较强的还原性,新制的白色 会逐渐转变为灰绿色,使学生误认为氢氧化亚铁的颜色是灰绿色。为能较长时间观察到白色
会逐渐转变为灰绿色,使学生误认为氢氧化亚铁的颜色是灰绿色。为能较长时间观察到白色 ,某实验小组做了如下探究实验。
,某实验小组做了如下探究实验。(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用蒸馏水的水分子空间结构为
 晶体类型为
晶体类型为(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的
 也仅能存在几分钟,其原因可能是
也仅能存在几分钟,其原因可能是(3)甲同学按如图a所示操作制备
 (溶液均用煮沸过的蒸馏水配制)。挤入少量
(溶液均用煮沸过的蒸馏水配制)。挤入少量 溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因:
溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因:
(4)乙同学经查阅资料后设计了如图
 所示的装置(溶液均用煮沸过的蒸馏水配制),能较长时间观察到白色
所示的装置(溶液均用煮沸过的蒸馏水配制),能较长时间观察到白色 。
。①该反应的原理为
②结合原理和装置特点分析能较长时间观察到白色
 的原因:
的原因:(5)实验试剂最佳浓度探究:
采用不同浓度的试剂进行实验,记录如下。
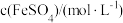 | 1.0 | 1.5 | 2.0 | |
| 1.0 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速 |
| 稳定时间 | 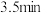 | 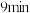 | 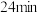 | |
| 1.5 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速 |
| 稳定时间 | 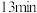 | 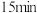 | 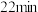 | |
| 2.0 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率加快 | 常温下无现象,加热后产生白色沉淀 |
| 稳定时间 |  | 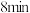 |  | |
①由以上实验可得到的规律是
②
 溶液的浓度为
溶液的浓度为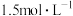 时,
时, 溶液的最佳浓度为
溶液的最佳浓度为 。
。(6)实验创新:
延长
 沉淀的稳定时间还可以采取的措施为
沉淀的稳定时间还可以采取的措施为
您最近半年使用:0次
名校
2 . 纳米Fe3O4在磁流体、催化剂、医学等领域具有广阔的应用前景。氧化共沉淀制备纳米Fe3O4的方法如下:
Ⅰ.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到FeOOH红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生白色沉淀,该反应的离子方程式是___________ 。
②该白色沉淀置于空气中能观察的现象是___________ 。
③上述反应完成后,测得a值与FeOOH产率及其生成后溶液pH的关系,结果如下:
用离子方程式解释FeOOH生成后溶液pH下降的原因:___________ 。
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeOOH向Fe2O3的转化;
ii.溶液中存在少量Fe2+,导致FeOOH向Fe2O3的转化。
①经分析,假设i不成立的实验依据是___________ 。
②其他条件相同时,向FeOOH浊液中加入不同浓度Fe2+,30min后测定物质的组成,结果如下:
以上结果表明:___________ 。
③a=7和a=9时,FeOOH产率差异很大的原因是___________ 。
Ⅱ.Fe2+和Fe3+共沉淀:向FeOOH红棕色悬浊液中同时加入FeSO4溶液和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3O4。
(3)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是___________ 。
②已知N=n(FeOOH)/n(Fe2+),其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如下图所示:
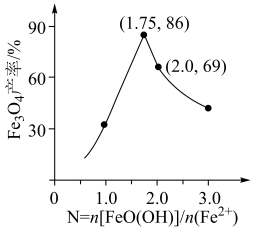
经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是___________ 。
(4)测量制得的纳米Fe3O4中n(Fe3+)/n(Fe2+):取ag样品,加入足量盐酸使之完全溶解,加入SnCl2将Fe3+还原为Fe2+;除去过量SnCl2后,用c1mol/LK2Cr2O7标准溶液滴定(还原产物为Cr3+),消耗K2Cr2O7溶液的体积为v1mL,另取ag样品,加入足量稀硫酸使之完全溶解,用c2mol/LKMnO4标准溶液滴定至终点,消耗KMnO4溶液的体积为v2mL,则样品中n(Fe3+)/n(Fe2+)为___________ 。
Ⅰ.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到FeOOH红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生白色沉淀,该反应的离子方程式是
②该白色沉淀置于空气中能观察的现象是
③上述反应完成后,测得a值与FeOOH产率及其生成后溶液pH的关系,结果如下:
| a | 7.0 | 8.0 | 9.0 |
| FeO(OH)的产率 | <50% | 95% | >95% |
| FeO(OH)生成后的pH | 接近4 | 接近4 | 接近4 |
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeOOH向Fe2O3的转化;
ii.溶液中存在少量Fe2+,导致FeOOH向Fe2O3的转化。
①经分析,假设i不成立的实验依据是
②其他条件相同时,向FeOOH浊液中加入不同浓度Fe2+,30min后测定物质的组成,结果如下:
| c(Fe2+)/mol/L | FeO(OH)百分含量/% | Fe2O3百分含量/% |
| 0.00 | 100 | 0 |
| 0.01 | 40 | 60 |
| 0.02 | 0 | 100 |
③a=7和a=9时,FeOOH产率差异很大的原因是
Ⅱ.Fe2+和Fe3+共沉淀:向FeOOH红棕色悬浊液中同时加入FeSO4溶液和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3O4。
(3)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是
②已知N=n(FeOOH)/n(Fe2+),其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如下图所示:

经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是
(4)测量制得的纳米Fe3O4中n(Fe3+)/n(Fe2+):取ag样品,加入足量盐酸使之完全溶解,加入SnCl2将Fe3+还原为Fe2+;除去过量SnCl2后,用c1mol/LK2Cr2O7标准溶液滴定(还原产物为Cr3+),消耗K2Cr2O7溶液的体积为v1mL,另取ag样品,加入足量稀硫酸使之完全溶解,用c2mol/LKMnO4标准溶液滴定至终点,消耗KMnO4溶液的体积为v2mL,则样品中n(Fe3+)/n(Fe2+)为
您最近半年使用:0次
3 . 现有中学化学常见的金属单质A、B、C和气体甲、乙、丙、丁以及物质D、E、F、G、H、X,其中气体乙为黄绿色气体,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
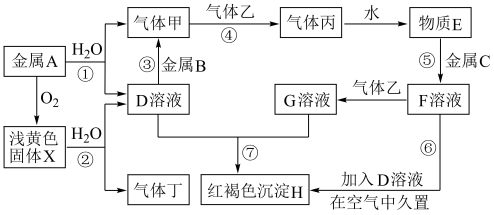
请根据以上信息完成下列各题:
(1)写出反应①的离子方程式:___________ 。
(2)写出反应②的化学方程式:___________ ,该反应的氧化剂是_____ 。
(3)写出反应③的化学方程式:___________ 。
(4)写出反应⑥的化学方程式:___________ 。

请根据以上信息完成下列各题:
(1)写出反应①的离子方程式:
(2)写出反应②的化学方程式:
(3)写出反应③的化学方程式:
(4)写出反应⑥的化学方程式:
您最近半年使用:0次
4 . 以下流程中涉及的物质均为中学化学常见物质,其中白色固体A为一种常见的钠盐,混合气体C可使澄清石灰水变浑浊,白色固体F在空气中易迅速变为灰绿色,黑色固体H有磁性。

请回答下列问题:
(1)白色固体E的化学式为___________ ;黑色固体H的化学式为___________ ;无色气体I的化学式为___________ 。
(2)无色混合气体C的组成为___________ 。
(3)白色固体A与少量澄清石灰水反应的离子方程式为___________ 。
(4)白色固体F无氧常温条件下分解的化学方程式为___________ 。
(5)请设计实验验证黑色固体H中金属元素的化合价___________ 。

请回答下列问题:
(1)白色固体E的化学式为
(2)无色混合气体C的组成为
(3)白色固体A与少量澄清石灰水反应的离子方程式为
(4)白色固体F无氧常温条件下分解的化学方程式为
(5)请设计实验验证黑色固体H中金属元素的化合价
您最近半年使用:0次
解题方法
5 . 某工厂酸性废液中含有 、
、 、
、 、
、 、
、 ,以该废液为原料制备
,以该废液为原料制备 的工艺流程如下(部分操作和反应条件略):
的工艺流程如下(部分操作和反应条件略):
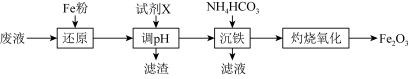
已知:加入试剂X调节pH使 生成沉淀。
生成沉淀。
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:_____________ 、_________________ 。
(2)若加入Fe粉过量,取少量调节pH过滤后得到的滤液,加入NaOH溶液的现象为_____________ ,请写出沉淀颜色发生变化的化学方程式:_________________________ 。
(3)“沉铁”过程中有 沉淀和气体生成,写出该反应的离子方程式:
沉淀和气体生成,写出该反应的离子方程式:_________________ ; 在空气中经“灼烧氧化”生成
在空气中经“灼烧氧化”生成 ,试写出“灼烧氧化”的化学方程式:
,试写出“灼烧氧化”的化学方程式:____________________ 。
 、
、 、
、 、
、 、
、 ,以该废液为原料制备
,以该废液为原料制备 的工艺流程如下(部分操作和反应条件略):
的工艺流程如下(部分操作和反应条件略):
已知:加入试剂X调节pH使
 生成沉淀。
生成沉淀。回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:
(2)若加入Fe粉过量,取少量调节pH过滤后得到的滤液,加入NaOH溶液的现象为
(3)“沉铁”过程中有
 沉淀和气体生成,写出该反应的离子方程式:
沉淀和气体生成,写出该反应的离子方程式: 在空气中经“灼烧氧化”生成
在空气中经“灼烧氧化”生成 ,试写出“灼烧氧化”的化学方程式:
,试写出“灼烧氧化”的化学方程式:
您最近半年使用:0次
6 . 铁及其化合物在日常生活中有广泛应用。
(1)向硫酸亚铁溶液中滴加氢氧化钠溶液,生成白色沉淀,迅速___________ (补全实验现象),化学方程式为___________ 。
(2)绿矾( )是补血剂的原料,易变质。设计实验证明绿矾未
)是补血剂的原料,易变质。设计实验证明绿矾未完全 变质________ 。
(3)利用绿矾制备还原铁粉的工业流程如下:
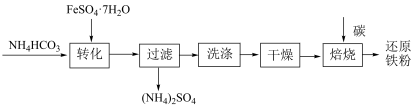
①“转化”是在水溶液中进行,产生白色沉淀和无色无味气体。写出反应的离子方程式___________ 。
②干燥过程主要是为了脱去游离水和结晶水,过程中会有少量 在空气中被氧化为
在空气中被氧化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(4)某同学在:实验室进行铁盐与亚铁盐相互转化的实验:
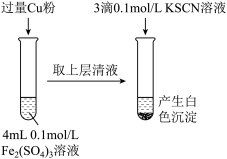
实验 :将
:将 转化为
转化为
① 与
与 粉发生反应的离子方程式为
粉发生反应的离子方程式为___________ 。
②探究白色沉淀产生的原因,请填写实验方案:
查阅资料:i. 的依学性质与
的依学性质与 相似;ii.
相似;ii.
 与
与 反应的离子方程式为
反应的离子方程式为____________________ 。
实验II:将 转化为
转化为
③用离子方程式表示溶液变红的原因是___________ 、 ,为探究红色消失的原因,继续查阅资料:SCN中C为+4价,N为-3价,可被强氧化剂氧化为CO2、N2和
,为探究红色消失的原因,继续查阅资料:SCN中C为+4价,N为-3价,可被强氧化剂氧化为CO2、N2和 ,用离子方程式表示红色消失的原因为:
,用离子方程式表示红色消失的原因为:___________ 。
(1)向硫酸亚铁溶液中滴加氢氧化钠溶液,生成白色沉淀,迅速
(2)绿矾(
 )是补血剂的原料,易变质。设计实验证明绿矾未
)是补血剂的原料,易变质。设计实验证明绿矾未(3)利用绿矾制备还原铁粉的工业流程如下:

①“转化”是在水溶液中进行,产生白色沉淀和无色无味气体。写出反应的离子方程式
②干燥过程主要是为了脱去游离水和结晶水,过程中会有少量
 在空气中被氧化为
在空气中被氧化为 ,该反应的化学方程式为
,该反应的化学方程式为(4)某同学在:实验室进行铁盐与亚铁盐相互转化的实验:

实验
 :将
:将 转化为
转化为
①
 与
与 粉发生反应的离子方程式为
粉发生反应的离子方程式为②探究白色沉淀产生的原因,请填写实验方案:
查阅资料:i.
 的依学性质与
的依学性质与 相似;ii.
相似;ii.
 与
与 反应的离子方程式为
反应的离子方程式为实验II:将
 转化为
转化为
| 实验方案 | 现象 |
| 向0.1mol/LFeCl2溶液中加入一滴KSCN溶液;再通入氯气 | 溶液颜色无明显变化;溶液变红,一段时间后红色消失。 |
 ,为探究红色消失的原因,继续查阅资料:SCN中C为+4价,N为-3价,可被强氧化剂氧化为CO2、N2和
,为探究红色消失的原因,继续查阅资料:SCN中C为+4价,N为-3价,可被强氧化剂氧化为CO2、N2和 ,用离子方程式表示红色消失的原因为:
,用离子方程式表示红色消失的原因为:
您最近半年使用:0次
名校
解题方法
7 . 碳酸亚铁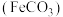 难溶于水,常用于制取铁或补血剂。一种
难溶于水,常用于制取铁或补血剂。一种 的制备装置如下图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得
的制备装置如下图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得 沉淀。
沉淀。
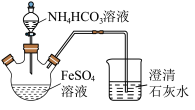
(1)恰好完全反应后,检验三颈烧瓶内溶液中阳离子的方法是___________ 。
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是___________ 。
(3) 在潮湿的空气中先转化为
在潮湿的空气中先转化为 ,最终变为
,最终变为 ,并进一步转化为
,并进一步转化为 。写出
。写出 在潮湿的空气中转化为
在潮湿的空气中转化为 的化学方程式:
的化学方程式:___________ 。
(4)某 固体被部分氧化,为测定其中
固体被部分氧化,为测定其中 的质量分数,现进行如下实验:称取
的质量分数,现进行如下实验:称取 固体样品,加足量盐酸充分溶解,将溶液稀释至
固体样品,加足量盐酸充分溶解,将溶液稀释至 。量取
。量取 该溶液,加入
该溶液,加入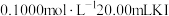 溶液,两者正好完全反应。已知实验过程中发生反应如下:
溶液,两者正好完全反应。已知实验过程中发生反应如下: 。计算
。计算 固体样品中
固体样品中 的质量分数,写出计算过程
的质量分数,写出计算过程___________ 。
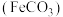 难溶于水,常用于制取铁或补血剂。一种
难溶于水,常用于制取铁或补血剂。一种 的制备装置如下图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得
的制备装置如下图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得 沉淀。
沉淀。
(1)恰好完全反应后,检验三颈烧瓶内溶液中阳离子的方法是
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是
(3)
 在潮湿的空气中先转化为
在潮湿的空气中先转化为 ,最终变为
,最终变为 ,并进一步转化为
,并进一步转化为 。写出
。写出 在潮湿的空气中转化为
在潮湿的空气中转化为 的化学方程式:
的化学方程式:(4)某
 固体被部分氧化,为测定其中
固体被部分氧化,为测定其中 的质量分数,现进行如下实验:称取
的质量分数,现进行如下实验:称取 固体样品,加足量盐酸充分溶解,将溶液稀释至
固体样品,加足量盐酸充分溶解,将溶液稀释至 。量取
。量取 该溶液,加入
该溶液,加入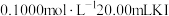 溶液,两者正好完全反应。已知实验过程中发生反应如下:
溶液,两者正好完全反应。已知实验过程中发生反应如下: 。计算
。计算 固体样品中
固体样品中 的质量分数,写出计算过程
的质量分数,写出计算过程
您最近半年使用:0次
解题方法
8 . 利用矿铁厂的废铁屑(主要成分为 ,含有沙土、油污、
,含有沙土、油污、 和
和 )制备磁性纳米
)制备磁性纳米 的流程如图:
的流程如图:
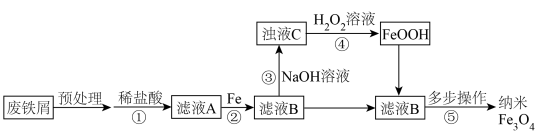
下列说法中错误的是
 ,含有沙土、油污、
,含有沙土、油污、 和
和 )制备磁性纳米
)制备磁性纳米 的流程如图:
的流程如图:
下列说法中错误的是
A.预处理时,需要使用 溶液,可将溶液进行适当升温 溶液,可将溶液进行适当升温 |
B.纳米 属于胶体,能发生丁达尔效应 属于胶体,能发生丁达尔效应 |
| C.滤液B中加入氢氧化钠溶液时,可观察到有白色沉淀生成,迅速转为灰绿色,最后转化为红褐色 |
D.步骤⑤发生反应的离子方程式为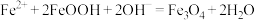 |
您最近半年使用:0次
2023-09-10更新
|
453次组卷
|
2卷引用:广东省清中、河中、北中、惠中、阳中、茂中等6校2023-2024学年高三上学期第一次联考化学试题
名校
解题方法
9 . A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体,B为黄绿色气体,C为无色气体;D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体,它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去):

(1)写出下列物质的化学式:D___________ ;X___________
(2)在反应①~⑦中,不属于氧化还原反应的是___________ (填序号)。
(3)往G溶液中加入NaOH溶液观察到的现象是___________
(4)反应⑦的化学方程式为___________ ,该反应中每消耗0.3mol的A,可转移电子___________ mol。
(5)反应③的离子方程式___________

(1)写出下列物质的化学式:D
(2)在反应①~⑦中,不属于氧化还原反应的是
(3)往G溶液中加入NaOH溶液观察到的现象是
(4)反应⑦的化学方程式为
(5)反应③的离子方程式
您最近半年使用:0次
2023-06-08更新
|
234次组卷
|
2卷引用:广东省南阳中学、清新一中、佛冈一中、连州中学、连 山中学五校2022-2023学年高一上学期12月联考化学试题
解题方法
10 . 草酸亚铁晶体(FeC2O4·2H2O)可作为制备电池正极材料磷酸铁锂的原料。以FeSO4溶液制备电池级草酸亚铁晶体的实验流程如下:

(1)“沉淀”步骤得到的混合体系不宜在空气中久置,其原因是(用化学方程式表示)________ 。
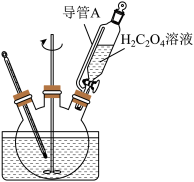
(2)“转化”在如图所示的装置中进行,导管A的作用是___________ 。
(3)检验“洗涤”完全的实验操作是___________ 。
(4)草酸亚铁晶体在空气中易氧化,检验草酸亚铁晶体是否氧化变质的实验操作是________ 。
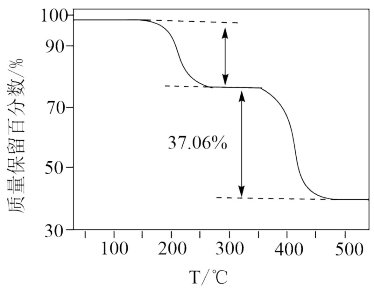
(5)在氩气中加热草酸亚铁晶体(FeC2O4∙2H2O),FeC2O4∙2H2O的质量变化曲线随温度升高出现两个失重“台阶”,如图所示。结合表格,计算第一阶段的质量损失率为___________ (保留4位有效数字),推断第二阶段产生气体的化学式为___________ 。(质量损失率=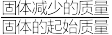 ×100%)
×100%)

(1)“沉淀”步骤得到的混合体系不宜在空气中久置,其原因是(用化学方程式表示)
(2)“转化”在如图所示的装置中进行,导管A的作用是

(3)检验“洗涤”完全的实验操作是
(4)草酸亚铁晶体在空气中易氧化,检验草酸亚铁晶体是否氧化变质的实验操作是
(5)在氩气中加热草酸亚铁晶体(FeC2O4∙2H2O),FeC2O4∙2H2O的质量变化曲线随温度升高出现两个失重“台阶”,如图所示。结合表格,计算第一阶段的质量损失率为
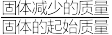 ×100%)
×100%)| 失重阶段 | 温度范围/℃ | 质量损失率% | 产物 |
| 第一阶段 | 室温~255 | __________ | FeC2O4 |
| 第二阶段 | 255-520 | 37.06 | Fe3O4 |

您最近半年使用:0次
2023-04-27更新
|
518次组卷
|
2卷引用:江苏省扬州市高邮市2022-2023学年高一下学期4月期中考试化学试题