解题方法
1 . 某实验小组在实验室进行Fe2+与Fe3+相互转化的实验。
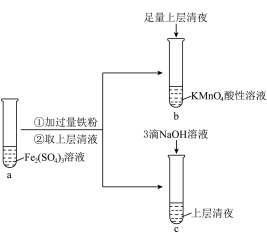
(1)向试管a中加入过量铁粉的离子方程式是___________ 。
(2)试管b中的实验现象是___________ 。
(3)试管c中产生白色沉淀,一段时间后部分沉淀变为红褐色。写出白色沉淀变为红褐色的化学方程式___________ 。
(4)实验小组为探究反应物浓度对Fe(OH)2制备效果的影响,以Fe(OH)2沉淀白色持续时间(t)为指标,t越大,实验效果越好。部分实验数据如下(w表示质量分数):
①实验i、ii、iii的目的是___________ 。
②小组同学通过实验得出结论:其他条件不变时,所用NaOH溶液的浓度越大,实验效果越好,推断的证据是___________ 。

(1)向试管a中加入过量铁粉的离子方程式是
(2)试管b中的实验现象是
(3)试管c中产生白色沉淀,一段时间后部分沉淀变为红褐色。写出白色沉淀变为红褐色的化学方程式
(4)实验小组为探究反应物浓度对Fe(OH)2制备效果的影响,以Fe(OH)2沉淀白色持续时间(t)为指标,t越大,实验效果越好。部分实验数据如下(w表示质量分数):
| 实验 | 序号 | w(FeSO4)/% | w(NaOH)/% | t/s |
 | i | 2.5 | 15 | 149 |
| ii | 5 | 15 | 138 | |
| iii | 10 | 15 | 99 | |
| iv | 5 | 25 | 142 | |
| v | 5 | 35 | 180 |
②小组同学通过实验得出结论:其他条件不变时,所用NaOH溶液的浓度越大,实验效果越好,推断的证据是
您最近半年使用:0次
名校
解题方法
2 . 部分含铁物质的类别与相应化合价关系如图所示。下列推断不合理 的是
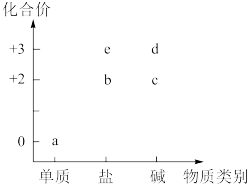

| A.可存在b→c→d→e→b的循环转化关系 | B.可将e加入浓碱液中制得d的胶体 |
| C.b既可被氧化,也可被还原 | D.可由化合反应制得d |
您最近半年使用:0次
2023-01-05更新
|
222次组卷
|
3卷引用:微专题(六) ——利用“价—类”二维图认识铁及其化合物的转化
微专题(六) ——利用“价—类”二维图认识铁及其化合物的转化天津市第九中学2022-2023学年高一 阶段性质量检测化学试题(已下线)专题07 铁及其化合物 金属材料-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)
名校
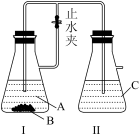
3 . 下列各图示中能较长时间观察到 的是
的是

 的是
的是
| A.①②③ | B.①②④ | C.①②③④ | D.②③④ |
您最近半年使用:0次
2022-12-26更新
|
2257次组卷
|
52卷引用:人教版(2019)高一必修第一册 第三章 第一节 铁及其化合物
人教版(2019)高一必修第一册 第三章 第一节 铁及其化合物鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第1节 铁的多样性鲁科版(2019)高一必修第一册第三章易错疑难集训(一)人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物(已下线)3.1.2 铁的重要化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(苏教版2019)必修第二册专题9 金属与人类文明 易错疑难集训(已下线)3.1.1 铁及其氧化物、氢氧化物-2021-2022学年高一化学课后培优练(人教版2019必修第一册)2016-2017学年宁夏育才中学高一上月考二化学卷2上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题1上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题2上海交通大学附属中学2017-2018学年高二上学期第一次月考化学试题上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题3(已下线)2018年11月8日 ——《每日一题》人教必修1铁的氢氧化物的性质和制备河北省承德市第一中学2018-2019学年高一上学期第三次月考化学试题上海市曹杨第二中学2018-2019学年高二上学期期中考试化学试题(已下线)2019年11月7日《每日一题》必修1—— 铁的氢氧化物的性质和制备陕西省商洛市山阳中学2019-2020学年高一上学期期中考试化学试题北京市2019—2020学年高一年级11月月考化学试题湖北省利川市第五中学2019-2020学年高一12月月考化学试题辽宁省盘锦市辽河油田第二高级中学2019-2020学年高一上学期期末考试化学试题(已下线)上海市上海交通大学附属中学2017-2018学年高二10月月考化学试题江苏省南通市白蒲高级中学2019-2020学年高一下学期期末复习化学试题(已下线)第03章 铁 金属材料(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)第三章 章末检测(2)——《高中新教材同步备课》(人教版 必修第一册)内蒙古壮族自治区乌兰察布市化德县第一中学2021届高三上学期期中考试化学试题云南省弥勒市第一中学黄冈校区2020-2021学年高一12月月考化学试题云南省曲靖市第二中学2020-2021学年高一上学期期末考试化学试题云南省云天化中学2020-2021学年高一下学期开学考试化学试题吉林省长春市第二十中学2020-2021学年高一上学期第三次考试化学试题四川省成都市实验外国语学校(西区)2019-2020学年高一上学期11月月考化学试题(已下线)专题3.1.2 铁的氧化物和氢氧化物(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)2016-2017学年湖南省长沙市长郡中学高一上学期期末考试化学试卷(已下线)5.2.2 重要的金属化合物(第2课时)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)安徽省六安市第一中学2021-2022学年高一下学期开学考试化学试题吉林省长春市第二中学2021-2022学年高一上学期期末化学试题河北省保定市唐县第一中学2021-2022学年高一下学期6月考试化学试题江西省安福县第三中学2021-2022学年高一上学期第二次月考化学试题(已下线)第三章 铁 金属材料(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)宁夏银川市第三十一中学2021-2022学年高一上学期期末学业检测化学试题山东省枣庄市滕州市第五中学2022-2023学年高一上学期第二次线上考试化学试题湖北省武汉外国语学校(武汉实验外国语学校)2022-2023学年高一上学期12月月考化学试题浙江省宁波市效实中学2022-2023学年高一上学期期中考试化学试题(已下线)【2023】【高一上】【浙附丁兰】【期末考】【高中化学】【赵优萍收集】9.2.2反应条件影响的探究(课前)-2019苏教版必修2课前课中课后(已下线)【知识图鉴】单元讲练测必修第一册第三单元01讲核心河北省邯郸市永年区第二中学2022-2023学年高一下学期5月月考化学试题(已下线)专题突破卷03?金属及其化合物?-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)考点巩固卷03 金属及其化合物(4大考点48题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)课时2 铁的重要化合物陕西省西安市第三十八中学2023-2024学年高一上学期第二次月考化学试卷12-2023新东方高二上期中考化学12河北省衡水市武强中学2023-2024学年高一上学期期末考试化学试题
13-14高一上·辽宁·期末
名校
解题方法
4 . 下列离子的检验方法合理的是
| A.向某溶液中滴入硫氰化钾溶液呈红色,说明不含Fe2+ |
| B.向某溶液中通入氯气,然后再加入硫氰化钾溶液变红色,说明原溶液中含有Fe2+ |
| C.向某溶液中加入氢氧化钠溶液,得红褐色沉淀,说明溶液中含有Fe3+ |
| D.向某溶液中加入氢氧化钠溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+ |
您最近半年使用:0次
2022-12-20更新
|
480次组卷
|
41卷引用:3.1.1 铁及其化合物练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)
(已下线)3.1.1 铁及其化合物练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 教材帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 教材帮专题9 第二单元 探究铁及其化合物的转化-高中化学必修第二册苏教版20199.2.1反应的合理选择(课中)-2019苏教版必修2课前课中课后第2课时 铁盐和亚铁盐作业(十七) 亚铁盐和铁盐(已下线)2012-2013学年辽宁省实验中学分校高一上学期期末考试化学试卷(已下线)2012-2013年黑龙江哈尔滨第十二中学高一上学期期末考试化学试卷2015-2016学年广东省汕头金山中学高一上期末化学试卷2015-2016学年山西省晋城市高平市特立高中高二下期中文科化学试卷2016-2017学年宁夏育才中学高一上月考二化学卷22016-2017学年江西省景德镇一中高一12月月考化学卷河北省邢台市第一中学2016-2017学年高二下学期第三次月考化学试题青海省西宁市第四高级中学2017-2018学年高一上学期第二次月考化学试题1宁夏育才中学孔德校区2017-2018学年高一12月月考化学试题青海省西宁二十一中2017-2018学年高一上学期12月月考化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密安徽省滁州市民办高中2018-2019学年高一上学期第三次月考化学试题【市级联考】吉林省公主岭市2018-2019学年高一上学期期末考试化学试题甘肃省武威第十八中学2018-2019学年高一上学期期末考试化学试题贵州省剑河县第二中学2018-2019学年高一上学期12月份考试化学试题(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测辽宁省本溪满族自治县高级中学2019-2020学年高二下学期期末考试化学试题湖北省宜昌市葛洲坝中学2021届高三9月月考化学试题陕西省汉中市洋县第二高级中学2020-2021学年高二上学期11月月考化学试题(已下线)练习13 铁铜的获取和应用-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)江西省南昌市新建一中2020-2021学年高一上学期第二次月考化学试题(已下线)专题05 金属及其重要化合物-备战2021届高考化学二轮复习题型专练(已下线)【浙江新东方】双师107(已下线)【浙江新东方】高中化学20210304-019黑龙江省牡丹江市第三中学2021-2022学年高二上学期第一次月考化学(文)试题陕西省武功县普集高级中学2021-2022学年高一上学期第二次月考化学试题湖北省咸丰春晖学校2022-2023学年高二上学期9月月考化学试题吉林江城中学2021-2022学年高三上学期9月月考化学试题浙江省丽水外国语学校高中部2021-2022学年高一下学期第一次阶段性考试(3月)化学试题山东省济南九中2022-2023学年高一第二次线上质量评估(12月份)化学试题(已下线)课时2 铁的重要化合物河北省高碑店市崇德实验中学2022-2023学年高一下学期期末考试化学试题化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷
名校
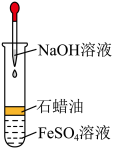
5 .  易被空气中的氧气氧化,故制备时主要是避免氧气的介入。某学生利用稀硫酸A、铁粉B和某碱溶液C在实验室设计了如图装置制备白色
易被空气中的氧气氧化,故制备时主要是避免氧气的介入。某学生利用稀硫酸A、铁粉B和某碱溶液C在实验室设计了如图装置制备白色 固体。
固体。
(1)写出 易被空气中的氧气氧化的方程式
易被空气中的氧气氧化的方程式_______ 。
(2)装置II盛放的溶液C是_______ (a.NaOH b. );配置该溶液时,为除去蒸馏水中溶解的
);配置该溶液时,为除去蒸馏水中溶解的 常采用的方法是
常采用的方法是_______ 。
(3)铁粉与稀硫酸制备 的离子方程式为
的离子方程式为_______ , 的作用有
的作用有_______ (填编号)。
a.驱赶装置内的空气
b.把物质B压入II中
c.保护白色 不被空气氧化
不被空气氧化
(4)白色 沉淀在
沉淀在_______ (填“锥形瓶I”或“锥形瓶II”)内生成,经在无氧环境中干燥处理,得到的白色 粉末是很好的化工
粉末是很好的化工_______ (填“除酸剂”或“除氧剂”)。
 易被空气中的氧气氧化,故制备时主要是避免氧气的介入。某学生利用稀硫酸A、铁粉B和某碱溶液C在实验室设计了如图装置制备白色
易被空气中的氧气氧化,故制备时主要是避免氧气的介入。某学生利用稀硫酸A、铁粉B和某碱溶液C在实验室设计了如图装置制备白色 固体。
固体。
(1)写出
 易被空气中的氧气氧化的方程式
易被空气中的氧气氧化的方程式(2)装置II盛放的溶液C是
 );配置该溶液时,为除去蒸馏水中溶解的
);配置该溶液时,为除去蒸馏水中溶解的 常采用的方法是
常采用的方法是(3)铁粉与稀硫酸制备
 的离子方程式为
的离子方程式为 的作用有
的作用有a.驱赶装置内的空气
b.把物质B压入II中
c.保护白色
 不被空气氧化
不被空气氧化(4)白色
 沉淀在
沉淀在 粉末是很好的化工
粉末是很好的化工
您最近半年使用:0次
2022-12-17更新
|
428次组卷
|
5卷引用:9.2.2反应条件影响的探究(课中)-2019苏教版必修2课前课中课后
6 . I.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
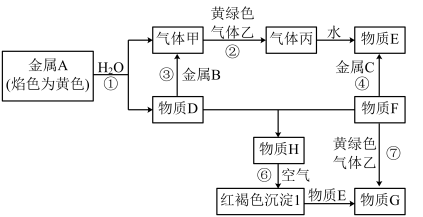
请回答下列问题:
(1)D溶液和F溶液在空气中混合的现象:_______ ;
(2)反应③的离子方程式:_______ ;
(3)反应⑦的离子方程式:_______ ;
(4)反应⑥的化学方程式:_______ 。
II.合金是由两种或两种以上的金属(或金属或非金属)熔合而成的具有金属特性的物质。一般来说,合金的熔点低于其中任何一个组成金属的熔点。下表是一些金属熔点的数据。
(5)铅锡合金中某种金属的质量分数与合金的熔点有如图所示的关系,其中横坐标表示的是_______ 的质量分数;当合金熔点最低时,合金中铅与锡的质量比为_______ 。

(6)保险丝由铋、铅、锡、镉等金属组成,其熔点约为_______。
(7)青铜器的主要成分是铜锡合金。崭新的青铜器呈土黄色。当青铜器长期埋在地下,逐渐形成了绿色的铜绿[主要成分Cu2(OH)2CO3],从其化学式可知铜绿是铜与_______ (填物质的化学式)长期作用的结果。

请回答下列问题:
(1)D溶液和F溶液在空气中混合的现象:
(2)反应③的离子方程式:
(3)反应⑦的离子方程式:
(4)反应⑥的化学方程式:
II.合金是由两种或两种以上的金属(或金属或非金属)熔合而成的具有金属特性的物质。一般来说,合金的熔点低于其中任何一个组成金属的熔点。下表是一些金属熔点的数据。
| 金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
| 熔点/℃ | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |

(6)保险丝由铋、铅、锡、镉等金属组成,其熔点约为_______。
| A.20~40℃ | B.60~80℃ | C.230~250℃ | D.300~320℃ |
您最近半年使用:0次
2022-12-07更新
|
114次组卷
|
2卷引用:9.3.2合金及其应用(课后)-2019苏教版必修2课前课中课后
解题方法
7 . 下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。
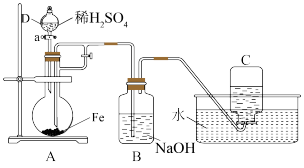
请回答下列问题:
(1)仪器D的名称为________ 。
(2)如何控制仪器D滴加稀硫酸的速度__________ 。
(3)A中反应一段时间后,关闭a,在B中即可得到Fe(OH)2。关闭a的操作不可太早,原因是__________ 。
(4)实验完毕,拔去B装置中的橡胶塞,通入空气,此时B装置中发生反应的化学方程式为__________ 。
(5)简述制取Fe(OH)2的过程及原理:__________ 。
(6)在下图中,装置④中FeSO4溶液上方加一层苯的作用是________ 。装置__________ (填序号)能较长时间观察到Fe(OH)2白色沉淀。


请回答下列问题:
(1)仪器D的名称为
(2)如何控制仪器D滴加稀硫酸的速度
(3)A中反应一段时间后,关闭a,在B中即可得到Fe(OH)2。关闭a的操作不可太早,原因是
(4)实验完毕,拔去B装置中的橡胶塞,通入空气,此时B装置中发生反应的化学方程式为
(5)简述制取Fe(OH)2的过程及原理:
(6)在下图中,装置④中FeSO4溶液上方加一层苯的作用是

您最近半年使用:0次
2022-12-05更新
|
539次组卷
|
2卷引用:作业(十七) 铁的单质、氧化物、氢氧化物
8 . 将下列有关铁及其化合物的性质或用途与所对应的物质连接起来________ 。
具有磁性的黑色固体 铁单质
用于治疗缺铁性贫血 三氧化二铁
涂料中的红色颜料 四氧化三铁
用于保存亚铁盐溶液 氢氧化亚铁
在空气中很不稳定 亚铁盐
遇KSCN溶液变色 铁盐
具有磁性的黑色固体 铁单质
用于治疗缺铁性贫血 三氧化二铁
涂料中的红色颜料 四氧化三铁
用于保存亚铁盐溶液 氢氧化亚铁
在空气中很不稳定 亚铁盐
遇KSCN溶液变色 铁盐
您最近半年使用:0次
9 . 铁的氢氧化物
(1)Fe(OH)2、Fe(OH)3的比较
(2)Fe(OH)2的制备
Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3.在实验室中制备Fe(OH)2,并使Fe(OH)2长时间保持白色沉淀状态,成功的关键有以下两点:
①溶液中不含Fe3+和O2等氧化性物质;
②制备过程中,保证生成的Fe(OH)2在密闭的隔绝空气的体系中。
(1)Fe(OH)2、Fe(OH)3的比较
| 名称 | Fe(OH)2 | Fe(OH)3 |
| 颜色 | ① | ② |
| 热稳定性 | —— | ③ |
| 水溶解性 | 难溶 | 难溶 |
| 制备(离子方程式) | ④ | ⑤ |
| 与盐酸反应(离子方程式) | ⑥ | ⑦ |
| 转化 | ⑧ | |
Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3.在实验室中制备Fe(OH)2,并使Fe(OH)2长时间保持白色沉淀状态,成功的关键有以下两点:
①溶液中不含Fe3+和O2等氧化性物质;
②制备过程中,保证生成的Fe(OH)2在密闭的隔绝空气的体系中。
您最近半年使用:0次
名校
解题方法
10 . 下列有关铁及其化合物的说法中正确的是
| A.铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| B.FeSO4溶液加入NaOH溶液可产生白色沉淀,迅速变成灰绿色,最终变成红褐色 |
| C.铁溶于盐酸可得到FeCl3溶液和H2 |
| D.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入Cu粉,然后过滤 |
您最近半年使用:0次
2022-09-22更新
|
555次组卷
|
5卷引用:实验活动2 铁及其化合物的性质



