1 . Fe3S4固体是一种重要的磁性材料,以它为原料实现如下化合物的转化: 的形式存在,溶液呈亮黄色。
的形式存在,溶液呈亮黄色。
请回答:
(1)依据B→C→D的现象,判断Cl-、SCN-、CN-与Fe3+的配位能力由强到弱依次为___________ ,无色酸性溶液F中的含硫阴离子有___________ 。
(2)Fe3S4能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标准状况下的密度为1.518g∙L-1),写出该反应的离子方程式___________ 。
(3)下列说法正确的是___________。
(4)写出F→G反应的化学方程式___________ 。请设计实验方案确定溶液G中的阴离子___________ 。

 的形式存在,溶液呈亮黄色。
的形式存在,溶液呈亮黄色。请回答:
(1)依据B→C→D的现象,判断Cl-、SCN-、CN-与Fe3+的配位能力由强到弱依次为
(2)Fe3S4能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标准状况下的密度为1.518g∙L-1),写出该反应的离子方程式
(3)下列说法正确的是___________。
| A.固体A中可能含有FeO | B.无色气体E能完全溶于水 |
| C.溶液C呈酸性,是由于Fe3+水解 | D.溶液B可溶解铜 |
(4)写出F→G反应的化学方程式
您最近一年使用:0次
名校
解题方法
2 . 下列离子方程式正确的是
| A.氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ |
B.氯气通入石灰乳制漂白粉: |
C.氢氧化铁溶于氢碘酸中: |
D.NaHSO4与Ba(OH) 2溶液反应至溶液呈中性: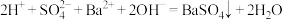 |
您最近一年使用:0次
2023-11-16更新
|
754次组卷
|
3卷引用:题型03 离子方程式正误判断 离子共存、检验和推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
(已下线)题型03 离子方程式正误判断 离子共存、检验和推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)浙江省名校协作体2023-2024学年高二上学期开学联考化学试题天津市实验中学2023-2024学年高三上学期第二次阶段检测化学试题
2023高三·全国·专题练习
解题方法
3 . 工业上用盐酸酸化的FeCl3溶液腐蚀铜制线路板,分别取腐蚀后的滤液并向其中加入下列指定物质,反应后的溶液中主要存在的一组离子正确的是
| A.加入过量CuO:Fe3+、H+、Cu2+、Cl- |
| B.加入过量NaOH溶液:Na+、Fe2+、OH-、Cl- |
| C.通入过量Cl2:Fe3+、H+、Cu2+、Cl- |
D.通入过量SO2:Fe2+、H+、Cu2+、SO 、Cl- 、Cl- |
您最近一年使用:0次
2023高三·全国·专题练习
4 . FeCl3溶液中滴加HI溶液:2Fe3++2HI=2Fe2++2H++I2。( )
您最近一年使用:0次
5 . 下列反应的离子方程式书写正确的是
A.等体积、等浓度的NaHSO4溶液与Ba(OH)2溶液混合:H++ +Ba2++OH-=BaSO4↓+H2O +Ba2++OH-=BaSO4↓+H2O |
| B.将Fe2O3溶于过量HI溶液:Fe2O3+6H+=2Fe3++3H2O |
C.向AgCl悬浊液中滴加足量Na2S溶液:AgCl(s)+S2-(aq) Ag2S(s)+Cl-(aq) Ag2S(s)+Cl-(aq) |
D.向酸性KMnO4溶液中滴加NaHSO3溶液:2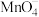 +5 +5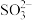 +6H+=2Mn2++5 +6H+=2Mn2++5 +3H2O +3H2O |
您最近一年使用:0次
名校
解题方法
6 . 铁铵矾[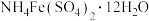 ]常用于制备高铁酸盐。下列反应的离子方程式正确的是
]常用于制备高铁酸盐。下列反应的离子方程式正确的是
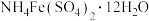 ]常用于制备高铁酸盐。下列反应的离子方程式正确的是
]常用于制备高铁酸盐。下列反应的离子方程式正确的是A.铁铵矾溶液与氨水混合反应: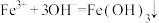 |
B.向铁铵矾溶液中通入 气体: 气体: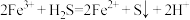 |
C.在强碱溶液中,铁铵矾与次氯酸钠反应生成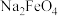 ; ;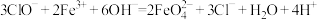 |
D.向铁铵矾溶液中加入过量 溶液: 溶液: |
您最近一年使用:0次
2023-03-23更新
|
2043次组卷
|
10卷引用:专题04 离子反应
(已下线)专题04 离子反应江苏省苏锡常镇四市2022-2023学年高三下学期教学情况调研(一)(3月)化学试题江苏省苏州中学2022-2023学年高一下学期期中考试化学试题江苏省黄埭中学2022-2023学年高一下学期期中调研测试化学试题江苏省南京市六校联合体2022-2023学年高一下学期期末联合调研化学试题江苏省常州高级中学 2022~2023学年高一下学期 5月阶段检测化学试题江苏省连云港高级中学2022-2023学年高二下学期第二次学情检测化学试题06 2024年苏州苏苑高级中学高一3月月考02 2024年苏州昆山一中高一3月月考江苏省南京市第一中学2023-2024学年高二下学期期中考试 化学试卷
2023高一·全国·专题练习
解题方法
7 . 下列有关铁元素的叙述中,正确的是
| A.自然界中存在赤铁矿、磁铁矿等铁矿石,说明铁的氧化物与水难以直接化合 |
| B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3 |
C.氢氧化铁与氢碘酸反应的化学方程式为 |
| D.将FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体 |
您最近一年使用:0次
8 . 在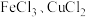 混合溶液中,加入铁粉与铜粉的混合物。
混合溶液中,加入铁粉与铜粉的混合物。
(1)若金属无剩余,则溶液中一定存在的金属阳离子有_______ ,可能存在的有_______ 。
(2)若剩余固体中有铁和铜,则溶液中一定存在的金属阳离子有_______ ,一定不存在_______ 。
(3)若剩余固体中只有铜,则溶液中一定存在的金属阳离子有_______ ,可能存在的有_______ ,一定不存在_______ 。
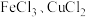 混合溶液中,加入铁粉与铜粉的混合物。
混合溶液中,加入铁粉与铜粉的混合物。(1)若金属无剩余,则溶液中一定存在的金属阳离子有
(2)若剩余固体中有铁和铜,则溶液中一定存在的金属阳离子有
(3)若剩余固体中只有铜,则溶液中一定存在的金属阳离子有
您最近一年使用:0次
9 . 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 在空气中点燃氢气,然后把导管伸入盛满氯气的集气瓶中 | 氢气安静地燃烧,发出淡蓝色火焰 | 燃烧反应不一定要有氧气参加 |
| B | 将一小块钠投入盛有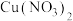 溶液的烧杯中 溶液的烧杯中 | 烧杯底部析出红色固体 | 金属活动性: |
| C | 向 溶液中逐滴加入少量稀 溶液中逐滴加入少量稀 | 溶液导电能力不断减弱 | 生成的 不能发生电离 不能发生电离 |
| D | 向盛有 溶液的试管中滴加无色的维生素C溶液 溶液的试管中滴加无色的维生素C溶液 | 溶液黄色褪去 | 维生素 具有还原性 具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-18更新
|
341次组卷
|
3卷引用:2022年重庆高考真题化学试题变式题(选择题6-10)
10 . 聚合硫酸铁是一种常用净水剂,其分子式可表示为 。以工业废铁屑(含少量
。以工业废铁屑(含少量 、FeS)为原料制取聚合硫酸铁的工艺流程如图1所示。
、FeS)为原料制取聚合硫酸铁的工艺流程如图1所示。
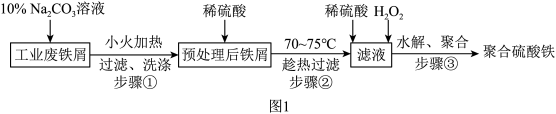
已知:硫酸亚铁的溶解度如表所示。
回答下列问题:
(1)步骤②将预处理后铁屑转移至三颈烧瓶,加入适量3mol·L
 溶液,水浴加热至70~75℃,直到不再有气泡产生。装置如图2所示。
溶液,水浴加热至70~75℃,直到不再有气泡产生。装置如图2所示。
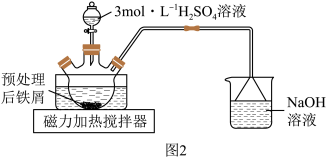
盛放3mol·L
 溶液的仪器名称为
溶液的仪器名称为___________ 。装置中用到的热源是磁力加热搅拌器,不宜使用酒精灯,是因为___________ 。
(2)步骤②趁热过滤所得的滤渣的主要成分为___________ (填化学式);过滤需要趁热的原因是___________ 。
(3)向步骤②所得滤液中滴加几滴KSCN溶液,无明显现象,是因为___________ (用离子方程式表示)。
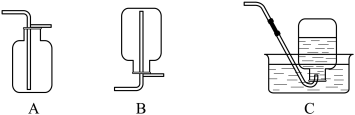
(4)向滤液中滴加少量稀硫酸,分批加入 ,边加边搅拌,直到出现少量气泡。滤液中开始时发生反应的离子方程式为
,边加边搅拌,直到出现少量气泡。滤液中开始时发生反应的离子方程式为___________ 。后期出现少量气泡的原因是___________ (用化学方程式表示),收集该气体的装置为___________ (填标号)。
(5)经上述处理后的溶液先水解后聚合得到红棕色黏稠液体即聚合硫酸铁,则水解产生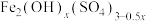 的化学方程式为
的化学方程式为___________ 。
 。以工业废铁屑(含少量
。以工业废铁屑(含少量 、FeS)为原料制取聚合硫酸铁的工艺流程如图1所示。
、FeS)为原料制取聚合硫酸铁的工艺流程如图1所示。
已知:硫酸亚铁的溶解度如表所示。
| T/℃ | 10 | 20 | 30 | 40 | 50 |
| S/g | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 |
回答下列问题:
(1)步骤②将预处理后铁屑转移至三颈烧瓶,加入适量3mol·L

 溶液,水浴加热至70~75℃,直到不再有气泡产生。装置如图2所示。
溶液,水浴加热至70~75℃,直到不再有气泡产生。装置如图2所示。
盛放3mol·L

 溶液的仪器名称为
溶液的仪器名称为(2)步骤②趁热过滤所得的滤渣的主要成分为
(3)向步骤②所得滤液中滴加几滴KSCN溶液,无明显现象,是因为
(4)向滤液中滴加少量稀硫酸,分批加入
 ,边加边搅拌,直到出现少量气泡。滤液中开始时发生反应的离子方程式为
,边加边搅拌,直到出现少量气泡。滤液中开始时发生反应的离子方程式为
(5)经上述处理后的溶液先水解后聚合得到红棕色黏稠液体即聚合硫酸铁,则水解产生
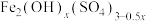 的化学方程式为
的化学方程式为
您最近一年使用:0次



