名校
解题方法
1 . 已知:2Fe3++2I- ==2Fe2+ +I2 ,2Fe2++Br2 ==2Fe3++2Br-。向含等物质的量浓度的FeI2、FeBr2混合溶液中通入一定量的氯气后,再滴加少量的KSCN溶液,溶液变红色,则下列方程式书写不合理的是( )
| A.2Fe2++4I- +3Cl2==2Fe3+ +2I2+6Cl- | B.2Br-+2I-+2Fe2++3Cl2== I2+Br2+2Fe3++6Cl- |
| C.2Br-+4I-+2Fe2++4Cl2== 2I2+Br2+2Fe3++8Cl- | D.2I-+2Fe2+ +2Cl2 ==2Fe3++ I2+4Cl- |
您最近一年使用:0次
2018-05-25更新
|
942次组卷
|
4卷引用:学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检测
(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检测(已下线)专题04 氧化还原反应及其应用(练)-2023年高考化学二轮复习讲练测(新高考专用)【全国百强校】宁夏银川一中2018届高三第三次模拟考试理综化学试题河北省承德市第一中学2018-2019学年高二下学期第三次月考化学试题
解题方法
2 . (2018·北京市西城区4月一模)下列解释事实的方程式书写正确的是
| A.Na2CO3溶液处理水垢中的CaSO4:Ca2+ + CO32− == CaCO3↓ |
| B.Na2O2作呼吸面具的供氧剂:2Na2O2 + 2CO2 == 2 Na2CO3 + O2 |
| C.稀HNO3洗涤做过银镜反应的试管:Ag + 2H+ + NO3− == Ag+ + NO2↑ + H2O |
| D.FeCl3溶液腐蚀线路板:Fe3+ + Cu == Fe2+ + Cu2+ |
您最近一年使用:0次
2014高三·全国·专题练习
名校
3 . 将1.12 g铁粉加入25 mL 2mol/L的氯化铁溶液中,充分反应后,其结果是
| A.铁有剩余,溶液呈浅绿色,Cl- 浓度基本不变 |
| B.往溶液中滴入无色KSCN溶液,显黄色 |
| C.氧化产物与还原产物的物质的量之比为2∶5 |
| D.Fe2+和Fe3+的物质的量之比为6∶1 |
您最近一年使用:0次
2017-12-13更新
|
745次组卷
|
18卷引用:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷
(已下线)2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(已下线)2014年高考化学苏教版总复习 3-2 铁、铜的获取和应用练习卷2015届福建省武平县第一中学高三上学期12月月考化学试卷2015-2016学年山东省滕州市第二中学高一上学期12月月考化学试卷2015-2016学年河北省冀州中学高一上第五次月考化学试卷2015-2016学年辽宁沈阳市第二中学高二下期末考化学卷2017届宁夏石嘴山三中高三上学期第一次月考化学试卷2016年山东省普通高中学业水平化学模拟试卷(4)2016-2017学年河北石家庄辛集中学高一上阶段考二化学卷2016-2017学年江西省景德镇一中高一12月月考化学卷山西省忻州市第一中学2016-2017学年高一必修一:3.1.3金属的化学性质同步练习化学试题河北省辛集中学2017-2018学年高一上学期12月月考化学试题上海市复旦大学附中2017-2018学年高二上学期期中考试化学试题安徽省滁州市定远县炉桥中学2019—2020学年高一上学期期末检测化学试题人教版(2019)高一必修第一册 第三章 第一节 铁及其化合物鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第1节 铁的多样性天津市第八中学2020-2021学年高一上学期第三次统练化学试题宁夏石嘴山市第三中学2020-2021学年高一上学期第二次月考化学试题
名校
4 . 在复杂的体系中,确认化学反应先后顺序有利于解决问题。下列化学反应先后顺序判断正确的是
| A.在含有等物质的量的A1O2-、OH-、CO32-溶液中逐滴加入盐酸: OH-、CO32-、A1O2- |
| B.在含等物质的量的FeBr2、FeI2溶液中缓慢通入氯气: I-、Br-、Fe2+ |
| C.Fe(NO3)3、Cu(NO3)2、HNO3混合溶液中逐渐加入铁粉: Fe(NO3)3、HNO3、Cu(NO3)2 |
| D.在含等物质的量的Fe3+、NH4+、H+溶液中逐滴加入NaOH溶液: H+、Fe3+、NH4+ |
您最近一年使用:0次
2017-12-06更新
|
388次组卷
|
5卷引用:2020届高三化学二轮复习 氧化还原反应过关检测(强化训练)
5 . 下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中,K+、Fe2+、I—、Br—可以大量共存 |
| B.用该溶液中溶解一定量铜粉,向所得溶液中再加入铁粉,若溶液中有Cu2+,则一定没有固体析出 |
| C.将该溶液蒸干,得到的固体中混有氢氧化铁 |
| D.100mL 0.1 mol/L该溶液和足量的Zn充分反应,生成1.12 gFe |
您最近一年使用:0次
2016-12-09更新
|
372次组卷
|
5卷引用:2020届高三化学无机化学二轮专题复习——铁及其化合物的相关计算2【精编24题】
6 . 下列化学反应先后顺序判断正确的是( )
| A.含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH溶液:H+、Al3+、Al(OH)3 |
| B.含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气: I-、Br-、Fe2+ |
| C.含有等物质的量的NaCl、Na2S的溶液中加入AgNO3溶液:NaCl、Na2S |
| D.含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+ |
您最近一年使用:0次
2016-12-09更新
|
931次组卷
|
6卷引用:二轮复习 专题3 氧化还原反应 押题专练
(已下线)二轮复习 专题3 氧化还原反应 押题专练(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(押题专练)(已下线)专题04 离子反应(缺项配平、离子检验、离子推断、共存)-2021年高考化学必做热点专题(已下线)专题34 分类例析元素化合物综合应用试题中存在的陷阱-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)2015届湖北省七市(州)教科研协作体4月高三联合考试理综化学试卷2016届河南省三门峡市陕州中学高三上学期第二次精英对抗赛化学试卷
名校
7 . 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
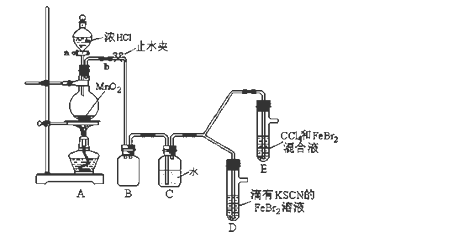
(1)①装置A中发生反应的离子方程式是_____________________ 。
②整套实验装置存在一处明显的不足,请指出_______________________ 。
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化 。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________ ,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________ 溶液,若溶液颜色________ ,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式 (离子或化学方程式不限定)解释产生白色沉淀原因__________________ 、_______________________

(1)①装置A中发生反应的离子方程式是
②整套实验装置存在一处明显的不足,请指出
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由 |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN- Fe(SCN)3 是一个可逆反应。 Fe(SCN)3 是一个可逆反应。ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。 ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 ⅳ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用
您最近一年使用:0次
2016-12-09更新
|
1550次组卷
|
5卷引用:2020届高三化学二轮复习实验题必练-铁及其化合物
9-10高三·湖南·阶段练习
名校
8 . 将适量的SO2通入Fe(NO3)3中,溶液逐渐由棕黄色变为浅绿色,但又立即变为棕黄色,继续滴入BaCl2溶液,产生白色沉淀。在上述一系列变化过程中,最终被还原的元素是
| A.S | B.Fe | C.Cl | D.N |
您最近一年使用:0次
2016-12-09更新
|
2664次组卷
|
13卷引用:夯基提能2020届高三化学选择题对题专练——氧化还原反应的综合分析
夯基提能2020届高三化学选择题对题专练——氧化还原反应的综合分析(已下线)炎德?英才大联考三湘名校2010届高三月考试卷(一)(已下线)2011届浙江省杭州师范大学附属中学高三上学期第一次月考化学卷(已下线)2013届浙江省绍兴一中分校高三10月学习质量诊断化学试卷2016届辽宁师范大学附属中学高三上学期期中考试化学试卷2016-2017学年安徽省黄山屯溪一中高二上开学测化学试卷苏教版(2020)高一必修第一册专题4 总结检测鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第2节 硫的转化 综合训练高一必修第二册(人教2019版)第五章 第一节 硫及其化合物 综合训练山西省太原市第五中学2021届高三上学期9月阶段性考试化学试题(已下线)第四章 非金属及其化合物(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版必修1)人教版2019必修第二册 第五章 本章达标检测广东省佛山市顺德李兆基中学2020-2021学年高一3月月考化学试卷
11-12高一上·河北衡水·期末
名校
9 . 向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 molFe,充分搅拌后Fe溶解,溶液中不存在Fe3+,同时析出0.1 mol Ag。下列结论错误的是
| A.氧化性:Zn2+>Cu2+>Fe3+>Ag+ | B.Fe3+的氧化性大于Cu2+ |
| C.溶液中Cu2+与Fe2+的物质的量比为1∶2 | D.1 mol Fe可还原2 mol Fe3+ |
您最近一年使用:0次
2016-12-09更新
|
1013次组卷
|
12卷引用:解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)2010—20111学年河北省衡水中学高一上学期期末考试化学试卷(已下线)2010—2011学年浙江省杭州二中高一下学期期中考试化学试卷(已下线)2011-2012学年辽宁省沈阳东北育才学校高一上学期期中考试化学试卷宁夏银川一中2017-2018学年高一上学期期末考试化学试题黑龙江省伊春中学2017-2018学年高一化学上学期期末考试题宁夏回族自治区青铜峡市高级中学2018-2019学年高一上学期期末考试化学试题安徽省合肥十一中2018-2019学年高二分班考试化学试题云南省大理市下关第一中学2019-2020学年高一上学期期末考试化学试题宁夏银川一中2021-2022学年高一上学期期末考试化学试题宁夏石嘴山三中2016届高三(上)第四次质检化学试卷(解析版)
真题
解题方法
10 . 某研究性学习小组在网上收集到如下信息: 溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与 溶液反应,发现银镜溶解。
溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是_______________ 。
a. 边振荡盛有2%的 溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2ml乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
【提出假设】
假设1: 具有氧化性,能氧化Ag。
具有氧化性,能氧化Ag。
假设2: 溶液显酸性,在此酸性条件下
溶液显酸性,在此酸性条件下 能氧化Ag。
能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出 ,验证了假设1的成立。请写出
,验证了假设1的成立。请写出 氧化Ag的离子方程式:
氧化Ag的离子方程式:_________________________________ 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论: 溶液中的
溶液中的 和
和 都氧化了Ag。你是否同意丙同学的结论,并简述理由:
都氧化了Ag。你是否同意丙同学的结论,并简述理由:_________________________________________________ 。
 溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:【实验】制作银镜,并与
 溶液反应,发现银镜溶解。
溶液反应,发现银镜溶解。(1)下列有关制备银镜过程的说法正确的是
a. 边振荡盛有2%的
 溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止b.将几滴银氨溶液滴入2ml乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
【提出假设】
假设1:
 具有氧化性,能氧化Ag。
具有氧化性,能氧化Ag。假设2:
 溶液显酸性,在此酸性条件下
溶液显酸性,在此酸性条件下 能氧化Ag。
能氧化Ag。【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出
 ,验证了假设1的成立。请写出
,验证了假设1的成立。请写出 氧化Ag的离子方程式:
氧化Ag的离子方程式:(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:
 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② | 若银镜消失,假设2成立 若银镜不消失,假设2不成立 |
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:
 溶液中的
溶液中的 和
和 都氧化了Ag。你是否同意丙同学的结论,并简述理由:
都氧化了Ag。你是否同意丙同学的结论,并简述理由:
您最近一年使用:0次
2016-12-09更新
|
911次组卷
|
6卷引用:考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)
(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)2010年高考试题理综化学部分(安徽卷)(已下线)2010年6月浙江省金温七校高二化学期末卷2010年高考化学试题分项专题五 氧化还原反应2010年高考化学试题分项专题十一 金属元素及其化合物(已下线)2011届广东省增城中学高三第一次综合测试理综)化学试题



