名校
1 . 二氧化硫是形成酸雨的罪魁祸首之一,含硫煤燃烧的尾气处理一直是化学研究的重要课题。某工厂设计了新的治污方法,该工艺流程如图所示,下列叙述不正确的是( )
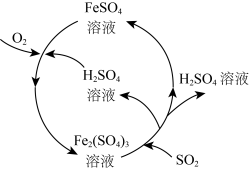

A.该过程中可得到化工产品 |
B.该工艺流程中 可以循环利用 可以循环利用 |
C.若处理含 的尾气,理论上需要通入相同条件下的空气约 的尾气,理论上需要通入相同条件下的空气约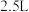 |
| D.可用澄清石灰水检验最终排出的气体是否含有二氧化硫 |
您最近一年使用:0次
2020-02-16更新
|
264次组卷
|
3卷引用:2020届高三化学无机化学二轮专题复习——铁盐及亚铁盐的性质2【精编25题】
名校
解题方法
2 . 常温下,铝土矿 含有
含有 、FeO、
、FeO、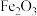 、
、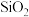 等物质
等物质 用硫酸浸。下列说法中错误的是
用硫酸浸。下列说法中错误的是

 含有
含有 、FeO、
、FeO、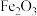 、
、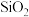 等物质
等物质 用硫酸浸。下列说法中错误的是
用硫酸浸。下列说法中错误的是

A.向浸出后的溶液加入过量NaOH溶液后存在: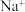 、 、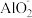 、 、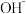 、 、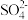 |
B.向浸出后的溶液加入过量氨水后存在: 、 、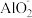 、 、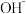 、 、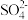 |
C.向浸出后的溶液通入过量HI后存在: 、 、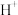 、 、 、 、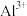 、 、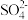 |
D.若铝土矿改用NaOH溶液浸,浸出后的溶液中存在: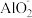 、 、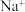 、 、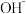 、 、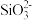 |
您最近一年使用:0次
2020-02-06更新
|
241次组卷
|
6卷引用:夯基提能2020届高三化学选择题对题专练——氧化还原反应的实际应用(提升练)
名校
3 . 关于反应过程中的先后顺序,下列评价正确的是
| A.向浓度都为0.1mol/L的FeCl3和CuCl2加入铁粉,溶质CuCl2首先与铁粉反应 |
| B.向过量的Ba(OH)2溶液中滴加少量的KAl(SO4)2溶液,开始没有白色沉淀生成 |
| C.向浓度都为0.1mol/L 的Na2CO3和NaOH的混合溶液通入CO2气体,NaOH首先反应 |
| D.向浓度为0.1mol/L的FeCl3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应 |
您最近一年使用:0次
2019-12-24更新
|
399次组卷
|
20卷引用:专题1.3 氧化还原反应(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升
专题1.3 氧化还原反应(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)模块四 金属及其化合物(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)【全国省级联考】辽宁省部分重点高中2019届高三9月联考化学试题【全国百强校】四川省成都市双流区棠湖中学2019届高三上学期第一次月考理科综合化学试题山东省济南市济钢高中2019届高三上学期10月份质量检测化学试题河南省许昌高级中学2020届高三上学期第一次月考化学试题辽宁省抚顺市第十中学2018-2019学年高二下学期期中考试化学试题河北省隆化县存瑞中学2020届高三上学期第一次质检化学试题山东省济宁市2020届高三10月月考化学试卷山东省济宁市邹城第一中学2020届高三10月月考化学试题山东省莱阳市第一中学2020届高三10月月考化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题河南省信阳市罗山县高级中学老校区2020届高三第七次模拟考试化学试题辽宁省朝阳市建平县第二高级中学2020届高三上学期期中考试化学试题河北省石家庄市行唐县三中2020届高三11月月考化学试题甘肃省张掖市第二中学2020届高三上学期11月月考化学试题河北省安平中学2019-2020学年高一上学期第四次月考化学试题甘肃省武威第一中学2020届高三12月月考化学试题江西省南昌市进贤一中2019-2020学年高一上学期第二次月考化学试题山东省日照市五莲县2020届高三上学期10月模块诊断性测试化学试题
名校
4 . 下列有关物质性质与用途具有对应关系的是
| A.SO2具有氧化性,可用于漂白纸浆 |
| B.Si的熔点高,可用作半导体材料 |
| C.FeCl3溶液显酸性,可用于蚀刻铜制的电路板 |
| D.漂白液中含有强氧化性物质,可作漂白剂和消毒剂 |
您最近一年使用:0次
2019-11-19更新
|
323次组卷
|
4卷引用:2020届高三《新题速递·化学》12月第01期(考点01-06)
名校
5 . 下列有关铜的化合物说法正确的是( )
| A.根据铁比铜金属性强,在实际应用中可用FeCl3腐蚀Cu刻制印刷电路板 |
B.CuSO4溶液与H2S溶液反应的离子方程式为:Cu2++S2- CuS↓ CuS↓ |
| C.用稀盐酸除去铜锈的离子方程式为CuO+2H+===Cu2++H2O |
D.化学反应:CuO+CO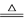 Cu+CO2的实验现象为黑色固体变成红色固体 Cu+CO2的实验现象为黑色固体变成红色固体 |
您最近一年使用:0次
2019-07-16更新
|
661次组卷
|
6卷引用:考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)黑龙江省大庆市铁人中学2018-2019学年高二下学期期末考试化学试题【全国百强校】黑龙江省大庆市铁人中学2020届高三上学期开学考试化学试题海南省儋州市第一中学2020届高三上学期第二次月考化学试卷黑龙江省鹤岗市第一中学2019-2020学年高二下学期期末考试化学试题黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期开学考试化学试题
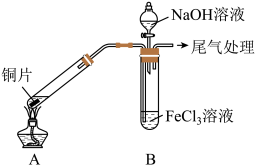
6 . 某校化学兴趣小组探究 与
与 溶液的反应,所用装置如下图所示
溶液的反应,所用装置如下图所示 夹持仪器已略去
夹持仪器已略去 。
。
 实验室配制和保存
实验室配制和保存 溶液应滴加少许
溶液应滴加少许______ 于试剂瓶中。
 实验过程中需要配制
实验过程中需要配制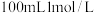
 溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、
溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、______ 。
 该小组同学向5mL
该小组同学向5mL 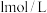
 溶液中通入足量的
溶液中通入足量的 ,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是
,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是______ 。
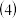 该小组同学在
该小组同学在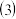 中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
【查阅资料】 离子在溶液中呈红棕色且具有较强的还原性,能被
离子在溶液中呈红棕色且具有较强的还原性,能被 氧化为
氧化为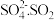 与
与 溶液反应生成红棕色
溶液反应生成红棕色 离子的离子方程式是
离子的离子方程式是______ ; 与
与 在溶液中反应的离子方程式是
在溶液中反应的离子方程式是______ 。
 为了安全起见,还可以在A、B装置之间加一个
为了安全起见,还可以在A、B装置之间加一个______ 装置。
 若实验中用5mL一定浓度的浓
若实验中用5mL一定浓度的浓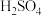 与适量Cu片充分反应,实验结束后,测得产生
与适量Cu片充分反应,实验结束后,测得产生 的体积在标准状况下为672mL,向已冷却的A试管溶液中加入
的体积在标准状况下为672mL,向已冷却的A试管溶液中加入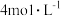 的NaOH溶液30mL时,恰好使
的NaOH溶液30mL时,恰好使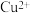 完全沉淀。则所用浓
完全沉淀。则所用浓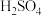 浓度为
浓度为______ 。 忽略过程中溶液的体积变化
忽略过程中溶液的体积变化
 与
与 溶液的反应,所用装置如下图所示
溶液的反应,所用装置如下图所示 夹持仪器已略去
夹持仪器已略去 。
。 实验室配制和保存
实验室配制和保存 溶液应滴加少许
溶液应滴加少许 实验过程中需要配制
实验过程中需要配制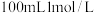
 溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、
溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、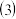 该小组同学向5mL
该小组同学向5mL 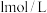
 溶液中通入足量的
溶液中通入足量的 ,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是
,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是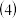 该小组同学在
该小组同学在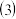 中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。【查阅资料】
 离子在溶液中呈红棕色且具有较强的还原性,能被
离子在溶液中呈红棕色且具有较强的还原性,能被 氧化为
氧化为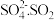 与
与 溶液反应生成红棕色
溶液反应生成红棕色 离子的离子方程式是
离子的离子方程式是 与
与 在溶液中反应的离子方程式是
在溶液中反应的离子方程式是 为了安全起见,还可以在A、B装置之间加一个
为了安全起见,还可以在A、B装置之间加一个
 若实验中用5mL一定浓度的浓
若实验中用5mL一定浓度的浓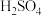 与适量Cu片充分反应,实验结束后,测得产生
与适量Cu片充分反应,实验结束后,测得产生 的体积在标准状况下为672mL,向已冷却的A试管溶液中加入
的体积在标准状况下为672mL,向已冷却的A试管溶液中加入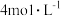 的NaOH溶液30mL时,恰好使
的NaOH溶液30mL时,恰好使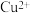 完全沉淀。则所用浓
完全沉淀。则所用浓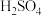 浓度为
浓度为 忽略过程中溶液的体积变化
忽略过程中溶液的体积变化
您最近一年使用:0次
2019-03-28更新
|
369次组卷
|
3卷引用:2020届人教版高三化学二轮复习非选择题专攻练——化学实验设计与评价的综合应用1
7 . 某小组同学对FeCl3与KI的反应进行探究。
【初步探究】室温下进行下表所列实验。
(1)证明实验Ⅰ中有I2生成,加入的试剂为 __________ 。
(2)写出实验Ⅰ反应的离子方程式:_________________ 。
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是_____________________ 。
【深入探究】20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:________ ,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素 可能是_____________ (写出两条)。
(5)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I- + I2 I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________ 。
(6)丙同学针对20 min后的实验现象继续提出假设:FeCl3与KI的反应、I-与I2的反应达到平衡需要一段时间,有可能20 min之前并未达到平衡。为验证该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液体系,具体实验方案为__________________ 。
【初步探究】室温下进行下表所列实验。
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 取5 mL 0.1 mol·L-1 KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5) | 溶液变为棕黄色 |
| 实验Ⅱ | 取2 mL实验Ⅰ反应后的溶液,滴加2滴0.1 mol·L-1 KSCN溶液 | 溶液呈红色 |
(2)写出实验Ⅰ反应的离子方程式:
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是
【深入探究】20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:
(5)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I- + I2
 I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:(6)丙同学针对20 min后的实验现象继续提出假设:FeCl3与KI的反应、I-与I2的反应达到平衡需要一段时间,有可能20 min之前并未达到平衡。为验证该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液体系,具体实验方案为
您最近一年使用:0次
2019-03-27更新
|
637次组卷
|
3卷引用:2020届高三化学二轮复习实验题必练-化学平衡
2020届高三化学二轮复习实验题必练-化学平衡【区级联考】北京市海淀区2019届高三下学期适应性训练化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题05-2020年北京新高考化学模拟试题
名校
8 . 把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+ 和Fe3+的物质的量浓度之比为3:1,则已反应的Fe3+和未反应的Fe3+的物质的量之比为
| A.1:1 | B.2:3 | C.2:1 | D.3:2 |
您最近一年使用:0次
2019-02-06更新
|
921次组卷
|
23卷引用:易错专题21 铁单质的性质-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)
(已下线)易错专题21 铁单质的性质-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)天津市静海县第一中学2017-2018学年高一12月学生学业能力调研考试化学试题山东省桓台县2017-2018学年高一上学期期末考试化学试题山东省桓台第二中学2017-2018学年高一上学期期末考试化学试题辽宁省抚顺中学2017-2018学年高一上学期期末考试化学试题黑龙江省牡丹江中学2017-2018学年高一上学期期末考试化学试题【全国百强校】云南省玉溪市第一中学2018-2019学年高一上学期第一次月考化学试题【市级联考】湖北省天门市、潜江市2018-2019学年高一上学期12月月考化学试题【全国百强校】湖北省荆州中学2018-2019学年高一上学期期末考试化学试题河南省许昌市第三高级中学2019-2020学年高一下学期期末考试化学试题人教版(2019)高一必修第一册 第三章 第一节 铁及其化合物鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第1节 铁的多样性(已下线)第三章 铁 金属材料(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版2019必修第一册)(已下线)3.2.3 铁的重要化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)(已下线)3.1.2 铁的重要化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)安徽省合肥一六八中学2020-2021学年高一上学期期末调研化学试题湖南省常德市芷兰实验中学2020-2021学年高一上学期期末考试化学试题吉林省长春市第二实验中学2020-2021学年高一下学期开学考试化学试题浙江省淳安县汾口中学2020-2021学年高一12月阶段考试化学试题浙江省浙北G2(湖州中学、嘉兴一中)2021-2022学年高一上学期期中联考化学试题新疆喀什地区疏附县2021-2022学年高一上学期1月测试化学试题四川省宜宾市叙州区第一中学校2022-2023学年高一上学期第三次月考试化学试题作业(十八) 铁盐和亚铁盐
真题
名校
9 . 下列文字表述与反应方程式对应且正确的是( )
| A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ |
| B.用醋酸除去水垢:CaCO3+ 2H+=Ca2++ H2O + CO2↑ |
| C.利用腐蚀法制作印刷线路板:Fe3++ Cu = Fe2++ Cu2+ |
D.实验室用液溴和苯在催化剂作用下制溴苯: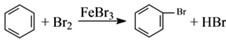 |
您最近一年使用:0次
2019-01-30更新
|
1371次组卷
|
7卷引用:江西省玉山县第一中学2017届高三化学板块复习测试:基本概念
江西省玉山县第一中学2017届高三化学板块复习测试:基本概念四川省南充市阆中中学2020届高三化学选择题专项训练(24)2008年普通高等学校招生统一考试化学试题(江苏卷)(已下线)09~10年锦州一中高二下学期期中考试化学卷(已下线)2010年云南省个旧一中高二上学期期中检测化学卷(已下线)2010—2011学年吉林省长春十一中高二上学期期末考试化学试卷(已下线)2012-2013学年辽宁省丹东市宽甸二中高二4月月考(一)化学试卷
名校
10 . 根据下列实验:
①向Fe2(SO4)3和CuSO4的混合液中加入过量铁粉,充分反应,有红色固体析出,过滤。
②取①中滤液,向其中滴加KSCN溶液,观察现象。
判断下列说法正确的是( )
①向Fe2(SO4)3和CuSO4的混合液中加入过量铁粉,充分反应,有红色固体析出,过滤。
②取①中滤液,向其中滴加KSCN溶液,观察现象。
判断下列说法正确的是( )
| A.氧化性Cu2+>Fe3+ | B.①中所得固体只含铜 |
| C.①中滤液含有Cu2+和Fe2+ | D.②中不会观察到溶液变红 |
您最近一年使用:0次
2018-11-13更新
|
1499次组卷
|
12卷引用:2020届高考化学知识点必练——氧化还原反应的规律
2020届高考化学知识点必练——氧化还原反应的规律【区级联考】北京市海淀区2019届高三第一学期期中考试化学试题【区级联考】北京市海淀区2019届高三上学期期中考试化学试题【全国百强校】吉林省实验中学2018-2019学年高一上学期期末考试化学试题四川省成都外国语学校2018-2019学年高二5月月考化学试题河南省洛阳市第四十三中学2022届高三上学期开学考试化学试题北京市第二十二中学2021-2022学年高三上学期10月月考化学试题(已下线)3.1.2铁及其化合物-同步学习必备知识江苏省南京市人民中学2021-2022学年高一上学期7月第一阶段学情监测试题9.2.1反应的合理选择(课后)-2019苏教版必修2课前课中课后北京市第一五六中学2021-2022学年高三上学期期中考试化学试题北京市东城区东直门中学2021-2022学年高三上学期期中考试化学试题



